计算弥散加权成像联合瘤周DWI高信号征象评估胶质瘤IDH-1基因分型的临床应用
王晓青 曹梦秋 程佳慧 张一铭 吴 洪 张晓华 周 滟
胶质瘤是最常见的原发性中枢神经系统肿瘤。2016 年版世界卫生组织(WHO)中枢神经系统肿瘤分类在组织病理学的基础上,联合分子表型进行分类,且分子表型在证据级别上优于组织学形态,新版的肿瘤分类延续了此分类原则[1-2]。在胶质瘤的诊断中,最为重要的是异柠檬酸脱氢酶(isocitrate dehydrogenase, IDH)基因[1]。相比IDH-1 突变型,同级别的IDH-1 野生型胶质瘤对放化疗的敏感性更低、复发转移发生率更高、整体生存期更短,并且IDH-1 基因更有望成为治疗靶点[3-4]。如何使整合了分子基因型的弥漫型胶质瘤分类在分级诊断中继续发挥作用,并找到合适的影像学标志物对IDH基因突变亚型作出预测,对胶质瘤患者的个体化治疗及预后评估具有重要意义。
在增强磁共振成像中,钆对比剂的强化仅代表了肿瘤区域血脑屏障的破坏,并不能反映肿瘤的真实浸润边界,这也为胶质瘤边界的判定及手术方案的制定带来极大不确定性。磁共振弥散加权成像(diffusionweighted imaging, DWI)已广泛应用于脑肿瘤组织异质性及恶性程度的评估[5]。近年来有学者提出,高b值条件下,肿瘤周围非强化区域出现的DWI 高信号(nonenhancing peritumoral DWI hyperintense, NePDH)征象提示了胶质瘤向周围正常组织的浸润程度,且该影像学征象出现的位置与肿瘤术后复发转移的位置密切相关[6-7]。但较低b值的DWI图像受T2穿透效应的影响,不能区分血管源性脑水肿与异常DWI 高信号,因此不适用于NePDH 征象的判读[8]。高b 值DWI 扫描时间相对较长且图像信噪比(signal to noise ratio,SNR)较差,故常规临床磁共振检查往往使用800~1 000 s/mm2的b 值而不进行高b 值的扫描。这些因素大大限制了NePDH征象在临床中的应用[7,9]。
计算弥散加权磁共振成像(computed DWI,cDWI)是指通过线性拟合至少包含2 个较低b 值的DWI图像,合成任意b 值cDWI 图像的技术[10]。既往的研究表明,利用cDWI技术拟合得到的高b值cDWI图像不仅能够避免增加扫描时间,且图像SNR 及病灶清晰度均明显优于同样b 值下扫描得到的DWI 图像,有助于提高诊断的灵敏度和特异度[9]。因此,本研究拟运用cDWI 技术将低b 值DWI 图像拟合得到高b 值的cDWI 图像,在高b 值cDWI 上进行NePDH 征象的判读,进而评价cDWI 图像上该NePDH 征象与胶质瘤IDH-1基因型的相关性。
方 法
1.临床资料
回顾性分析2018 年3 月至2020 年5 月我院60 例经手术病理证实的胶质瘤患者,所有患者均签署研究知情同意书。纳入标准:①所有患者均在GE HDxt 3.0 T 超导型MR 成像设备上行常规MR 平扫、增强及DWI 扫描(b=0、1 000、3 000 s/mm2)。②MR 检查前患者未接受过手术、放化疗、抗肿瘤药物等治疗。③所需分子病理学资料完整。依据分子病理结果分为IDH-1 突变型(25 例,年龄22~73 岁)和IDH-1 野生型(35例,年龄19~76岁)。
2.MR检查方法
使用美国GE HDxt 3.0 T超导型MR成像设备,采用标准8 通道相控阵头部线圈。扫描序列:T1WI、T2WI、T2 液体衰减反转恢复(T2-FLAIR),增强后T1WI 及DWI。主要扫描参数:①T1WI 序列,TR 137 ms,TE 2.49 ms,层厚5 mm,层数22。②T2WI序列,TR 4 500 ms,TE 103 ms,层厚5 mm,层数22。③T2-FLAIR 序列,TR 8 000 ms,TE 96 ms,层厚5 mm,层数22。④DWI 采用自旋回波平面成像技术,TR 4 850 ms,TE 74 ms,b 值为0、1 000、3 000 s/mm2,层厚5 mm,层间距1 mm,采集矩阵160×160,视野260 mm×260 mm,翻转角90°,激励次数2。增强造影剂采用钆喷酸葡胺(Gd-DTPA),剂量为0.01 mmol/kg;通过手背预先留置的静脉针快速团注,速率1.5 mL/s。
3.图像分析
3.1 cDWI图像拟合
本研究采用目前普遍应用于临床的DWI(0,1000)图像 进 行 拟 合, 通 过 计 算 拟 合 得 到cDWI(0,3000)图像[11]。
首先,DWI(0,1000)图像通过以下方程计算得到相应的表观弥散系数(ADC),即ADC(0,1000)图:
S(b)、S(0)分别表示b 值为b、0 s/mm2时的信号强度。
接着,利用以下方程,通过ADC(0,1000)图像推测某一b值下每个体素的信号强度:
其中,Sc(b)为拟合得到的cDWI 图像上b 值为b s/mm2时的信号强度,本研究中b 值为3 000 s/mm2。S*(0)、 ADC*分 别 为 每 个 体 素 中S (0) 和ADC(0,1000)的估计值。
3.2 SNR、CNR的计算
SNR、CNR依据如下公式[12-13]计算:
3.3 NePDH 征象判读及肿瘤实质区ADC(0,1000)测量
根据以往文献,肿瘤周围区定义为T1 增强图像上肿瘤增强区域周围3 cm 以内范围[6]。将高b 值DWI 或cDWI 图像上,瘤周DWI 信号高于对侧正常表观白质信号的30%,即信号率(signal intensity ratio, SIR) ≥30% 定义为无增强区域高信号征阳性[6]。由一名具有3 年以上工作经验的影像科医师在对病理结果不知情的情况下,分别在DWI(0,3000)及cDWI(0,3000)图像上进行NePDH征象的判读。
肿瘤实质区定义为T1 增强图像上肿瘤强化的部分。另外一名具有3 年以上影像诊断经验的医师在对病理结果不知情的情况下,参考T1WI、T2WI 及T2-FLAIR 图像,在ADC(0,1000)图像的肿瘤实质区域放置类圆形感兴趣区域(regions of interest, ROI)测量平均ADC 值,ROI面积约为20~40 mm2。测量时注意避开坏死、囊变、出血、钙化等区域。每个肿瘤各勾画3 个ROI,取3 个ROI 的平均值作为最终的ADC值。
4.统计学分析
使用SPSS 22.0 和MedCalc 11.4.2.0 统计分析软件。采用Wilcoxon 符号秩和检验比较DWI(0,3000)及cDWI(0,3000)图像上CNR、SNR 之间的差异。采用Kappa 检验评估医师在DWI(0,3000)及cDWI(0,3000)图像上判读NePDH 征象的一致性。κ≤0.2表示一致性极低;0.21~0.4 表示一致性一般,0.41~0.6 表示一致性中等,0.6~0.8 表示一致性高,0.8~1.0 表示一致性极高。采用Pearsonχ2检验分析NePDH 征象与IDH-1 基因型的相关性,并计算诊断的灵敏度、特异性、阳性预测值、阴性预测值。同时,采用Mann-WhitneyU检验评估不同IDH-1 基因型组间肿瘤实质区域ADC(0,1000)值 的 差 异。 绘 制 受 试 者 工 作 特 征(receiver operating characteristic, ROC)曲线并评价DWI(0,3000)、cDWI(0,3000)图像上NePDH 征象及肿瘤实质区ADC(0,1000)值的诊断效能。采用DeLong 检验评价ROC 曲线下面积(AUC)间的差异。P<0.05 认为差异有统计学意义。
结 果
患者的一般资料见表1。IDH-1 突变组、野生组患者间年龄、性别差异均无统计学意义(P>0.05)。

表1 患者一般资料

表2 不同胶质瘤IDH-1基因型组间cDWI(0,3 000)图像上NePDH征象及肿瘤实质区ADC(0,1 000)值比较

表3 cDWI(0,3 000)图像上NePDH征象、肿瘤实质区ADC(0,1 000)值及两者联合预测胶质瘤IDH-1基因型的效能
图像质量分析结果(图1)显示,cDWI(0,3000)图像的SNR、CNR均高于DWI(0,3000),两者间差异均具有统计学意义(P<0.05)。
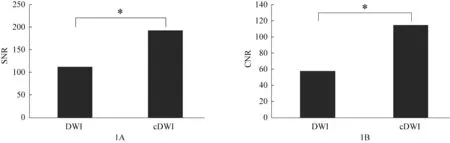
图1 图像质量分析
医师间在cDWI(0,3000)及DWI(0,3000)图像上判读NePDH 征象的一致性极高(κ=0.958)。在总共60 例胶质瘤患者中,cDWI(0,3000)图像上具有NePDH 阳性征象的病例共16 例(26.67%)。不同IDH-1 基因型组间,cDWI(0,3000)图像上NePDH 征象阳性具有统计学差异(P<0.05),详见表2。
cDWI(0,3000)图像上NePDH 征象阳性对IDH-1 野生型胶质瘤的阳性预测值为93.75%,阴性预测值为54.55%。DWI(0,3000)图像上NePDH 征象阳性对胶质瘤IDH-1 型诊断的AUC 为0.674,灵敏度为92.00%,特异度为 42.9%。 DeLong 检验结果显示,cDWI(0,3000)、DWI(0,3000)图像上NePDH 征象阳性诊断的AUC 之间差异不具有统计学意义(P>0.05),说明两者的诊断价值相仿。
NePDH 征象阳性及阴性病例影像资料分别见图2和图3。

图2 NePDH征象阳性病例影像资料

图3 NePDH征象阴性病例影像资料
IDH-1 野生型胶质瘤患者的肿瘤实质区ADC(0,1000)值 低 于IDH - 1 突 变 型(P<0.05)。cDWI(0,3000)图像上NePDH 征象阳性联合肿瘤实质区ADC(0,1000)值 对 胶 质 瘤IDH-1 基 因 型 进 行 诊 断 的AUC 达0.834, 灵 敏 度 达96.0%, 特 异 度 为71.4%(表3)。
讨 论
本研究证明了利用cDWI 技术拟合得到的高b 值cDWI 图像,其SNR、CNR 均优于扫描得到的同一b值的DWI 图像,且拟合得到的高b 值cDWI 图像上NePDH 征象阳性对胶质瘤IDH-1 基因型的诊断准确性能够达到与扫描得到的高b 值DWI 图像结果相仿。以上结果说明,cDWI 技术可以作为胶质瘤术前评估的一种无创性诊断手段,高b 值cDWI 图像上NePDH征象阳性为胶质瘤IDH-1基因型的术前诊断提供了诊断依据。
利 用cDWI 技 术 拟 合 得 到 的cDWI(0,3000)图 像,SNR、CNR 均明显优于DWI(0,3000)(P<0.05),这与既往研究结果相一致[14]。Feuerlein 等[14]的研究通过比较cDWI 及DWI 图像CNR、SNR,发现cDWI 技术能最大限度地提高肿瘤组织与背景组织之间的对比度,从而提高病灶显示的清晰度。同时,医师在cDWI(0,3000)图像上判读NePDH 征象的结果与其在DWI(0,3000)图 像 上 判 读 的 结 果 一 致 性 极 高,且cDWI(0,3000)、DWI(0,3000)图像上NePDH 征象对IDH-1 基因型的诊断效能相仿,说明cDWI 能够作为判读NePDH 征象的一种方法。此外,cDWI技术无需重新扫描患者,节约了扫描时间[15]。因此,cDWI技术一方面弥补了高b 值DWI 存在的图像质量不足等问题;另一方面,避免了非必要的高b 值扫描,实现了现有数据的有效利用。
IDH-1 野生型的胶质瘤相对于突变型侵袭性更高[16]。本研究结果表明,高b 值cDWI 图像上NePDH 征象阳性对IDH-1 野生型胶质瘤诊断的特异度极高(96.77%),阳性预测值可达96.55%。Price等[17]的研究表明约40%的胶质瘤在T2 加权图像上表现无异常的脑组织区域存在肿瘤细胞浸润。T1 增强序列是目前作为确定肿瘤浸润范围最常用的序列,但在血流灌注不足或肿瘤生长较快的边缘区域,T1增强无法达到满意的效果。而原发颅内胶质瘤细胞可沿血管通道及白质纤维浸润而不破坏血脑屏障,这导致周围浸润区域细胞密度增加但不伴有T1WI 增强上明显强化[18]。由于高b 值DWI 对细胞密度改变的高敏感性,NePDH 阳性征象(瘤周非强化区域DWI 高信号)有可能先于T1 增强图像检测到肿瘤细胞的周围浸润。已经有学者的研究表明,高b 值DWI 上NePDH 征象的出现与胶质瘤的肿瘤浸润程度、生存期密切相关[6-7]。因此,高b 值DWI 图像上NePDH 征象阳性可能是肿瘤细胞浸润早期浸润的结果[6-7],这与IDH-1 野生型胶质瘤更容易向周围浸润具有一致性。
然而,NePDH 征象对IDH-1 野生型胶质瘤诊断的灵敏度、阴性预测值均较低(分别为42.86%、52.55%)。ADC 值作为DWI 图像的定量参数,诊断较为客观,广泛应用于胶质瘤的分级、分子类型的评估[19]。因此,本研究将肿瘤实质区域ADC(0,1000)值与NePDH 征象这2 个指标相结合,发现联合指标对IDH-1 基因型诊断的灵敏度提升至96.0%,特异度为71.4%,AUC达0.834。
本研究存在一定的局限性。①本研究样本量较小。②对NePDH 征象可能与肿瘤细胞周围浸润相关的推测未进行相应区域的病理证实。③不同的较低b值计算得到的cDWI 图像质量有所不同,本研究仅对最常用的b=0、1 000 s/mm2进行研究,后续还需更多研究以优化b值的选择。
综上所述,计算加权成像能够作为判读肿瘤周围无增强区域DWI 高信号的一种方法,且图像质量较高。高b值cDWI图像上出现NePDH 征象联合肿瘤实质区ADC 值为无创诊断胶质瘤IDH-1 基因突变类型提供了一种无创可行的方法。

