肺黏液表皮样癌的CT大体分型和免疫组化特征研究
刘艳芳 任 刚 蔡 嵘 汪心韵
肺黏液表皮样癌(pulmonary mucoepidermoid carcinoma,PMEC)属于唾液腺型肿瘤,约占所有肺癌的0.1%~0.2%[1],约占儿童肺癌的9%[2]。大部分PMEC 的恶性程度低,发展缓慢,预后较佳。其CT大体分型与免疫组化特征研究相对较少,笔者收集经手术病理证实的8 例原发性PMEC,分析归纳其CT大体分型和免疫组化特征,以加深对本病的认识。
方 法
1.临床资料
收集上海交通大学医学院附属新华医院2013年4月—2020 年1 月收治的经手术病理证实的8 例原发性PMEC 患者资料,其中男性5 例,女性3 例,男女比例为1.6∶1;年龄11~80岁,中位年龄49岁。首发症状为咳嗽2 例,胸痛1 例,咯血1 例,体检发现4 例。吸烟者2例。患者临床资料详见表1。

表1 8例PMEC患者的临床资料
2.仪器与方法
8例患者中有4例行胸部CT平扫,4例行胸部CT平扫和增强扫描。采用 Siemens Somatom Definition 64层双源CT、Philips 256层Brillancei CT 机。患者取仰卧位,在吸气末屏气,从颈根部扫描至肋膈角最下缘。扫描参数:管电压120 kV,电流依据患者生理条件自动跟踪调节,层厚5 mm,层间距5 mm,螺距1.0。增强扫描采用碘对比剂碘海醇(欧乃派克,300 mgI/mL)100 mL,使用高压注射器以3 mL/s 的流率经肘前静脉注射,分别于注射后20、70 s 采集血管期、实质期图像。
由2名工作10年以上的放射科诊断医师阅片并达成一致意见。观察病灶的CT 表现:①位置;②根据生长方式进行CT 大体分型[3],分为腔内结节型(病灶呈宽基底向腔内突出,气道偏心性狭窄)、腔内外肿块型(病灶沿气道浸润生长并向腔内外不同程度突出形成肿块)、外周型(病灶位于肺的周围部);③大小;④边界;⑤形态;⑥密度;⑦强化程度(增强扫描CT 峰值-平扫CT 值)<20 HU 为轻度强化,20~40 HU 为中度,>40 HU 为明显强化);⑧周围伴随征象(如支气管黏液栓塞、阻塞性肺炎、肺不张等);⑨转移情况。
病理学分级:根据肿瘤内细胞成分比例不同分为低、高级别。低级别者以黏液细胞和表皮样细胞为主,中间型细胞较少,肿瘤细胞排列呈巢片状,形成囊腔,细胞无明显异型性、核分裂少见;高级别者以表皮样细胞及中间型细胞为主,排列成片,细胞异型性明显、核分裂象可见,而黏液细胞较少。
采用免疫组织化学染色法检测8 例患者组织标本中CK5、CK7、P63、P40、P53、TTF-1、Napsin A、Ki-67、EGFR、ALK 抗体的表达,试剂均购自北京中杉金桥公司。
结 果
1.CT特征
5 例位于左肺,3 例位于右肺。3 例位于叶支气管,4 例位于段支气管,1 例位于肺的周围部。肿瘤最大径为1.0~7.0 cm,平均2.5 cm。
腔内结节型2 例(25%),表现为气管、支气管腔内单发类圆形结节,呈宽基底与管壁相连,病灶腔内部分>腔外部分(图1)。腔内外肿块型5 例(37.5%),表现为支气管腔内、外单发类椭圆形或分叶状结节、肿块,边界清楚,病灶长轴与支气管方向一致,病灶腔外部分>腔内部分(图2~4)。外周型1例(12.5%), 位于左肺上叶, 病灶呈菜花状(图5)。
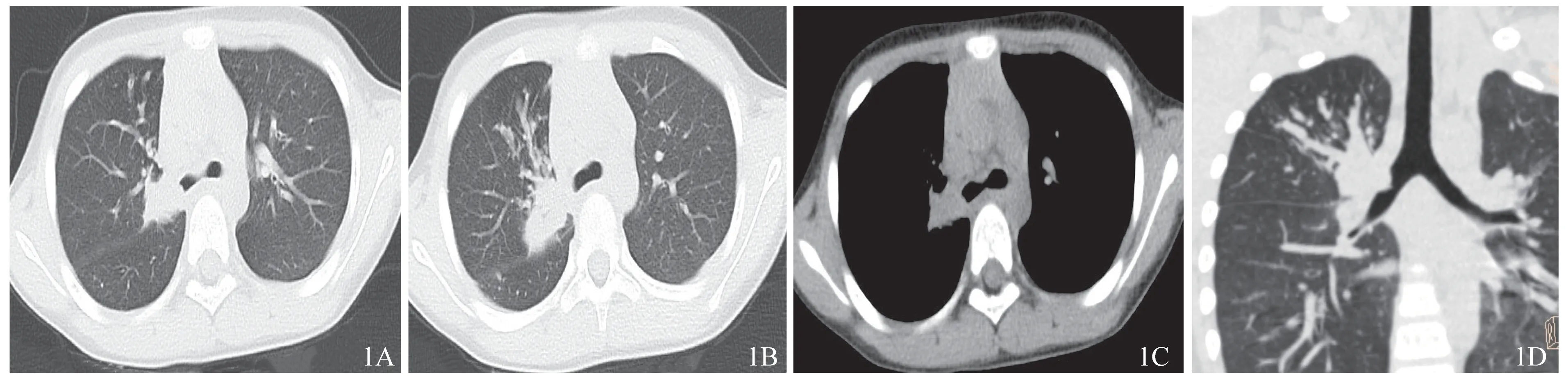
图1 病例1影像
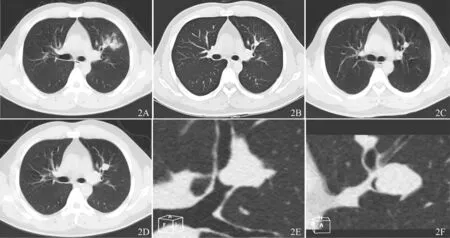
图2 病例2影像
8 例平扫均为软组织密度,密度均匀,CT 值为22~50 HU,其中1例伴多发点状钙化(图3B)。

图3 病例7影像

图4 病例8影像

图5 病例5影像
4 例行CT 增强扫描,呈轻度均匀强化,静脉期CT 值为33~59 HU,有2 例肿块内见血管影(图3C、4C)。
8例中2例伴阻塞性肺炎、肺不张,2例伴支气管黏液栓塞,1 例伴支气管旁淋巴结肿大,1 例伴左颈部淋巴结肿大(表2)。
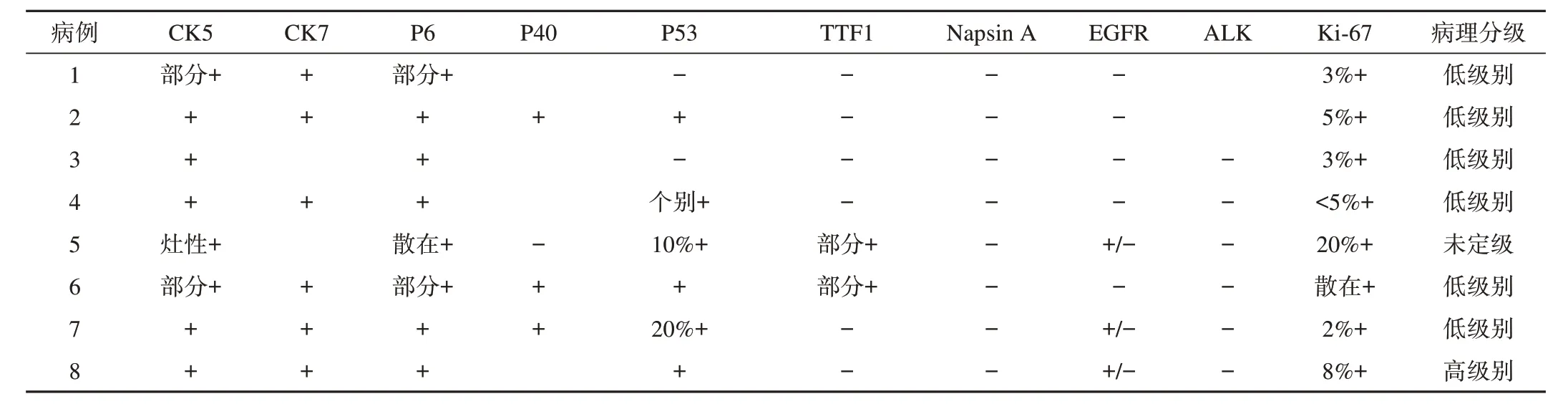
表3 8例PMEC免疫组织化学结果及病理分级
2.病理诊断、免疫组织化学检查结果
大体形态:8 例送检组织大部分切面呈灰白色,少数呈浅黄色,大部分质硬易碎。
镜下形态:8 例组织学形态相似,由黏液细胞、表皮样细胞、中间型细胞组成,排列呈巢状、腺囊样结构。黏液细胞体积大,呈多边形,胞质淡染呈嗜碱性,胞核小,位于基部;表皮样细胞呈多边形,可见细胞间桥,但角化不全;中间型细胞似基底细胞,呈多边形,体积小,胞质少,核圆。
本组病例低级别6 例,高级别1 例,未定级别1例(为左肺上叶病理学分级腺癌合并黏液表皮样癌)。镜下癌组织侵犯胸膜3 例,浸润周围肺组织2 例,淋巴结转移2例。
免疫组化检查:8例(8/8)CK5、P63表达阳性,6 例(6/8)CK7、P53 表达阳性,3 例(3/8)EGFR表达阳性,6 例(6/8)Ki-67 阳性率≤5%,8 例(8/8)Napsin A 表达阴性,5例(5/8)TTF1表达阴性,8例(8/8)ALK表达阴性(表3)。
讨 论
PMEC 起源于气管、支气管黏膜下腺体。其发病年龄跨度大,与传统肺癌相比更趋于年轻化,本组年龄最小者仅为11岁。
PMEC 呈惰性生长,早期无症状,只有当肿瘤造成支气管阻塞时,才会出现咳嗽、咳痰、咯血、胸痛等,而且往往容易误诊,造成延迟诊断。有文献[4]报道过PMEC 被长期误诊为肺炎,还有文献[5]报道过被误诊为哮喘的病例。本组病例中有1 例29 岁患者,表现为反复发作的肺炎,1 年后才得以明确诊断,很值得我们警醒。回顾该患者的CT 图像,其实首次就诊时在左肺上叶支气管旁即有直径约1.0 cm的软组织结节,因周围炎症及实变的存在,干扰了病灶的检出,造成了漏诊;5个月后小结节增大至1.3 cm,由于病灶呈类圆形,体积小且位于血管分叉处,我们观察不仔细,误认为是肺血管的横断面而再次漏诊;直至1 年后病灶增大至2.0 cm 才得以检出。由此,我们得出结论:①年轻患者反复发作的肺炎,要警惕PMEC 的存在,这是因为肿瘤生长在支气管内引起阻塞性肺炎,经抗炎治疗后炎症可以吸收,但由于阻塞并没有得到根治,故肺炎反复发作;②对于CT 上表现为肺炎的患者,应仔细分辨炎症所在肺叶的支气管血管束情况,做到病灶的早期识别。
PMEC 多发生于叶、段支气管及主支气管[6-7],影像上呈腔内结节型、腔内外肿块型。这与本病起源于气管、支气管黏膜下腺体有关,因为混合腺体和透明软骨存在于3 级以上的支气管黏膜下层[8]。本组腔内结节型2 例,表现为支气管腔内的结节,呈宽基底与支气管管壁相连,病灶腔内部分>腔外部分,此型为PMEC的早期影像表现,儿童也以此型居多。腔内外肿块型5 例(5/8),肿块边界清楚,呈圆形或分叶状,其长径与支气管走行方向一致,这也体现了肿瘤黏膜下浸润生长的特点,部分患者伴支气管黏液栓塞、阻塞性肺炎、肺不张,此型是由于病变破坏了支气管软骨,表现为向腔内外膨胀性生长的肿块,当支气管未完全闭塞时,可出现“空气新月征”,当肿块进一步进展就表现为支气管弥漫性增厚、闭塞,形成较大的软组织肿块。而且我们发现本组病例中有5 例(5/8)均位于左肺上叶支气管,且其中2 例位于左肺上叶前段支气管;由此我们推测左肺上叶支气管是PMEC 的好发部位,这有待后续扩大样本量后进一步证实。
发生于段以下支气管病变称为外周型,此型少见[7]。肿瘤边缘光滑或分叶,一般无毛刺、坏死、空洞及胸膜凹陷征[9]。本组病例中有1例(1/8)表现为外周型,病灶呈菜花状,内见支气管充气征,与邻近胸膜有牵拉,伴左颈部淋巴结肿大,病理诊断为肺腺癌合并黏液表皮样癌(腺泡型50%+黏液表皮样癌40%+微乳头型10%),笔者推测出现恶性征象可能与其含腺癌成分有一定关系。
本组8 例CT 平扫均呈软组织密度,且密度均匀。据报道[9]50%病例中可见斑点或颗粒状钙化,这是其诊断特点之一。这可能与黏液细胞分泌的黏液不完全吸收导致钙盐沉积有关。Ban 等[10]报道的一组病例37 例,钙化者3 例。侯晶晶等[11]报道的29 例均无钙化。本组8 例中仅有1 例(1/8)伴钙化,有待今后收集更多的样本进行统计,以获得更可信的结论。
本组病例中4例行CT增强扫描,均表现为轻度强化,部分肿块内或肿块边缘见血管影,这与韩小雨等[9]报道的PMEC呈中度至显著均匀或不均匀强化的观点不一致。据报道[12]增强扫描其强化程度与黏液细胞数量有关(黏液分泌区血管分布密集,非黏液分泌区血管分布稀疏),低级别有较多的黏液物质和较多的血管,故低级别PMEC增强程度要高于高级别者。
根据组织学特征,PMEC 分为低级别和高级别,而且组织学类型是预后的一个重要指标。低级别的PMEC 生长缓慢,病程可达数年,淋巴结转移少见,预后较好,临床上以这型居多[13]。高级别者少见,多表现为周围型肿块,且以老年人居多,肿瘤浸润支气管管壁全层,并侵及邻近肺组织,可发生淋巴道和血液转移[14]。本组低级别者有6 例(6/8),且均位于叶、段支气管,影像上表现为腔内结节型和腔内外肿块型;高级别1 例(1/8),且年龄为80 岁,与文献报道一致。
PMEC 因其组织学形态成分复杂,故需借助免疫组织化学染色来协助诊断。PMEC 是由黏液细胞、表皮样细胞及中间细胞按不同比例组成的恶性上皮肿瘤。肿瘤细胞可表达多种上皮源性抗原。本组病例Napsin A均表达阴性,6例TTF1表达阴性,CK5全部阳性表达,CK7 大部分阳性表达,P63 均为阳性,且P63 阳性 率 高 于P40 及P53。有 研 究[15]认 为Napsin A 和TTF1阳性基本上排除PMEC的可能性。由此我们推测Napsin A、TTF1 表达阴性,结合CK5、CK7、P63 表达阳性有助于PMEC的诊断。Ki-67高指数表示细胞增殖明显活跃,肿瘤恶性程度高;低指数则与之相反。本组Ki-67 阳性率≤5%者6 例,均为低级别PMEC;1例Ki-67阳性率8%者为高级别,故Ki-67可作为组织病理学分级的辅助鉴别指标,这与既往文献报道也是大致相符的[15]。
综上所述,PMEC 是一种低度恶性肿瘤,相对罕见,早期部分患者表现为反复发作的肺炎,很容易误诊、漏诊。多发生于叶、段支气管,CT 大体分型以腔内外肿块型居多,边缘清楚,肿块长径与支气管走行一致,呈轻度强化,可合并阻塞性肺炎和肺不张,很少有纵隔及肺门淋巴结转移。结合免疫组化Napsin A、TTF1 表达阴性,CK5、CK7、P63 表达阳性有助于诊断。Ki-67 可作为指导病理学分级及评估预后的指标。PMEC 的分子遗传学改变、高级别PMEC 的治疗是目前研究的热点,接下来我们也会收集更多的病例进行评估。

