老年性痴呆患者血清miR-375、SP1水平与认知功能的相关性
夏君燕,李亚男,章隽,高永红
(北京航天总医院 老年医学科, 北京 丰台 100076)
1 资料与方法
1.1 一般资料
选取2021年4月至2022年4月在本院就诊的老年性痴呆患者120例为疾病组,其中男49例,女71例,年龄60~88岁,平均(71.85±9.65)岁。根据临床痴呆评定量表(CDR)评分将患者分为轻度组(CDR评分=1分)42例、中度组(CDR评分=2分)43例、重度组(CDR评分=3分)35例。纳入标准:(1) 符合老年性痴呆的相关诊断标准[7];(2) CDR评分≥1分[8];(3) 简易精神状态量表(MMSE)评分<26分[9];(4) 肝、肾功能正常;(5) 临床资料完整。排除标准:(1) 脑部接受过手术治疗的患者;(2) 其他神经系统疾病引起的痴呆患者;(3) 参加本研究前接受过相关治疗的患者;(4) 伴有器质性病变患者;(5) 不能配合完成研究的患者。另选取同期健康体检志愿者120例作为对照组,其中男56例,女64例,年龄62~87岁,平均(72.30±9.42)岁。所有受试者对本研究内容知情并签署书面同意书。本研究通过医院伦理委员会审批。
1.2 细胞与主要试剂
人神经母细胞瘤细胞SH-SY5Y(货号:CC-Y1459)购自美国ATCC公司。Trizol试剂盒(货号:15596026)购自赛默飞世尔科技公司;逆转录试剂盒(货号:RRO47AA)购自日本TaKaRa公司;实时荧光定量PCR(qRT-PCR)试剂盒(货号:Code NO. RR420L)购自日本TaKaRa公司;双荧光素酶报告基因检测试剂盒(货号:T002)购自威格拉斯生物技术(北京)有限公司;Lipofectamine®3000转染试剂(货号:L3000-015)购自美国Invitrogen公司;SP1、甘油醛-3-磷酸脱氢酶(GAPDH)抗体(货号:ab227383、ab181602)购自英国Abcam公司;噻唑蓝(MTT)(货号:M8180-1)购自北京索莱宝科技有限公司;异硫氰酸荧光素标记膜联蛋白-V(Annexin V-FITC)/碘化丙啶(PI)凋亡检测试剂盒(货号:WK304)购自北京百奥莱博科技有限公司。
1.3 研究方法
1.3.1 一般资料收集 收集两组一般资料。(1) 人口学资料:性别、年龄、教育年限、吸烟史、饮酒史;(2) 基础疾病:高血压、高血脂、糖尿病;(3) 生化指标:总胆固醇(TC)、甘油三酯(TG)、高密度脂蛋白胆固醇(HDL-C)、低密度脂蛋白胆固醇(LDL-C)、血尿素氮(BUN)、血肌酐(SCr)、β-淀粉样蛋白肽1-42(Aβ1-42)、磷酸化tau(P-tau)蛋白。
1.3.2 样本采集 BD真空采血管收集所有研究对象清晨空腹状态下的静脉血10 ml,4 ℃ 3 000 r·min-1离心15 min,分离血清,置-80 ℃冰箱保存待测。
1.3.3 血清miR-375、SP1 mRNA表达水平检测 按Trizol试剂盒说明书操作,提取血清中总RNA,使用M-MLV反转录试剂盒反转录成cDNA,以cDNA为模板,采用qRT-PCR仪检测血清miR-375、SP1 mRNA的相对表达水平。PCR反应体系20 μl:cDNA模板1 μl、ddH2O 7 μl、正向引物1 μl、反向引物1 μl、2×Taq PCR master mix 10 μl;反应条件为95 ℃初始变性30 s;95 ℃变性15 s,55 ℃退火30 s,40个循环。每组实验重复3次。使用2-ΔΔCt方法分析血清miR-375、SP1 mRNA表达水平。miR-375以U6作为内参基因,SP1 mRNA以GAPDH作为内参基因,引物由生工生物工程(上海)股份有限公司提供。引物序见表1。

表1 qRT-PCR引物序列
1.3.4 双荧光素酶报告基因实验 分别构建SP1野生型质粒(WT-SP1)及突变型质粒(MUT-SP1),将WT-SP1和MUT-SP1分别与mimic NC或miR-375 mimic共转染于293t细胞,48 h后检测荧光素酶活性。
1.3.5 细胞分组、转染与老年性痴呆体外细胞模型构建 SH-SY5Y细胞采用含10%胎牛血清和1%双抗(青霉素和链霉素)的DMEM培养基在37 ℃、5% CO2培养箱中培养。生长状态良好且处于对数生长期的SH-SY5Y细胞分为对照组、模型组、mimic NC组和miR-375 mimic组。其中,mimic NC组和miR-375 mimic组细胞使用Lipofectamine®3 000转染试剂分别转染mimic NC或miR-375 mimic,转染48 h后使用含5 μmol·L-1β-淀粉样蛋白肽25-35(Aβ25-35)的DMEM培养基处理细胞24 h以构建老年性痴呆体外细胞模型[10];模型组细胞仅使用含5 μmol·L-1Aβ25-35的DMEM培养基处理细胞24 h;对照组细胞不进行任何特殊处理。处理结束后收集细胞,qRT-PCR法检测细胞中miR-375、SP1 mRNA表达水平(具体操作步骤参照1.3.3);蛋白质印迹法检测细胞中SP1蛋白表达水平;MTT法检测细胞活力;流式细胞术检测细胞凋亡率。
1.3.6 蛋白质印迹法检测各组SH-SY5Y细胞中SP1蛋白表达水平 收集处理后的各组SH-SY5Y细胞,使用裂解液充分裂解后提取细胞中总蛋白。SDS-PAGE电泳分离等量变性蛋白,将分离的蛋白电转移至聚偏二氟乙烯膜上,5%脱脂奶粉室温封闭1 h后添加一抗(SP1、GAPDH抗体)4 ℃孵育过夜,添加二抗室温孵育1.5 h,化学发光试剂显色,凝胶成像分析系统扫描图像,Image J软件分析蛋白条带灰度(GAPDH为内参蛋白)。
夜很静。尽管街道上有车,有人,但这一切对我来说,都是无声的。夏夜的凉风吹在我身上,这是我对外界的唯一感知。我很紧张。我即将去完成一件大事,生死攸关的大事。
1.3.7 MTT法检测各组SH-SY5Y细胞活力 将处理后的各组SH-SY5Y细胞以3 000个·孔-1接种于96孔板中,常规培养24、48、72 h后每孔添加20 μl MTT溶液(5 mg· ml-1),继续培养4 h后弃去培养液,添加150 μl二甲基亚砜(DMSO)充分混匀并孵育15 min,使用酶标仪检测各孔细胞在490 nm波长处的OD值(OD490 nm),以OD490 nm表示细胞活力。
1.3.8 流式细胞术检测各组SH-SY5Y细胞凋亡率 收集处理后的各组SH-SY5Y细胞,将5×104个细胞使用185 μl Annexin V-FITC结合液重悬,随后添加10 μl Annexin V-FITC、5 μl PI室温避光孵育10 min、5 min,使用流式细胞仪分析细胞凋亡率。
1.4 统计学处理
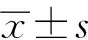
2 结 果
2.1 两组一般资料的比较
两组性别、年龄、吸烟史、饮酒史、高血压、高血脂、糖尿病、TC、TG、HDL-C、LDL-C、BUN、Scr比较差异无统计学意义(P>0.05),两组受教育年限、Aβ1-42、P-tau蛋白比较差异有统计学意义(P<0.05)。见表2。
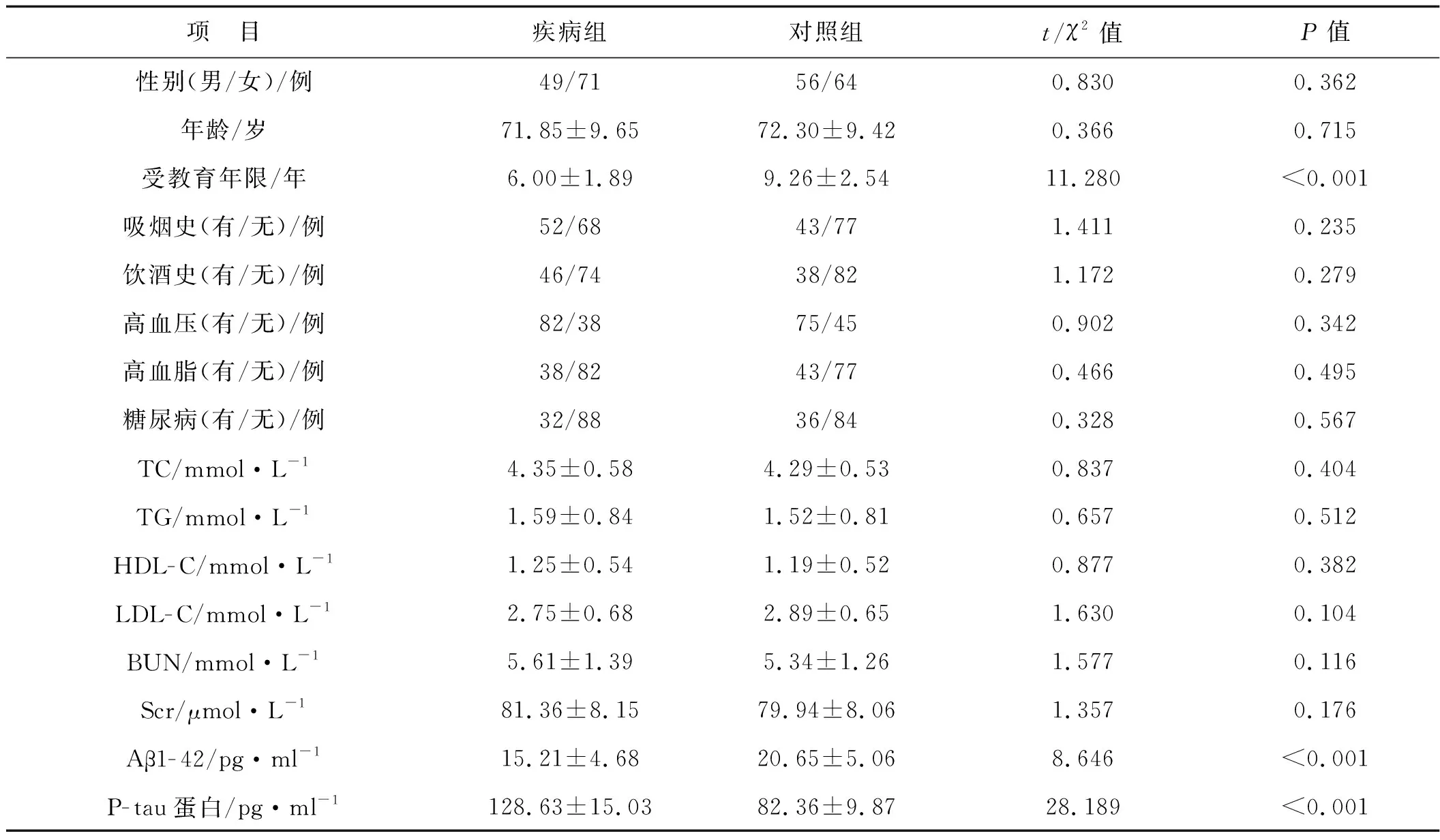
表2 两组一般资料的比较(n=120)
2.2 两组血清miR-375、SP1mRNA表达水平及MMSE评分比较
疾病组血清miR-375表达水平、MMSE评分显著低于对照组,SP1 mRNA表达水平显著高于对照组(P<0.001),见表3。

表3 两组血清miR-375、SP1mRNA表达水平及MMSE评分比较
2.3 不同病情程度组血清miR-375、SP1mRNA表达水平及MMSE评分比较
重度组、中度组血清miR-375表达水平、MMSE评分显著低于轻度组,SP1 mRNA表达水平显著高于轻度组(P<0.05);重度组血清miR-375表达水平、MMSE评分显著低于中度组,SP1 mRNA表达水平显著高于中度组(P<0.05)。见表4。

表4 不同病情程度组血清miR-375、SP1表达水平及MMSE评分比较
2.4 疾病组血清miR-375与SP1 mRNA表达水平及两者与MMSE评分的相关性
Pearson相关分析显示,疾病组血清miR-375与SP1 mRNA表达水平呈负相关(r=-0.627,P<0.05);Spearman相关分析显示,血清miR-375表达水平与MMSE评分呈正相关(r=0.664,P<0.05),血清SP1 mRNA表达水平与MMSE评分呈负相关(r=-0.472,P<0.05)。见图1。
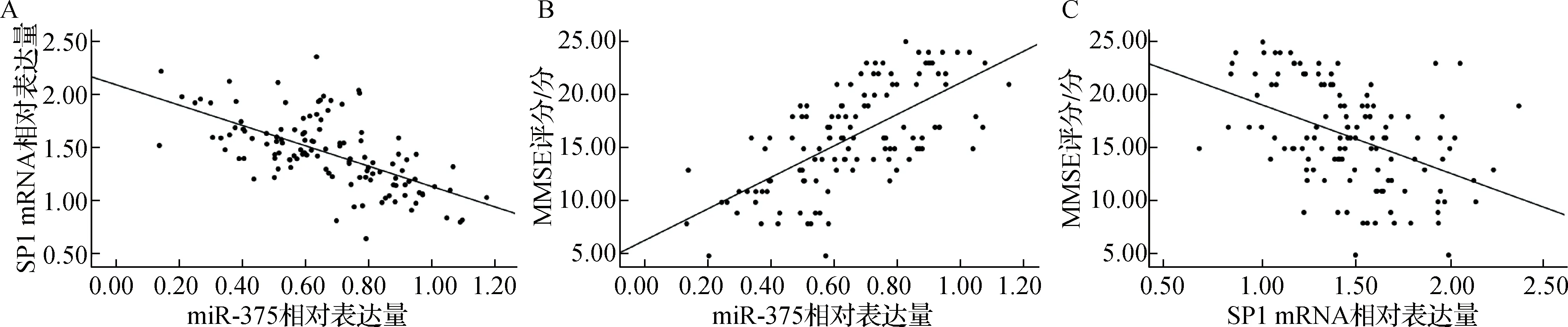
A.miR-375与SP1 mRNA的相关性;B.miR-375与MMSE评分的相关性;C.SP1 mRNA与MMSE评分的相关性图1 血清miR-375与SP1 mRNA表达水平及两者与MMSE评分的相关性
2.5 多因素Logistic回归分析影响老年性痴呆发生的危险因素
以是否发生老年性痴呆为因变量,以受教育年限、MMSE评分、miR-375和SP1 mRNA表达水平为自变量建立多因素Logistic回归模型,结果显示,低MMSE评分、miR-375低表达、SP1 mRNA高表达是影响老年性痴呆发生的危险因素(P<0.05),见表5。

表5 多因素Logistic回归分析影响老年性痴呆发生的危险因素
2.6 ROC曲线分析血清miR-375、SP1 mRNA表达水平和MMSE评分对老年性痴呆患者病情进展为重度的预测价值
以老年性痴呆患者病情是否进展为重度为状态变量,血清miR-375、SP1 mRNA表达水平和MMSE评分以及三者联合预测概率值(通过二元Logistic回归分析得到)为检验变量绘制ROC曲线,结果显示,血清miR-375、SP1 mRNA表达水平和MMSE评分预测老年性痴呆患者病情进展为重度的AUC分别为0.823(95%CI0.750~0.896)、0.780(95%CI0.689~0.871)、0.851(95%CI0.781~0.921),临界值分别为0.65、1.60、15,敏感度分别为91.43%、68.57%、85.71%,特异性分别为68.24%、77.65%、65.88%;三者联合预测的AUC为0.938(95%CI0.879~0.974),显著高于血清miR-375、SP1 mRNA表达水平和MMSE评分单独预测的AUC(Z=2.734、3.150、2.113,P<0.05),且敏感度高达97.14%,特异性为78.82%。见图2。

图2 血清miR-375、SP1 mRNA表达水平和MMSE评分预测老年性痴呆患者病情进展为重度的ROC曲线
2.7 miR-375靶向调控SP1
TargetScanHuman网址预测miR-375与SP1间存在结合位点,见图3。与mimic NC和WT-SP1共转染组比较,miR-375 mimic和WT-SP1共转染组细胞荧光素酶活性降低(P<0.05);与mimic NC和MUT-SP1共转染组比较,miR-375 mimic和MUT-SP1共转染组细胞荧光素酶活性变化差异无统计学意义(P>0.05),见表6。

图3 TargetScanHuman网址预测miR-375与SP1结合位点
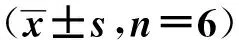
表6 荧光素酶活性比较
2.8 过表达miR-375对Aβ25-35诱导的SH-SY5Y细胞中SP1 mRNA和蛋白表达的影响
与对照组比较,模型组SH-SY5Y细胞中miR-375表达水平显著降低,SP1 mRNA和蛋白表达水平显著升高(P<0.05);与模型组比较,mimic NC组SH-SY5Y细胞中miR-375以及SP1 mRNA和蛋白表达水平差异无统计学意义(P>0.05);与模型组、mimic NC组比较,miR-375 mimic组SH-SY5Y细胞中miR-375表达水平显著升高,SP1 mRNA和蛋白表达水平显著降低(P<0.05)。见图4、表7。
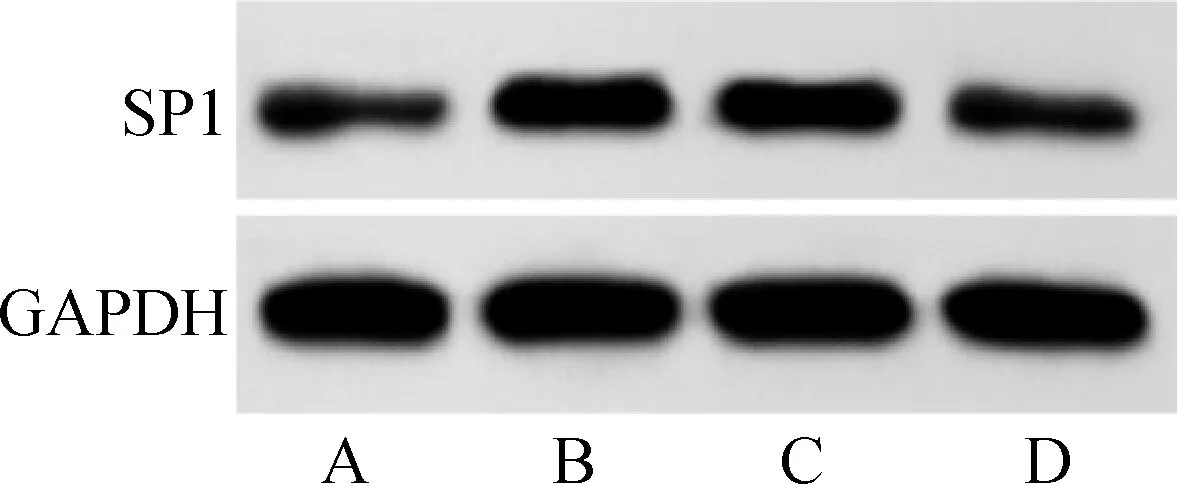
A.对照组;B.模型组;C.mimic NC组;D.miR-375 mimic组图4 蛋白质印迹法检测过表达miR-375对Aβ25-35诱导的SH-SY5Y细胞中SP1蛋白表达的影响
表7 过表达miR-375对Aβ25-35诱导的SH-SY5Y细胞中SP1 mRNA和蛋白表达的影响
2.9 过表达miR-375对Aβ25-35诱导的SH-SY5Y细胞活力和凋亡率的影响
与对照组比较,模型组SH-SY5Y细胞活力显著降低,凋亡率显著升高(P<0.05);与模型组比较,mimic NC组SH-SY5Y细胞活力和凋亡率差异无统计学意义(P>0.05);与模型组、mimic NC组比较,miR-375 mimic组SH-SY5Y细胞活力显著升高,凋亡率显著降低(P<0.05)。见图5、表8。

图5 流式细胞术检测过表达miR-375对Aβ25-35诱导的SH-SY5Y细胞凋亡率的影响

表8 过表达miR-375对Aβ25-35诱导的SH-SY5Y细胞活力和凋亡率的影响
3 讨 论
65岁以上老人老年性痴呆的发病率为5%左右[11],临床主要表现为记忆障碍、认知衰退、视空间能力损害,给患者日常生活造成困扰。老年性痴呆发病机制复杂,临床进展受多种因素影响,目前缺乏有效的诊断和治疗手段[6,12],已成为21世纪医学界急需解决的重大健康问题。寻找新的生物标志物,有助于临床评估患者病情,制定靶向治疗方案,延缓病情进展,提高患者生活质量。
阿尔茨海默病患者脑脊液中的Aβ能够在神经细胞外异常沉积,引起神经突退缩和神经元变性,同时还会造成血管平滑肌变性。tau蛋白能够与微管结合维持微管的稳定性,微管系统是神经骨架的主要成分,tau蛋白过度磷酸化后,神经骨架受到损坏,正常的轴突转运受损,造成神经元功能损伤。脑脊液中低水平Aβ1-42和高水平P-tau蛋白是临床推荐的阿尔茨海默病的生物标志物[13]。本研究发现,疾病组Aβ1-42水平低于对照组,P-tau蛋白水平高于对照组,与脑脊液中两者变化趋势一致[13],提示临床可通过检测血清中Aβ1-42和P-tau蛋白水平进行判断,与检测脑脊液中两者水平比较更容易获取检测样本。
此外,多种miRNA已被证实与阿尔茨海默病相关,可作为该疾病的生物标志物[12,14]。本研究中,疾病组miR-375表达降低,且MMSE评分越低miR-375水平越低,表明miR-375在老年性痴呆中起保护作用。研究证实,miR-375/SIX轴可接受lncRNA WT1-AS的调控,参与阿尔茨海默病的神经元氧化应激损伤和细胞凋亡[15]。Ashmwe等[16]采用体外冲击波治疗脊髓损伤大鼠,治疗后miR-375表达增加,表明miR-375具有神经保护作用。SP1已被证实是阿尔茨海默病的关键调控基因[17],且SP1能通过结合促炎转录因子如核因子-E2相关因子2(Nrf2)、核因子κB(NF-κB)和p53等调节阿尔茨海默病中重要基因如Aβ前体蛋白(APP)和β-分泌酶1(BACE1)的表达,同时也可能接受与阿尔茨海默病发病相关的重要细胞因子白介素-1β(IL-1β)的调节[18]。在帕金森病大鼠模型中,上调miR-375能够抑制SP1的表达,改善多巴胺能神经元的损伤,并且能够减轻炎症反应和氧化应激[19]。Xu等[20]研究发现,miR-375/SP1轴可接受lncRNA 01138的调控,在神经胶质瘤的有氧糖酵解和细胞增殖中发挥作用。本研究中,老年性痴呆患者血清SP1 mRNA表达水平显著升高,且病情越严重SP1 mRNA表达水平越高,提示SP1高表达可能在老年性痴呆发生和病情进展中起促进作用。进一步分析显示,老年性痴呆患者血清miR-375与SP1 mRNA表达水平呈负相关,miR-375低表达、SP1高表达均是影响老年性痴呆发生的危险因素,表明miR-375可能通过负向调控SP1在老年性痴呆发生和病情进展过程中发挥作用。此外,血清miR-375、SP1 mRNA表达水平和MMSE评分以及三者联合预测老年性痴呆患者病情进展为重度的曲线下面积(AUC)分别为0.823、0.780、0.851、0.938,三者联合预测的AUC显著高于单个指标预测的AUC,且三者联合预测的敏感度高达97.14%,特异性为78.82%,表明血清miR-375、SP1 mRNA表达水平和MMSE评分均具有一定预测老年性痴呆患者病情进展为重度的价值,且三者联合预测的价值较高。以上研究结果提示,血清miR-375、SP1 mRNA具有成为评估老年性痴呆发生及病情严重程度辅助指标的潜力。
TargetScanHuman网址预测发现miR-375与SP1间存在结合位点,双荧光素酶实验证实miR-375能够直接靶向SP1。老年性痴呆、帕金森病和神经胶质瘤均属于神经系统疾病,推测miR-375、SP1可能通过miR-375/SP1轴调节神经细胞增殖、凋亡、分化等生物学过程,进而在老年性痴呆发生发展中协同发挥作用。本研究以人神经母细胞瘤细胞SH-SY5Y(老年性痴呆发病机制研究常用细胞模型之一[21])为研究对象,通过Aβ25-35诱导构建老年性痴呆体外细胞模型初步探究miR-375、SP1在老年性痴呆中的具体作用机制。结果显示,Aβ25-35诱导后,SH-SY5Y细胞中miR-375表达水平、细胞活力降低,而SP1 mRNA和蛋白表达水平以及细胞凋亡率升高,此结果与miR-375、SP1在老年性痴呆患者血清中的表达趋势一致,提示miR-375、SP1可能通过相互作用参与Aβ25-35诱导的SH-SY5Y细胞损伤过程。进一步分析显示,过表达miR-375能够升高Aβ25-35诱导的SH-SY5Y细胞活力,同时降低SP1 mRNA和蛋白表达以及细胞凋亡率,该结果进一步证实了miR-375可能通过负靶向调控SP1表达影响Aβ25-35诱导的SH-SY5Y细胞增殖、凋亡,进而参与调控老年性痴呆发生发展。
综上所述,老年性痴呆患者血清miR-375表达水平明显降低,SP1 mRNA表达水平明显升高,两者呈负相关,且均与患者病情及认知功能具有一定的相关性。但本研究样本量较小,试验数据可能存在一定的偏倚。同时由于研究条件的限制,本研究仅初步分析了miR-375对SP1的靶向调控作用以及二者参与老年性痴呆的作用机制。后续可扩大样本数量,并结合更多的细胞实验、动物实验等基础研究对两者的具体作用机制进行深入探讨。

