波吉卵囊藻对凡纳滨对虾生长、抗氧化及肠道菌群的影响
陈红丽,邓承城,刘 阳,黄翔鹄,李 峰,张玉蕾,李长玲,张 宁
(广东海洋大学水产学院,广东 湛江 524088)
凡纳滨对虾(Litopenaeus νannamei)肉质鲜美、生长快速、适应性强、养殖效益高,已成为我国重要的养殖对象之一[1]。随着对虾高密度集约化养殖模式的广泛应用,养殖环境恶化、对虾抗病力下降及疾病感染等问题愈发突出,已严重影响对虾养殖业的健康发展[2-3]。如何有效改善养殖环境,提高对虾抗病力,实现绿色健康养殖,是对虾养殖业亟待解决的问题。构建以良性微藻为优势群落的绿色生态养殖模式是对虾养殖行业健康发展的方向之一[4-5]。微藻是对虾养殖生态系统中重要的组成部分,不仅直接影响对虾养殖环境,而且与对虾的生长、免疫和健康状况关系密切。姚冬梅等[6]接种蛋白核小球藻(Chlorella pyrenoidosa)于凡纳滨对虾养殖池塘,发现水体亚硝态氮和氨氮含量显著降低;Huang 等[7]在凡纳滨对虾养殖水体中分别添加眼点拟微球藻(Nannochloropsis oculata)和假微型海链藻(Thalassiosira pseudonana),发现两者均可改善水质并显著降低水体弧菌浓度,对虾生长速率和终末体质量均显著增加。Ge 等[8]使用小球藻(Chlorella νulgaris)、青岛大扁藻(Platymonas helgolandica)和牟氏角毛藻(Chaetoceros mulleri)三种海洋饵料进行凡纳滨对虾无水交换养殖,发现微藻显著改善了养殖水质、抑制了胃和肠道弧菌增殖,提高了对虾的生长和免疫性能。
波吉卵囊藻(Oocystis borgei)是本团队从对虾高位池中分离并鉴定的一种有益绿藻,可用来构建良性微藻群落,有效吸收养殖水环境中的氨氮[9-11],抑制水体中弧菌的繁殖[12-13],增强对虾抗病力,预防对虾疾病暴发[14]。但目前对波吉卵囊藻提高对虾免疫力的途径和机制还缺乏系统认知。本研究将波吉卵囊藻定向引入凡纳滨对虾养殖水体,分析波吉卵囊藻对凡纳滨对虾早期生长、免疫及肠道菌群的影响,为卵囊藻在对虾生态健康养殖中的应用提供理论基础。
1 材料与方法
1.1 材料
波吉卵囊藻取自广东海洋大学藻类资源开发与养殖环境生态修复实验室,凡纳滨对虾幼虾由湛江恒兴水产科技有限公司提供,饵料为商品化幼虾1 号饵料。实验用水为天然海水,水体经砂滤后用50 mg/L 漂白粉(有效氯质量分数≥20%)消毒12 h,以10 mg/L 硫代硫酸钠曝气24 h 中和后使用。实验用试剂均为分析纯。
1.2 方法
1.2.1 微藻培养 一级培养:实验室内,将波吉卵囊藻接种至含5 L 湛水107-13 培养基的三角烧瓶中,培养温度(25 ± 1)℃,盐度30 ± 2,自然光照辅以日光灯(70 W)24 h 照明,照度为(1 650±950)lx,充气培养2周后进行沉淀浓缩收集。
二级培养:室外500 L PⅤC 水塔中加满消毒海水,添加50 mg/L尿素和5 mg/L磷酸二氢钾,接种浓缩后的一级培养藻液,于自然温度(15~34 ℃)、照度(0.1×104~4.5×104lx)和光昼夜周期循环下充气培养7~10 d。
1.2.2 对虾养殖管理 养殖实验于2022 年5 月在广东海洋大学海洋生物研究基地进行。以接种波吉卵囊藻的对虾养殖为实验组(EC组),未接种的为对照组(CC 组),每组设定3 个养殖重复。选取初始体长(2.68±0.29)cm,初始体质量(0.35±0.02)g的健康凡纳滨对虾,随机分配到含800 L波吉卵囊藻水(接种密度为3.6×104L-1,添加50 mg/L尿素和5 mg/L磷酸二氢钾作为营养盐)或消毒海水的1 000 L 养殖桶中,200 尾/桶。养殖周期为20 d,期间水温25~30 ℃,pH 8.4± 0.3,持续充氧并保持溶氧在6 mg/L以上,每日6:30、12:00、18:00 定量投喂,初始日投喂量为对虾初始体质量的5%,后根据每日摄食情况随时调整日粮配比。每2 d 从底部吸去10%的养殖水体并补充消毒海水,EC组仅在10 d吸底后补充等量波吉卵囊藻藻液(密度3.6×104L-1),养殖期间不再补充营养盐。
1.3 指标测定
1.3.1 样品采集 养殖19 d 后,于各养殖桶中随机取30 尾凡纳滨对虾,停饲24 h,称量体质量,对虾体表用无菌水清洗、用体积分数75%乙醇消毒,无菌解剖其鳃、肝胰腺和肠道组织,并称量肝胰腺质量,取样组织按组别混合后置于无菌冻存管中,液氮速冻后于-80 ℃超低温冰箱中保存。
1.3.2 对虾生长指标测定 计算对虾增重率(Weight gain rate,WGR,%)、特定生长率(Specific growth rate,SGR,%/d)及肝体比(Hepatopancreas somatic indices,HSI,%)等生长指标:
式中,mm、mc和mh分别表示凡纳滨对虾实验终末体质量、实验初始体质量和肝胰腺质量(g);t代表实验时间(d)。
1.3.3 对虾免疫组织的非特异性免疫指标测定 委托南京建成生物工程研究所测定鳃和肝胰腺组织中的免疫酶活性,其中,超氧化物歧化酶(SOD)活性,比色法测定;谷胱甘肽(GSH)活性,DTNB 微板法测定;酸性磷酸酶(ACP)、碱性磷酸酶(AKP)活性,微量酶标法测定;总抗氧化能力(T-AOC),FRAP微板法测定。
1.3.4 对虾肠道微生物的测定和多样性分析 采用HiPure Stool DNA Mini Kit B(广州美基生物科技有限公司)提取对虾肠道组织微生物基因组DNA,使用含barcode的特异引物(341F:CCTACGGGNGGCWGCAG;806R: GGACTACHⅤGGGTATCTAAT)扩增其16S rDNA 的Ⅴ3-Ⅴ4 区,将纯化后的扩增产物连接测序接头,构建测序文库后使用Illumina PE250进行高通量测序。对虾肠道微生物组成的测定交由广州基迪奥生物科技有限公司进行。
用软件DADA2[15]对测序原始数据(raw reads)进行过滤和质控,获得高质量干净数据(clean reads),将干净数据拼接并去除嵌合体后,获得有效标签(Effective tags),用软件Uparse[16]对所有样品的有效标签以100%的相似性聚类为操作分类单元(Operational Taxonomic Units,OTUs),选取每 个OTU 中丰度最高的序列作为代表序列,利用RDP Classifier 朴素贝叶斯算法[17]与16S 数据库对其进行物种注释,分析微生物结构,置信度设为80%。
1.4 数据分析
采用统计软件SPSS 20.0 分析生长和免疫酶活性数据,经比较平均值和独立样本t检验,分析EC组和CC 组数据的差异显著性,数据以平均值± 标准差表示,有统计学意义的差异用星号表示(*,P<0.05;**,P<0.01)。
2 结果与分析
2.1 定培波吉卵囊藻对凡纳滨对虾生长性能的影响
与CC 组相比,波吉卵囊藻调控养殖凡纳滨对虾20 d 后对其增重率和特定生长率无显著影响(P>0.05),但极显著提高对虾的肝体比(P<0.01)(表1)。
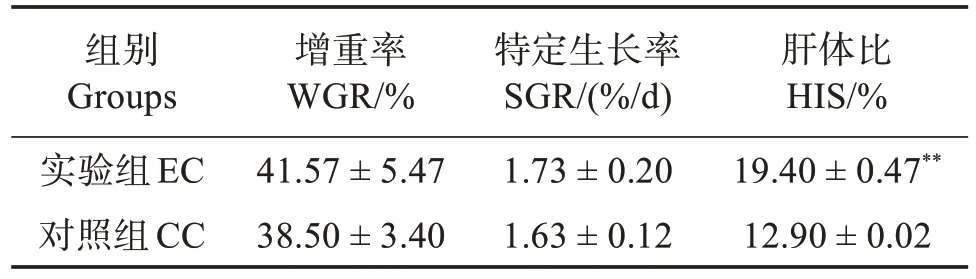
表1 定培波吉卵囊藻对凡纳滨对虾生长性能的影响Table 1 Effects of directional culture of Oocystis borgei on growth performance of Litopenaeus vannamei
2.2 定培波吉卵囊藻对凡纳滨对虾非特异性免疫的影响
相较于CC 组,EC 组中对虾肝胰腺的SOD 和T-AOC 活性极显著提高(P<0.01),GSH、ACP 和AKP活性均无显著差异(P>0.05);同时,EC组对虾鳃中的SOD 和T-AOC 活性均极显著提高(P<0.01),GSH 和ACP 活性显著提高(P<0.05),而AKP 活性无显著差异(P>0.05)(表2),表明波吉卵囊藻调控养殖显著提高了凡纳滨对虾肝胰腺和鳃的非特异性免疫能力。
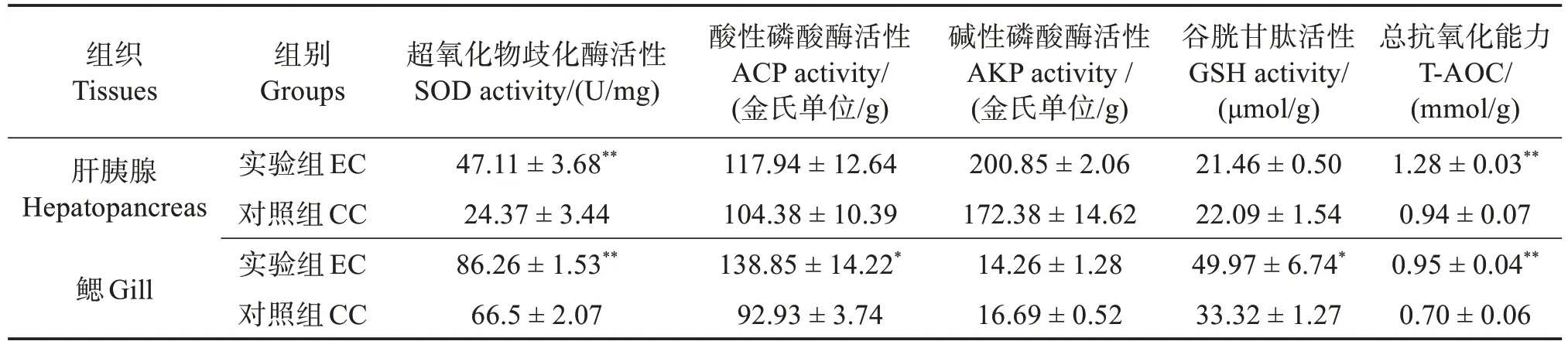
表2 定培波吉卵囊藻对凡纳滨对虾肝胰腺和鳃非特异性免疫的影响Table 2 Effects of directional culture of Oocystis borgei on nonspecific immunity of hepatopancreas and gill of Litopenaeus vannamei
2.3 定培波吉卵囊藻对凡纳滨对虾肠道菌群的影响
2.3.1 测序样本序列信息 将6 个样本测序后的776 538 条原始数据拼接、质控后获得754 123 条纯净数据,纯净数据拼接去除嵌合体后获得569 643条有效标签,其N50和N90均为430 bp,聚类有效标签最终得到18 347 个OTU 用于比较两组样品间微生物群落结构,其中,EC 组的OTU 数量均高于CC组(表3)。
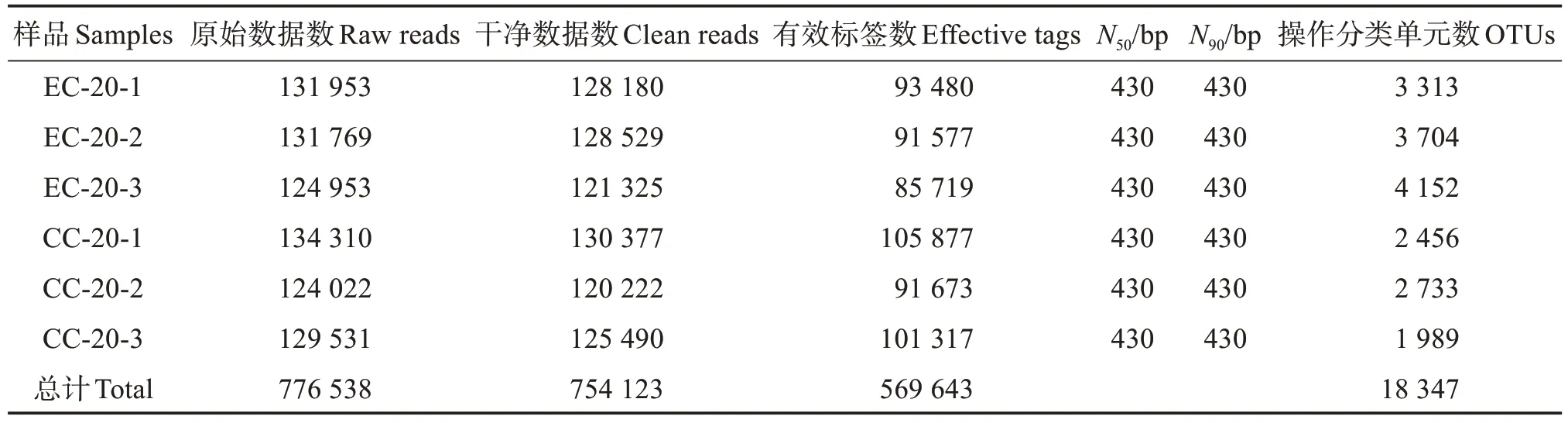
表3 凡纳滨对虾肠道微生物测序数据量及质量Table 3 Data quantity and sequencing quality of intestinal sequences of Litopenaeus vannamei
2.3.2 对虾肠道微生物物种注释与分布 对OTUs一致序列的物种注释表明,OTUs主要隶属26门,58纲,140 目,203 科和349 属,还有一些OTUs 未鉴定出分类地位,属于unclassified序列。
在门水平上,EC 组和CC 组凡纳滨对虾肠道菌群主要是由变形菌门(Proteobacteria)、浮霉菌门(Planctomycetota)、拟杆菌门(Bacteroidota)、梭杆菌门(Fusobacteria)和放线菌门(Actinobacteriota)等组成(图1),在EC 组中分别占62.07%、10.75%、7.34%、3.90%和3.41%,在CC 组中分别占71.94%、7.84%、10.40%、1.18%和1.64%(表4),表明定向引入波吉卵囊藻,对虾肠道菌群中变形菌门比例显著降低(P<0.05),拟杆菌门含量有所下降,而梭杆菌门和放线菌门含量有所提高,但差异不显著(表4)。

图1 凡纳滨对虾肠道微生物在门、科、属分类水平上的物种丰度Fig.1 Community abundance of intestinal microflora of Litopenaeus νannamei at phylum,family and genus classification level

表4 各组物种注释中前10个优势菌门的相对丰度Table 4 Community abundance of the top 10 dominant bacteriophyta in each group
在科水平上,除无法鉴别的种类外,凡纳滨对虾肠道优势菌主要由弧菌科(Ⅴibrionaceae)、红杆菌科(Rhodobacteraceae)及黄杆菌科(Flavobacteriaceae)组成(图1)。与CC 组相比,EC 组中弧菌科丰度有降低趋势,但差异不显著(P=0.074 6),而红杆菌科丰度有升高趋势,但差异不显著(P=0.176 9)。
在属水平,EC 组和CC 组共有物种174 个,EC组特有物种75 个,CC 组特有物种91 个,两组中弧菌属(Vibrio)、发光杆菌属(Photobacterium)和鲁杰氏菌属(Ruegeria)均为优势菌属(图1),然而定向引入波吉卵囊藻后,EC 组弧菌属相对丰度与CC 组相比明显下降(P=0.058 6)。
2.3.3 对虾肠道微生物的α多样性α多样性可反映样本物种的多样性和丰度情况,Shannon 和Simpson指数常用来度量样品菌群多样性,而用Chao 1 指数来度量样品菌群丰度。由表5 可见,EC 组对虾样本肠道菌群的Shannon 和Chao 1 指数显著低于CC 组(P<0.05),而Simpson 指数无显著差异(P>0.05),表明在凡纳滨对虾养殖水体中定向培养波吉卵囊藻,降低了对虾肠道微生物的多样性和丰度。此外,所有样本的Good’s覆盖率均为100%,表明测序数据充足可靠,不存在没有多样性分析的序列。

表5 凡纳滨对虾肠道微生物α多样性指数Table 5 Alpha diversity index of intestinal microbial community of Litopenaeus vannamei
2.3.4 对虾肠道微生物的β多样性分析 属水平物种PCoA 主成分分析结果(图2(A))显示,EC 组样本聚在在左侧,而CC 组样本聚集在右侧,构成两个独立的组群,表明两组物种组成有明显差异。基于Weighted Unifrac 距离算法的属水平物种UPGMA聚类分析(图2(B))显示,EC 组样本和CC 组样本单独聚类,与PCoA主成分分析结果一致。
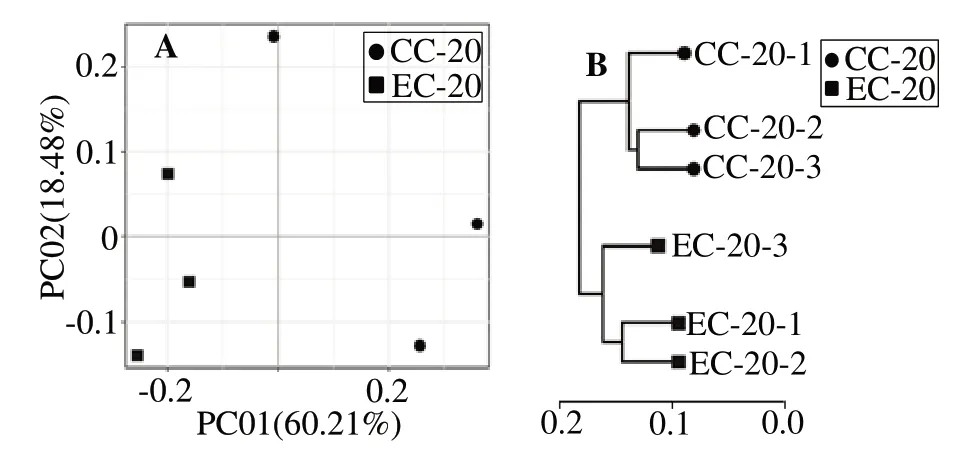
图2 凡纳滨对虾肠道微生物属水平的PCoA分析和UPGMA聚类树Fig.2 PCoA analysis and UPGMA clustering tree of intestinal microbes of Litopenaeus νannamei at genus level
3 讨论
3.1 定培波吉卵囊藻对凡纳滨对虾生长性能的影响
养殖水体中定向引入波吉卵囊藻对凡纳滨对虾早期的增重率和特定生长率无显著影响,但对对虾肝体比体有一定促进效应。肝体比是动物健康程度的重要评价指标,一定程度上可反映肝胰腺功能强弱与受损程度。在对虾养殖中,肝胰腺明显萎缩是对虾不健康的表征之一,严重时可能会造成对虾死亡[18]。周琳玉等[19]发现,凡纳滨对虾的肝体比、肝胰腺E 细胞、B 细胞和R 细胞数量的提高,使得对虾肝胰腺再生能力增强,同时也能降低肝胰腺组织的氧化损伤,增强其免疫力,有利于对虾生长。本研究中,定培波吉卵囊藻使凡纳滨对虾肝体比极显著提高,表明对虾肝胰腺免疫功能增强。此外,肝胰腺为甲壳动物储存营养物质的重要器官,肝体比也是其能量储备的指标之一。克氏原螯虾(Procambarus clarkii)肝体比增加可能由成熟过程中脂质在肝胰腺中大量积累所造成[20]。综上,本研究定向引入波吉卵囊藻后凡纳滨对虾生长早期肝体比显著提高,说明卵囊藻可能增强了凡纳滨对虾肝胰腺的抗氧化能力和脂肪供能等生理过程。
3.2 定培波吉卵囊藻对凡纳滨对虾抗氧化能力的影响
活性氧(Reactive oxygen species,ROS,如O2-与H2O2等)是动物免疫系统中的细胞毒性成分,是在机体受到逆境胁迫及抗应激时产生的重要物质[21]。SOD 是动物体内重要的抗氧化酶之一,可及时清除机体产生的ROS,使机体细胞免受损伤[22],是评价实验动物免疫水平的重要指标[23-25]。T-AOC 是评价细胞或机体内各种抗氧化酶和抗氧化物质等生物活性物质总抗氧化水平的综合指标。GSH 作为机体抗氧化系统的重要组成部分,也是重要的抗氧化剂和自由基清除剂,可与谷胱甘肽系统中的其他三种酶(谷胱甘肽过氧化物酶GSH-Px、谷胱甘肽巯基转移酶GST 和谷胱甘肽还原酶GSR)形成抗自由基防线[26]。此外,抗氧化能力的增强也有利于提高水生生物的解毒能力[27-28]。本研究中,EC 组凡纳滨对虾肝胰腺和鳃中SOD 和T-AOC 活性以及鳃中GSH活性显著增加,表明定向引入波吉卵囊藻可增加凡纳滨对虾早期的免疫能力,提高对虾肝胰腺和鳃的排毒能力。微藻提高水产动物免疫力主要有两种方式,一是微藻富含多种生物活性物质,可作为饵料或饲料添加剂为养殖动物提供营养、能量和提高抗氧化力、增强免疫力等[29-30],二是将微藻引入养殖系统,改善养殖水体环境,增强养殖动物的抗病力、免疫力,如养殖水体接种蛋白核小球藻(Chlorella pyrenoidosa)可提高凡纳滨对虾肝胰腺的SOD 和GSH 活性[31];将不同浓度的产毒颤藻(Oscillatoriasp.)投加到凡纳滨对虾养殖水体中,低浓度颤藻引起机体免疫力增益,组织的过氧化物酶(POD)、SOD、PO、GST 和抗菌活性均增加[32],波吉卵囊藻和微绿球藻定向引入凡纳滨对虾成虾养殖水体可显著提高对虾血清SOD和酚氧化酶(PO)活性[14],本研究将波吉卵囊藻引入凡纳滨对虾幼体养殖水体也得到了类似结论。
3.3 定培波吉卵囊藻对凡纳滨对虾肠道菌群的影响
对虾肠道健康与肠道菌群的组成和结构密切相关,肠道菌群易受养殖水环境影响,其中,水体微生物(包括细菌、病毒、真菌以及一些小型的原生生物、微藻等)[33]是对虾肠道菌群最关键的环境影响因子,尤其对早期肠道菌群的结构与组成有决定性作用[34],还会对宿主的健康有直接影响,如在健康状态下,养殖水体中的细菌群落和对虾肠道菌群间无显著差异,但在患病情况下,二者存在显著差异[35]。本研究多样性分析表明,凡纳滨对虾养殖水体中定向引入波吉卵囊藻降低了对虾肠道微生物的多样性和丰度,在门水平上,EC 组和CC 组对虾肠道菌群种类基本一致,均主要由变形菌门、拟杆菌门、放线菌门等组成,这与前人研究[36]一致;然而各菌群组成比例有明显差异,EC组对虾肠道菌群中变形菌门和拟杆菌门丰度降低,放线菌门丰度增加。研究表明,变形菌门丰度提高可能会对虾类产生潜在风险[37-38],而患病的凡纳滨对虾肠道中的拟杆菌门丰度会显著提高[39];此外,吴金凤等[40]研究发现,健康对虾肠道中放线菌门的相对丰度显著高于发病对虾肠道,与本研究结果一致。由此推断,波吉卵囊藻是通过改变肠道菌群中核心门类的丰度,从而增强对虾肠道菌群的稳态,改善对虾肠道健康。
弧菌是对虾养殖中常见的致病菌,也是对虾罹患某些疾病状态下(如患急性肝胰腺坏死综合征)肠道内的绝对优势菌群,严重影响其生存和健康[41]。Ge等[8]将小球藻(C.νulgaris)、青岛大扁藻(P.helgolandica)和牟氏角毛藻(C.mulleri)引入凡纳滨对虾养殖系统,发现3 种微藻显著抑制了对虾肠道中的弧菌数量,其中青岛大扁藻更能有效抑制肠道弧菌生长,并推测弧菌数量减少可能是由于养殖水体中存在微藻而有效控制了水质。此外,有些微藻可产生抑制细菌生长的抗生素[42],有些微生物絮凝物还可通过竞争性排斥来抑制弧菌的生长、调节机体免疫或提供营养来源[43]。本研究中EC 组对虾肠道菌群中隶属于变形菌门的弧菌科和弧菌属含量均明显降低,表明定向引入波吉卵囊藻可有效降低对虾肠道某些主要门类中有害菌群的丰度,改善对虾肠道健康,这也与拟杆菌门和黄杆菌科的丰度变化相呼应。黄杆菌科隶属于拟杆菌门,是一种条件致病菌,在凡纳滨对虾养殖密度过高时对虾肠道中黄杆菌科丰度也升高,可能对对虾机体造成不利影响[44]。相比之下,定向引入波吉卵囊藻后对虾肠道中的有益菌丰度有所增加,如红杆菌科。红杆菌科是一种重要的海洋细菌谱系,可产生广谱性抗菌物质TDA(Tropodithietic acid),破坏目标微生物的质子动力或作为信号分子影响细菌基因表达[45],某些产TDA的菌群可对抗致病性弧菌的侵害,保护轮虫等海洋饵料生物,可作为有益菌开发[46-47],这也可能是本研究中弧菌丰度降低的原因。综上,波吉卵囊藻对凡纳滨对虾肠道菌群的影响表现为降低有害细菌丰度,而提高有益菌丰度,而其抑制肠道有害菌是由于波吉卵囊藻产生抑制生长的抗菌物质的抑制作用,或者仅由接种波吉卵囊藻改善了养殖水质导致,这需要进一步研究。
4 结论
定向引入波吉卵囊藻可极显著提高凡纳滨对虾早期的肝体比,增强其抗氧化能力,影响肠道菌群中核心门类的组成,增加有益菌的丰度,减少有害弧菌的含量,进一步提高对虾肠道菌群的稳定性,从而有助于完善其肠道免疫系统和提高抗病力。

