太平洋亚历山大藻对凡纳滨对虾的急性毒性效应
杨惠婕,张玉蕾,刘碧洪,李长玲,黄翔鹄
(广东海洋大学水产学院,广东 湛江 524088)
赤潮生物包括原生动物,细菌及如甲藻、硅藻等藻类。其中有毒、有害赤潮藻类以甲藻居多,其次为硅藻、蓝藻、金藻和隐藻等[1]。藻华有害的原因是有毒微藻的大量增殖,产生的藻毒素可能会污染水环境或鱼、虾、贝类等的食物,导致其窒息死亡,食用此类水产品也可能造成人类患病[2-5]。甲藻作为典型的赤潮生物种,能够产生甲藻毒素。例如,短裸甲藻(Gymnodinium breνe)分泌的毒素为神经性贝毒;利马原甲藻(Prorocentrum lima)可产生腹泻性贝毒。太平洋亚历山大藻(Alexandrium pacificum)是塔玛亚历山大藻(Alexandrium tamarense)复合体中的一种[6],其毒素类型为麻痹性贝毒(PSP),毒素谱主要成分为N-磺基氨基甲酰基衍生物(C1/C2,B1)、膝沟藻毒素(GTX1/GTX4)和新石房蛤毒素(NEO)[7-8]。亚历山大藻一旦暴发,其产生的PSP 可经过食物链在鱼、虾、贝类等生物体内蓄积,会造成严重的水环境问题,对水产养殖业造成经济损失[9-11]。更甚者,从甲藻中提取的PSP 毒素可导致凡纳滨对虾的死亡[12]。研究表明,水生生物暴露于PSP 后,主要的应激反应包括产生大量活性氧(ROS),诱导抗氧化应激(包括酶促和非酶促防御)反应[13]、细胞内氧化还原稳态失衡[14]和导致细胞损伤(即脂质过氧化)[15]。
作为评估环境胁迫对生物体产生氧化胁迫的一类生物标志物,抗氧化系统通过监测脂质过氧化水平和抗氧化酶活力的改变,从而评估污染物的毒性效应[16-17]。研究表明,亚历山大藻会影响鱼、虾、贝类的生长及免疫功能[10,18-20]。但太平洋亚历山大藻对凡纳滨对虾(Litopenaeus νannamei)的整体抗氧化酶系的影响还未见报道。因此,本研究将凡纳滨对虾急性暴露在高浓度的太平洋亚历山大藻破碎液中72 h,从对虾重要的解毒器官和代谢中心——肝胰腺入手,检测其丙二醛(MDA)、谷胱甘肽(GSH)含量以及超氧化物歧化酶(SOD)、谷胱甘肽—S 转移酶(GST)、碱性磷酸酶(AKP)、多酚氧化酶(PPO)多种抗氧化酶活力的变化;同时观察对虾重要器官组织的病理损伤情况。通过抗氧化水平和病理两方面的结果,分析太平洋亚历山大藻对凡纳滨对虾的毒性效应,以期为研究赤潮有毒藻对水产动物的毒性作用机制提供思路,为甲壳类动物在太平洋亚历山大藻胁迫下存在的解毒机制提供理论支持。
1 材料与方法
1.1 材料
太平洋亚历山大藻的基本培养条件:温度22 ℃,盐 度25,光 照50 μmol·m-2·s-1,光暗比14 h∶10 h,采用f/2培养基培养置于光照培养箱中培养,每天定时摇瓶3次。
凡纳滨对虾由广东省湛江市东海岛试验基地提供,体长(5.3 ± 0.3)cm,体质量(2.5 ± 0.5)g,对虾在实验室暂养一周,养在消毒处理的海水中。待处于稳定状态后,选取健康、活泼、生长状况相似的对虾进行实验。
养殖海水采自广东省湛江市东海岛,盐度调至25后消毒处理。
1.2 太平洋亚历山大藻破碎液制备
将太平洋亚历山大藻藻液在4 ℃、4 000 r/min条件下离心2 min,分别收集上清以及藻细胞,浓缩藻细胞到5.0×105/mL。浓缩后混入0.5 mm 氧化锆珠,用组织破碎仪进行破碎,破碎条件为70 Hz、2 min。
1.3 太平洋亚历山大藻暴露实验
1.4 酶活测定
在0、3、6、9、12、24、48、72 h 分别从对照组和实验组的每个平行中各随机选取6 尾虾,取其肝胰腺液氮速冻,-80 ℃保存备用。
肝胰脏解冻后准确称取组织重量,按质量(g)∶体积(mL)=1∶10比例加入预冷生理盐水,高速研磨仪处理,然后以2 500 r/min离心10 min,取上清液用于酶活力测定。总蛋白以牛血清白蛋白BSA 为标准,Bradfords 法测定。SOD、GST、AKP、PPO 活力和MDA、GSH 含量采用南京建成生物工程研究所的试剂盒,按照各说明书进行测定。每项酶促测定均进行3个重复。
1.5 病理切片观察
在暴露72 h 后分别从对照组和实验组的每个平行中各随机选取2尾虾,取其肠道、肝胰腺、鳃、神经和肌肉,置于Bouins固定液,4 ℃保存。石蜡包埋切片,HE 染色,Olympus显微镜拍照,观察其组织病理变化。
1.6 数据处理统计
所有实验均重复3 次。使用GraphPad Prism 软件绘制存活率曲线图。对于不符合正态分布的存活率结果,对数据进行平方根反正弦转换处理。所有数据采用“平均值±标准误(X±SD)”表示,酶活以及存活率数据均采用SPSS 20.0 软件进行单因素方差(One-way ANOⅤA)分析和Duncan 多重比较检验处理,有统计学意义的显著性差异用星号表示(*P<0.05,**P<0.01)。
2 结果
2.1 太平洋亚历山大藻对凡纳滨对虾存活的影响
如图1 所示,太平洋亚历山大藻对凡纳滨对虾的存活率具有显著影响(P<0.01);在实验进行9 h后,实验组的对虾出现死亡,且存活率随暴露时间的增加而降低。
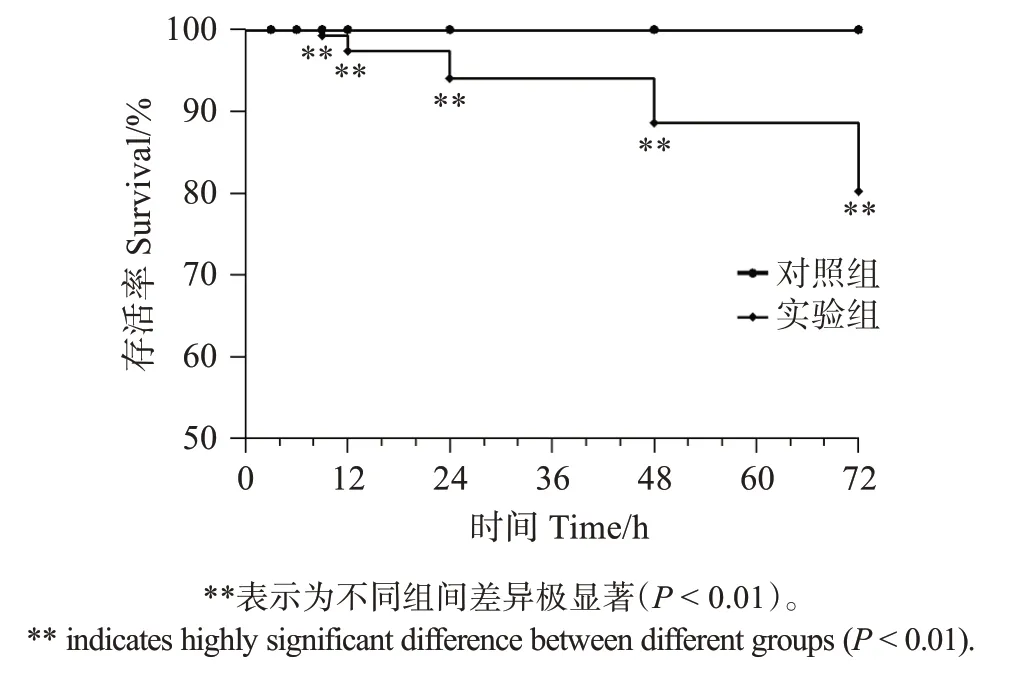
图1 太平洋亚历山大藻破碎液对凡纳滨对虾存活的影响Fig.1 Effect of Alexandrium pacificum on the survival of Litopenaeus νannamei
2.2 太平洋亚历山大藻胁迫下凡纳滨对虾的抗氧化酶的变化
在实验处理3 h 时,SOD 活力极显著低于对照组(P<0.01);在处理6 h 时,实验组对虾的SOD 活力显著高于对照组(P<0.01);在9 h 时,实验组SOD 活力极显著低于对照组(P<0.01);在48 h 时,实验组SOD 活力与对照组相比显著升高(P<0.05);在72 h 时,实验组的SOD 活力显著低于对照组(P<0.01)(图2(A))。
由此可见,努力提高失地农民再就业培训的“参与比率”,对于建构长效再就业培训系统、缓解失地农民结构性失业问题、落实“就业是最大民生”的治国理念而言,都具有重要的实践意义。
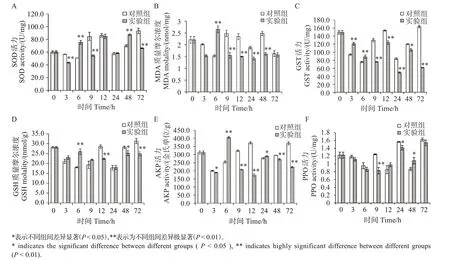
图2 太平洋亚历山大藻破碎液处理对凡纳滨对虾肝胰腺抗氧化水平的影响Fig.2 Effects of solution of crushed Alexandrium pacificum on antioxidant levels in hepatopancreas of Litopenaeus νannamei
太平洋亚历山大藻对凡纳滨对虾MDA 质量摩尔浓度的影响如图2(B)。在实验处理3 h 时,MDA质量摩尔浓度极显著低于对照组(P<0.01);在连续处理6 h 时,实验组对虾的MDA 质量摩尔浓度显著高于对照组(P<0.01);在9、12、24和48 h时,实验组MDA质量摩尔浓度均极显著低于对照组(P<0.01)。
太平洋亚历山大藻对凡纳滨对虾GST 活力的影响如图2(C)。在实验处理3、6 h 时,GST 活力极显著高于对照组(P<0.01);在9、12、24 和72 h 时,GST 活力极显著低于对照组(P<0.01);在48 h 时,实验组的GST活力显著低于对照组(P<0.05)。
太平洋亚历山大藻对凡纳滨对虾GSH 质量摩尔浓度的影响如图2(D)。在实验处理6 h 时,GSH质量摩尔浓度极显著高于对照组(P<0.01);在连续处理12 h 时,GSH 质量摩尔浓度极显著低于对照组(P<0.01);在48 h 时,GSH 质量摩尔浓度与对照组相比显著下降(P<0.05);72 h 时,实验组的GSH 质量摩尔浓度极显著低于对照组(P<0.01)。
太平洋亚历山大藻对凡纳滨对虾AKP 活力的影响如图2(E)。在实验处理3 h 时,AKP 活力显著低于对照组(P<0.05);6 h 时,实验组AKP 活力极显著高于对照组(P<0.01);在9、12、48 和72 h 时,实验组AKP的活力均显著低于对照组(P<0.05)。
太平洋亚历山大藻对凡纳滨对虾PPO 活力的影响如图2(F)。PPO 活力在实验处理9 h 时开始被诱导。在9 h 时,实验组极显著低于对照组(P<0.01);在48 h 时,实验组的PPO 活力与对照组相比显著升高(P<0.05)。
2.3 太平洋亚历山大藻胁迫下凡纳滨对虾的组织病理变化
对照组对虾的肠上皮细胞紧密连接,排列整齐、致密,外层结缔组织厚,可见血窦分布(图3(A));暴露在太平洋亚历山大藻破碎液中72 h后,对虾肠上皮细胞间黏附力下降,细胞空泡化或自溶,组织细胞间隙变大、解体(图3(B))。
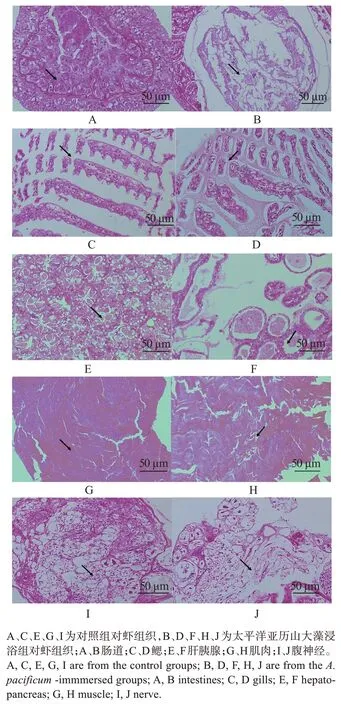
图3 太平洋亚历山大藻暴露72 h后凡纳滨对虾组织结构的变化Fig.3 Changes in tissue structure of Litopenaeus νannamei after 72 h exposure to Alexandrium pacificum
对照组对虾的鳃丝排列整齐,结构清晰,细胞和核明显(图3(C));暴露在太平洋亚历山大藻破碎液中72 h 后,对虾的鳃丝排列紊乱,有的区域出现黏连,核固缩,变小或消失(图3(D))。
对虾的肝胰腺为复管状腺,由多级分支的小管组成;肝小管外壁由单层柱状上皮细胞构成,其上皮细胞按功能分为吸收细胞和分泌细胞。各肝胰腺小管之间有结缔组织与脂肪组织包裹与分隔,管腔呈五角或四角星形。对照组对虾的肝胰腺小管结构完整,基底膜完整,边界清晰,管腔呈星形(图3(E));暴露在太平洋亚历山大藻破碎液中72 h后,对虾肝小管管腔扩大,形状不规则,吸收细胞和分泌细胞出现空泡化(图3(F))。
对照组对虾肌肉组织及肌纤维纹路清晰、排列致密(图3(G));暴露在太平洋亚历山大藻破碎液中72 h 后,对虾肌束萎缩,相邻肌束间距较大,肌纤维排列杂乱(图3(H))。
对照组腹神经由多个节间神经纤维束连成的神经节构成,两侧融合,纤维束分成两束,纵向把各个神经节联系起来,髓质明显(图3(I));暴露在太平洋亚历山大藻破碎液中72 h 后,对虾神经束间隙变大,神经节分布散乱(图3(J))。
3 讨论
太平洋亚历山大藻是一种喜高光微藻,实验室培养的照度一般为50 μmol·m-2·s-1[21],在温度为17~25 ℃[22]、盐度为23~27 条件下生长最佳[23];当温度低于10 ℃或者高于30 ℃,藻细胞则会停止生长甚至短时间内死亡[22]。根据本实验室前期培养情况,温度22 ℃,盐度25,照度50 μmol·m-2·s-1,光暗比为14 h∶10 h 时藻生长最佳。太平洋亚历山大藻及其产生的毒素,如麻痹性贝毒、溶血素等,可对水生动物产生急性毒性作用,导致水生动物行为改变、生殖中断、生长迟缓和酶活力降低,甚至直接造成海洋生物死亡[24]。研究发现,亚历山大藻对黑褐新糠虾(Neomysis awatschensis)有致死作用[25],其去藻过滤液也能显著提高糠虾的死亡率;亚历山大藻对凡纳滨对虾蚤状幼体的96 h 致死半浓度LC50为7 500 mL-1[26];斑节对虾(Penaeus monodon)暴露于10 000 mL-1亚历山大藻中,12 h 后出现虾死亡现象[27],并且在死亡对虾的鳃和胃里发现亚历山大藻细胞。结合前期预实验,选择1.0×104mL-1作为急性研究浓度。
在甲壳类动物中,肝胰腺是重要的解毒器官,也是清除多余ROS 的重要代谢中心,在免疫系统中发挥着关键作用[28-29]。凡纳滨对虾体内ROS的产生和代谢之间存在动态平衡。受到太平洋亚历山大藻毒素PSP 氧化胁迫时,对虾体内ROS 和抗氧化防御系统之间的平衡被打破[30],表现为氧化应激,可诱导抗氧化酶活力的改变。抗氧化酶通过灭活ROS和修复氧化生物分子来保护生物体免受氧化损伤[31]。因此,抗氧化酶活力的变化能够反映机体氧化损伤的水平[32-33]。
丙二醛(MDA)作为机体脂质过氧化作用的终产物,其含量变化水平能直接反映出PSP引起的组织细胞膜损伤情况[18]。研究表明,微囊藻(Microcystis)可导致罗非鱼(Oreochromis mossambicus)组织脂质过氧化[34];有毒裸甲藻可诱导扇贝过氧化脂质增加[14]。本研究中,6 h 时,对虾肝胰腺组织MDA 含量显著高于对照组,表明太平洋亚历山大藻诱导了凡纳滨对虾的肝胰腺脂质过氧化,这也是造成对虾组织细胞的膜溶解、破裂的重要原因。超氧阴离子(O2-)是ROS 主要的自由基,过氧化物歧化酶(SOD)的作用是把O2-歧化成H2O2和O2,免除多余的高活性氧化物质对机体的迫害[35]。本研究中,6 h 时,对虾肝胰腺组织SOD 活力较于对照组显著增高,表明对虾发生脂质过氧化后,SOD 能积极发挥作用清除生物体内过量的O2-;有研究表明,在大量O2-被SOD 歧化过程中,生成的H2O2会抑制SOD 活力[36]。本研究中,9 h 时,实验组中SOD 活力以及MDA 含量显著低于对照组,表明对虾受到氧化胁迫后,SOD 被迅速诱导,一定程度上抑制了脂质过氧化作用;同时,清除活性氧所产生的H2O2也使SOD活力降低。
谷胱甘肽S-转移酶(GST)不仅能抑制脂质过氧化,清除体内氧自由基,还有解毒功能。GST 催化谷胱甘肽(GSH)与多种内源性和外源性亲电化合物的偶联,减少亲电分子与细胞内生物大分子(如DNA)等结合形成脂类过氧化物,从而抑制脂质过氧化作用[37-39]。GST还可催化GSH与毒性化合物的活力产物共轭结合,从而达到解毒作用。本研究中,6 h 时,实验组对虾的GST 活力显著高于对照组。GST 活力被诱导是机体对氧化胁迫的适应性反应[40-42],表明凡纳滨对虾受到太平洋亚历山大藻毒素胁迫后,一方面为清除大量产生的氧自由基,对虾肝胰腺增强GST 活力来抵抗伤害,抑制脂质过氧化;另一方面,GST 被激活参与了太平洋亚历山大藻所产有毒物质的代谢及解毒过程[24,43]。GST 活力变化与GSH结果相呼应,GSH可作为反应底物通过GST 催化清除自由基和过氧化物,具有抗氧化作用和整合解毒作用,在免疫系统中发挥着关键作用[44-45]。此外,GSH 还会在甲壳动物代谢过程中诱导毒素转化[46-47]。江天久等[48]研究发现,中国龙虾(Panulirus stimpsoni)受PSP 胁迫后,GSH 诱导毒素由GTX2,3 转换成了GTX1,4。本研究中,实验组对虾肝胰腺组织GSH含量在6 h时显著高于对照组,表明对虾在太平洋亚历山大藻的胁迫下,机体产生了过量的氧自由基,诱导了GSH 的生成以加速消除多余的氧自由基,对抗氧自由基对肝胰腺的损害。这与梁忠秀等[49]将中国对虾(Fenneropenaeus chinensis)暴露于亚历山大藻中测得结果一致。
碱性磷酸酶(AKP)能有效地清除入侵甲壳动物的污染物和毒素[50]。AKP 作为溶酶体酶的重要组成部分,参与一系列的生理代谢活动,如膜的分子渗透、细胞生长和分化,以及一些磷素和其他营养物质的消化、吸收和运输等。本研究中,6 h时,实验组AKP活力显著高于对照组,表明在氧化应激状态下,溶酶体膜的通透性增强,溶酶体酶进入胞浆后AKP被激活。
在72 h,SOD、GST、AKP 活力以及GSH 含量均显著低于对照组,表明对虾暴露在高浓度的太平洋亚历山大藻后受到了严重的氧化胁迫,高强度胁迫导致对虾应激系统紊乱,溶酶体失去稳定,这可能是一种潜在的细胞凋亡的早期信号,说明随后产生积累的氧自由基会促使细胞发生凋亡[51]。此外,GST活力被抑制,可影响机体的解毒功能[24],增强对虾对需经GST代谢的外源性毒物的敏感性[52]。
多酚氧化酶(PPO)是一种双功能的含铜酶[53],是酚氧化酶原激活系统识别异物和免疫反应的起点,其活力高低影响着对虾免疫系统对进入体内的异物反应速度和强度,以及激活后续反应如凝集、吞噬、黑化等作用的效率。在甲壳动物中,PPO 以酚氧化物酶原的形式存在,能够被一些蛋白质或多糖激活而转变成活力的多酚氧化物酶。在9 h 时,实验组肝胰腺的PPO 活力显著低于对照组。分析其原因,一方面可能是由于对虾在受到氧化胁迫时,诱导了GSH 等抗氧化酶的活力,肝胰腺内蛋白质、多糖等生物大分子与GSH 发生共轭反应,酚氧化酶原无法被激活;另一方面可能是在氧自由基的催化下,PPO 被活化,迅速黏附异物进行识别,诱导有关底物由酚转化到醌,最终产生黑色素,抑制病原体胞外蛋白酶和几丁质酶的活力。48 h 时,实验组肝胰腺的PPO 活力显著高于对照组,表明对虾防御体外物质入侵的过程大量PPO 被活化,以抑制氧自由基的胁迫。由此可见,在太平洋亚历山大藻的胁迫下,凡纳滨对虾肝胰腺的SOD、GSH、GST、AKP 和PPO 均会被诱导发挥作用,清除过量的活性氧,抑制脂质过氧化,抵御外来毒性。
太平洋亚历山大藻所产的PSP 毒素,是特异性钠离子通道阻断剂,可导致膜内外的渗透压不平衡,从而使膜部分溶解。PSP毒素进入生物体后,机体产生的大量活性氧自由基会导致细胞膜脂质过氧化[49,54],生成的脂质过氧化物(如MDA)等与膜上蛋白质反应会增加膜的通透性,引起膜结构溶解。此外,GSH 还会诱导PSP 毒素发生毒素成分的转化[55-56],这种转化会产生大量的活性氧自由基[49],导致细胞膜脂质过氧化[54],造成细胞膜溶解。此外,膜结构的破损会加速PSP 的侵入,使更多的藻毒素进入细胞内。本研究中,将凡纳滨对虾暴露于太平洋亚历山大藻后,其肠道、鳃和肝胰腺的上皮细胞均出现空泡化,细胞出现了黏连,膜出现了溶解,这正是细胞膜脂质过氧化的结果。梁忠秀等[57]将中国对虾暴露于亚历山大藻中,发现对虾肝胰腺中的吸收细胞和分泌细胞均出现了空泡化,与本实验结果一致。其中,对虾鳃组织肿胀、鳃丝部分黏连,这和鳃直接与藻接触或是直接接触了太平洋亚历山大藻分泌的其他藻毒素有关[58]。亚历山大藻对鳃的机械损伤已在鱼类的研究中得到证实[10,19]。鳃是虾类的呼吸器官,是太平洋亚历山大藻最初作用的器官,鳃的病变会直接导致对虾窒息死亡。神经作为靶器官之一,PSP会损伤虾的神经节,导致神经节髓质分裂以及细胞溶解,从而导致麻痹、痉挛等异常行为或死亡[10]。神经系统麻痹后,对虾肌束萎缩,肌纤维排列杂乱。这也是造成对虾神经束间隙变大,神经节分布散乱,神经细胞溶解的原因。因此,高浓度的PSP毒素暴露会造成对虾重要组织及器官的损伤。其中,鳃的病变以及神经系统的受损均会导致对虾死亡。此外,由于对虾的抗氧化和解毒代谢能力有限,机体抗氧化酶系在高浓度的PSP 毒素暴露下会严重受损,导致对虾死亡。这些都是太平洋亚历山大藻对凡纳滨对虾的急性毒性影响,将有助于解释其对对虾的致毒机制。
4 结论
太平洋亚历山大藻毒素会降低凡纳滨对虾的存活率;对凡纳滨对虾肝胰腺具有脂质过氧化作用,会诱导MDA 含量增加,导致对虾氧化应激和组织损伤。凡纳滨对虾在太平洋亚历山大藻暴露下,SOD、GSH、GST、AKP 和PPO 均被激活以清除过量的活性氧,抑制脂质过氧化,抵御外来毒性。在严重的氧化胁迫下,凡纳滨对虾的肠道、肝胰腺、鳃、肌肉和神经组织严重受损,对虾氧化-抗氧化系统的平衡遭到破坏,对虾的免疫功能遭到损伤,多种免疫酶活力均被抑制。

