血清25(OH)D、叶酸水平在孤独症谱系障碍患儿中的临床意义
赵婷婷 童光磊 李红
【摘要】 目的:了解孤獨症谱系障碍(ASD)患儿血清25(OH)D、叶酸水平,分析其与患儿病情及发育情况的关系,以期为ASD患儿提供全新的药物治疗思路。方法:选取安徽省儿童医院2021年6月-2022年6月就诊的114例ASD患儿为ASD组,选取同期在本院体检的100例健康儿童为正常组,比较两组血清25(OH)D、叶酸水平,同时采用儿童孤独症评定量表(CARS)评估ASD患儿病情的严重程度、格里菲斯发育评估量表-中文版(GDS-C)评估ASD患儿的发育水平,并将血清指标与病情严重程度、发育水平进行相关性分析。结果:ASD组血清25(OH)D、叶酸水平分别为(33.28±11.05)、(14.74±4.84)ng/mL,均低于正常组的(44.71±6.32)、(23.17±6.16)ng/mL(P<0.05)。ASD组CARS评分为(33.11±2.01)分,GDS-C评分为(58.49±10.70)分。ASD组的血清25(OH)D、叶酸水平与CARS评分均呈负相关(P<0.05),与GDS-C评分均呈正相关(P<0.05)。结论:ASD患儿血清25(OH)D、叶酸水平较正常儿童降低,且与患儿的病情严重程度及发育水平相关。
【关键词】 孤独症谱系障碍 25羟维生素D 叶酸 儿童孤独症评定量表 格里菲斯发育评估量表-中文版
Clinical Significance of Serum 25 (OH) D and Folic Acid Levels in Children with Autism Spectrum Disorder/ZHAO Tingting, TONG Guanglei, LI Hong. //Medical Innovation of China, 2023, 20(09): -107
[Abstract] Objective: To investigate the levels of serum 25 (OH) D and folic acid in children with autism spectrum disorder (ASD), and to analyze the relationship between serum 25 (OH) D and folic acid in children with ASD, so as to provide a new idea of drug treatment for children with ASD. Method: A total of 114 children with ASD who received medical treatment in Anhui Provincial Children's Hospital from June 2021 to June 2022 were selected as the ASD group, and 100 healthy children who underwent physical examination in our hospital during the same period were selected as the normal group. The differences in serum 25 (OH) D and folic acid levels between the two groups were compared. At the same time, the children's autism rating scale (CARS) was used to evaluate the severity of ASD, and Griffiths developmental scale-Chinese version (GDS-C) was used to evaluate the development level of ASD children, and the correlation between serum indicators and the severity of ASD and development level was analyzed. Result: Serum 25 (OH) D and folic acid levels in ASD group were (33.28±11.05) ng/mL and (14.74±4.84) ng/mL, which were significantly lower than (44.71±6.32) ng/mL and (23.17±6.16) ng/mL in normal group (P<0.05). CARS score in ASD group was (33.11±2.01), GDS-C score was (58.49±10.70). Serum 25(OH)D and folic acid levels in ASD group were negatively correlated with CARS score (P<0.05), and positively correlated with GDS-C score (P<0.05). Conclusion: Serum levels of 25 (OH) D and folic acid in children with ASD are lower than those in normal children, which are related to the severity and developmental level of the disease.
[Key words] Autism spectrum disorder 25-hydroxy vitamin D Folic acid Children's autism rating scale Griffiths developmental scale-Chinese version
First-author's address: The Fifth Clinical Medical College of Anhui Medical University, Hefei 230000, China
doi:10.3969/j.issn.1674-4985.2023.09.025
孤独症谱系障碍(autism spectrum disorder,ASD)是一种常见的、起病早、且发展迅速的神经发育障碍性疾病[1]。其核心症状是社交沟通和互动受损,重复、限制性的兴趣和行为,以及感觉的异常[2]。2020年,美国疾控中心发布并报道了ASD的患病率由原来的1/59上升为1/54[3],同时据调查显示,我国ASD高发年龄集中2~6岁,患病率为7‰[4],也呈上升趋势。目前更多的研究者提出ASD是由遗传与环境等因素共同作用所引起,其具体原因和发生机制目前还未明确[5]。众所周知,早期营养对神经发育至关重要,然而儿童的大脑新陈代谢非常活跃,约占身体总能量消耗的60%[6-7]。参与儿童早期神经发育时期的营养素主要包括蛋白质、长链多不饱和脂肪酸、锌和铁等矿物质,以及多种维生素等[8-9],这些营养素在神经元功能的信号级联中发挥作用,目前有关营养素与ASD之间关系的研究越来越多,据有关研究报道显示:当血清中25(OH)D及叶酸水平降低到某种程度时,神经元核DNA的损伤修复将受到阻碍,从而可能引发ASD[10-11]。故本研究旨在通过比较ASD患儿和健康儿童血清25(OH)D、叶酸水平的差异,进而分析ASD患儿核心症状及发育情况与血清25(OH)D、叶酸水平的关系,以期为ASD的治疗提供新的方向。
1 资料与方法
1.1 一般资料 收集2021年6月-2022年6月在安徽省儿童医院就诊的ASD患儿114例。(1)纳入标准:①符合美国精神障碍诊断与统计手册第5版(diagnostic and statistical manual of mental disorder,fifth edition,DSM-5)孤独症诊断标准[12];②均正常参加户外活动,3个月内未添加维生素D及叶酸制剂;③年龄2~6岁;④均为首次确诊患儿。(2)排除标准:①近3个月内有服用抗癫痫药物及其他精神类药物;②患有维生素D、叶酸缺乏的其他疾病、神经系统疾病及脑外伤;③伴发染色体及遗传代谢性疾病;④因其他原因不能配合完成检查。选取同期在本院体检的100例健康儿童为正常组,年龄2~6岁。所有入组对象的父母或监护人均已签署知情同意书,本研究经安徽省儿童医院医学伦理委员会审批(伦理号:EYLL-2022-019)。
1.2 方法
1.2.1 孤独症核心症状评估方法 儿童孤独症评定量表(children's autism rating scale,CARS)评估孤独症严重程度,包括情绪反应、模仿、肢体动作等15项,每项评分l~4分,得分越高病情越严重,30~36分为轻中度、37~60分为重度[13]。
1.2.2 发育水平评估方法 格里菲斯神经发育评估量表-中文版(Griffiths developmental scale-Chinese version,GDS-C)对ASD患儿进行发育情况评估。该量表分为0~2岁和0~8岁两个部分,0~2岁部分由“A粗大运动、B个人-社会、C听力-语言、D手眼协调、E视觉表现”5个领域组成,0~8岁部分在此基础上增加了“F实际推理”GDS-C总商和每个分量表商的均值均为100分,标准差15分。总商或分量表商<70分,提示儿童整体发育水平或某一能区落后于同龄健康儿童2个标准差以上,预示存在显著发育落后[14]。
1.2.3 血清25(OH)D、叶酸水平检测 所有患儿均采取清晨空腹肘静脉血。血清25(OH)D水平测定采用高效液相色谱-串联质谱分析法;血清叶酸水平测定采用化学发光法。
1.3 统计学处理 数据处理选择SPSS 23.0软件,采用Kolmogorov-Smirnow检验样本的正态性,计量资料符合正态分布以均数±标准差(x±s)表示,组间比较采用独立样本t检验;计数资料用[例(%)]表示,组间比较采用字2检验。计量资料的相关性分析,采用Pearson相关性分析。P<0.05表示差异有统计学意义。
2 结果
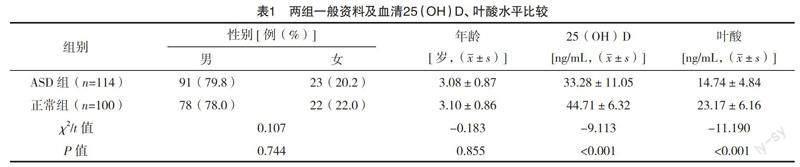
2.1 ASD组与正常组一般资料及血清25(OH)D、叶酸水平比较 ASD组与正常组性别及年龄比较,差异均无统计学意义(P>0.05),具有可比性;ASD組血清25(OH)D、叶酸水平均低于正常组(P<0.05)。见表1。
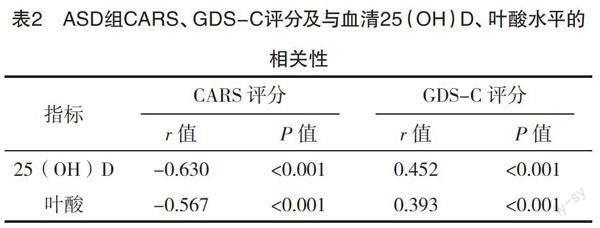
2.2 ASD组CARS评分、GDS-C评分及与血清
25(OH)D、叶酸水平之间的相关性 ASD组CARS评分为(33.11±2.01)分,GDS-C评分为(58.49±10.70)分。血清25(OH)D、叶酸水平与CARS评分均呈负相关(r=-0.630、-0.567,P<0.05),与GDS-C评分均呈正相关(r=0.452、0.393,P<0.05),见表2。
3 讨论
维生素D是一种类固醇激素,在体内发挥作用主要是通过促进小肠对钙的吸收进而调节多种生理功能。研究证明,维生素D3能诱导许多动物的肠黏膜产生一种专一的钙结合蛋白,增加动物肠黏膜对钙离子的通透性,促进钙在肠内的吸收。维生素D的主要功能是调节体内钙、磷代谢,维持血钙和血磷的水平,从而维持牙齿和骨骼的正常生长就发育。同时,维生素D还介导神经细胞增殖、神经传递、氧化应激和免疫功能[15]。其通过抗有丝分裂特性及调节细胞周期蛋白和神经营养因子(神经生长因子、胶质细胞源性神经营养因子)的表达,从而促进神经元成熟和分化、调节脑内钙信号及营养和保护神经等作用[16]。在西蒙斯基金会孤独症研究计划的数据库中发现了223个与ASD发病有关的基因是维生素D的敏感基因[17],这表明ASD的发生可能与维生素D有关。
本研究結果发现,与正常组相比,ASD组血清25(OH)D水平降低,且与GDS-C量表评分呈正相关,与CARS量表评分呈负相关。这与董涵宇等[18]的研究结果相似,ASD患儿血清25(OH)D水平与正常儿童相比呈降低状态,其水平降低与神经元细胞损伤有关。体内25(OH)D对维持周围神经网的完整性至关重要,其水平降低将破坏网络完整性、干扰神经回路功能,并阻碍记忆和思维等认知过程[19]。另外,有研究者对瑞典的58例患有ASD的儿童进行了脐带血25(OH)D的浓度检测,结果明显低于未患病的双胞胎兄弟[20],这同样表明了ASD的发生与25(OH)D水平降低有关。Jia等[21]的研究显示ASD患儿核心症状的严重程度会随着患儿血清25(OH)D水平的变化而波动,这提示当血清25(OH)D水平下降的越多,孤独症患儿核心症状越明显。当血清中25(OH)D水平降低时,将导致机体产生氧化应激反应,影响神经传递和基因表达,维生素D还通过其对谷氨酸和钙信号的影响,对大脑产生毒性作用,造成神经系统的发育迟滞,严重影响认知水平的发育,加重患儿病情[22]。
叶酸是一种人体自身无法合成的水溶性B族维生素,以不同浓度天然存在于各种食物中,是支持多种生理过程的必需营养素。叶酸在体内进行一系列的转化从而参与DNA、RNA、蛋白质等甲基化反应,甲基化反应在大脑神经发育过程中具有调控神经干细胞增殖、神经元和神经角质细胞分化的作用[23]。同时,叶酸可直接调控一碳单位的代谢,参与同型半胱氨酸的再甲基化和转硫反应,进而调控人体氧化应激水平。有相关文献报道称ASD儿童较正常儿童血清同型半胱氨酸水平高,而血清叶酸浓度是同型半胱氨酸水平的重要决定因素,同时,二者水平呈现反比关系[24-26]。
本研究结果发现ASD组血清叶酸水平低于正常组,且与GDS-C量表评分呈正相关,与CARS量表评分呈负相关,这同样说明当血清叶酸水平下降的越多,孤独症患儿发育越差、核心症状越明显。孙艺等[27]的一项研究发现,ASD儿童的血清叶酸水平较正常儿童降低,与本研究结果一致。据统计,十分之九的孤独症患儿存在饮食问题,食物的选择导致叶酸的摄入不足,叶酸水平的降低加速了神经元细胞凋亡,阻碍了脑组织神经元DNA损伤修复和细胞核内的核苷合成,继而促进了ASD发生。James等[28]的一项研究显示,在脑脊液中5-甲基四氢叶酸水平较低的ASD的儿童中补充叶酸,可使叶酸水平正常化,并缓解了ASD的症状。蔡小凡等[29]利用Gesell发育量表评估了244例ASD患儿的发育水平,并和血清叶酸水平进行相关性分析,结果显示呈正相关关系。当叶酸水平降低时,海马神经元数量可能随之减少,造成分化异常,同时也将引起神经生长因子表达下调,进一步引起认知功能障碍,最终加重患儿核心症状及影响发育水平。
综上所述,ASD的发生及发展可能与血清
25(0H)D、叶酸的缺乏有关,可据此开展ASD在药物方向的康复方式。本研究属于横断面研究,未进行长期随访,未来可就此继续探讨。
参考文献
[1] GENOVESE A,BUTLER M G.Clinical assessment,genetics,and treatment approaches in autism spectrum disorder(ASD)[J].Int J Mol Sci,2020,21(13):4726.
[2] KODAK T,BERGMANN S.Autism spectrum disorder:characteristics,associated behaviors,and early intervention[J].Pediatr Clin North Am,2020,67(3):525-535.
[3] MAENNER M J,SHAW K A,BAIO J,et al.Prevalence of autism spectrum disorder among children aged 8 years—autism and developmental disabilities monitoring Network,11 sites,United States,2016[J].MMWR Surveill Summ,2020,69(4):1-12.
[4] ZHOU H, XU X, YAN W,et al.Prevalence of autism spectrum disorder in China:a nationwide multi-center population-based study among children aged 6 to 12 years[J].Neuroscience Bulletin,2020,36(9):961-971.
[5] GARCÍA-SERNA A M,MORALES E.Neurodevelopmental effects of prenatal vitamin D in humans:systematic review and meta-analysis[J].Mol Psychiatry,2020,25(10):2468-2481.
[6] LEE B K,EYLES D W,MAGNUSSON C,et al.Developmental vitamin D and autism spectrum disorders:findings from the Stockholm Youth Cohort[J].Mol Psychiatry,2019,26:1578-1588.
[7] KREBS N F,LOZOFF B,GEORGIEFF M K.Neurodevelopment:the impact of nutrition and inflammation during infancy in low-resource settings[J].Pediatrics,2017,139:S50-S58.
[8] STRAIN J J,BONHAM M P,DUFFY E M,et al.Nutrition and neurodevelopment:the search for candidate nutrients in the Seychelles child development nutrition study[J].Neurotoxicology,2020,81:300-306.
[9] SCHWARZENBERG S J,GEORGIEFF M K,Committee on Nutrition.Advocacy for improving nutrition in the first 1000 days to support childhood development and adult health[J/OL].Pediatrics,2018,141(2):e20173716.https://pubmed.ncbi.nlm.nih.gov/29358479/.
[10]吴梅荣,熊忠贵,金正江,等.25-羟维生素D维生素B12及叶酸对2~6岁孤独症谱系障碍儿童智力及核心症状的影响[J].中国妇幼保健,2021,36(11):2443-2446.
[11]李廷玉.营养素信号通路作为孤独症谱系障碍生物标志的进展和思考[J].中国儿童保健杂志,2022,30(4):349-351.
[12] American Psychiatric Association.Diagnostic and statistical manual of mental disorders,fifth edition[M].Washington DC:American Psychiatric Association,2013:50-51.
[13]陈艳琳,龚建华,龚江伟,等.3~6岁孤独症谱系障碍儿童医教结合康复的疗效初探[J].中国学校卫生,2018,39(3):343-345,349.
[14]杜瑜,毛正欢,王慧,等.中文版Griffiths发育评估量表在2~4岁孤独症谱系障碍儿童中的应用研究[J].中华物理医学与康复杂志,2021,43(9):816-820.
[15] ALI A,CUI X,EYLES D.Developmental vitamin D deficiency and autism:putative pathogenic mechanisms[J].J Steroid Biochem Mol Biol,2018:108-118.
[16] CUI X,GOOCH H,PETTY A,et al.Vitamin D and the brain:genomic and non-genomic actions[J].Mol Cell Endocrinol,2017:131-143.
[17] TRIFONOVA E A,KLIMENKO A I,MUSTAFIN Z S,et al.
The mTOR signaling pathway activity and vitamin d availability control the expression of most autism predisposition genes[J].Int J Mol Sci,2019,20(24):6332.
[18]董涵宇,王冰,李洪华,等.孤独症谱系障碍患儿维生素D水平与孤独症核心症状相关性研究[J].中华儿科杂志,2017,55(12):916-919.
[19] MATTA S M,HILL-YARDIN E L,CRACK P J.The influence of neuroinflammation in autism spectrum disorder[J].Brain Behav Immun,2019,79:75-90.
[20] FERNELL E,BEJEROT S,WESTERLUND J,et al.Autism spectrum disorder and low vitamin D at birth:a sibling control study[J].Mol Autism,2015,6:3.
[21] JIA F,SHAN L,WANG B,et al.Fluctuations in clinical symptoms with changes in serum 25(OH)vitamin D levels in autistic children:three cases report[J].Nutr Neurosci,2019,12:863-866.
[22] SASS L,VINDING R K,STOKHOLM J,et al.High-dose vitamin D supplementation in pregnancy and neurodevelopment in childhood:a prespecified secondary analysis of a randomized clinical trial[J/OL].JAMA Netw Open,2020,3(12):e2026018.https://pubmed.ncbi.nlm.nih.gov/33289844/.
[23] HARLAN DE CRESCENZO A,PANOUTSOPOULOS A A,
TAT L,et al.Deficient or excess folic acid supply during pregnancy alter cortical neurodevelopment in mouse offspring[J].Cereb Cortex,2021,1:635-649.
[24] GUO B Q,LI H B,DING S B.Blood homocysteine levels in children with autism spectrum disorder:an updated systematic review and meta-analysis[J].Psychiatry Res,2020,219:113283.
[25] KAYE A D,JEHA G M,PHAM A D,et al.Folic acid supplementation in patients with elevated homocysteine levels[J].Adv Ther,2020,37(10):4149-4164.
[26] PRZYBYCIEN-GAWEDA P M,LEE T S,LIM W S,et al.
One-carbon metabolism biomarkers and risks of incident neurocognitive disorder among cognitively normal older adults[J].Nutrients,2022,14(17):3535.
[27]孫艺,梁爽,孙彩虹,等.孤独症谱系障碍患儿血清叶酸及其代谢产物与维生素B12水平状况[J].中国学校卫生,2018,39(3):331-334.
[28] JAMES S J,MELNYK S,FUCHS G,et al.Efficacy of methylcobalamin and folinic acid treatment on glutathione redox status in children with autism[J].Am J Clin Nutr,2009,89(1):425-430.
[29]蔡小凡,郭敏,刘李燕,等.叶酸和维生素B12与孤独症谱系障碍儿童症状和发育水平相关性研究[J].中国实用儿科杂志,2021,36(7):514-517.
(收稿日期:2022-12-30) (本文编辑:田婧)

