利用CRISPR/Cas9 技术创建拟南芥AtDGK5基因的缺失表达突变体研究
郭 贺,贾羊羊,范玉国,李 君,潘延云
(河北农业大学 生命科学学院/河北省植物生理与分子病理学重点实验室,河北 保定 071000)
细胞的肌醇磷脂信号系统是调节动植物发育和应答刺激的经典信号途径。细胞受到刺激时,肌醇磷脂依赖的磷脂酶C(PI-PLC)被激活,分解膜组分二磷酸磷脂酰肌醇(PIP2),形成二脂酰甘油(DAG)和三磷酸肌醇(IP3)双信使分子。动物细胞中DAG 进一步激活蛋白激酶C(PKC),同时启动钙离子信号,完成胞外信号的跨膜转换[1];而植物细胞中则是DAG 进一步被甘油二酯激酶(DGK)磷酸化形成磷脂酸(PA)来发挥作用。PA 目前被认为是植物特有的新型第二信使分子,对植物DGK的生物学作用和调控机制的阐释也成为重要的研究领域[2]。
DGKs 是独特而保守的脂类激酶家族。动物细胞中,有10 个不同的DGKs基因,归为5 个不同的亚型[3]。目前在植物的多个物种中检测到DGKs基因,它们的结构均与动物中最简单的一种类型DGKε 型相似,都包含保守的DGK 催化激酶域。植物DGKs 根据序列同源性分为3 个簇[3]。拟南芥AtDGKs基因家族中有7 个成员,其中AtDGK1/2属于簇 I,结构上除了有激酶域外还有2 个C1 结构域,以及1 个预测的跨膜螺旋区,推测属于膜蛋白;AtDGK3/4/7属于簇II,AtDGK5/6属于簇III,簇II和簇III 都只有保守的激酶域[3-4]。研究显示,不同植物多种亚型的DGK 不仅参与植物生长发育过程,还参与植物对生物和非生物胁迫的应答响应,但这些结果多是基于对DGK表达水平的检测,如8 个苹果MdDGKs基因中6 个受到干旱和盐胁迫及ABA的诱导[5];3 个ZmDGKs基因表达受到干旱和冷胁迫的诱导[6]。利用突变体提供体内证据的研究仍然以拟南芥为主,如关于拟南芥AtDGK5,研究发现该基因与AtDGK2和AtDGK3共同通过平衡体内TAG 和PA 来调控耐寒性[7];AtDGK5还在鞭毛蛋白信号转导和植物及微生物互作中早期免疫应答中发挥作用[8]。但是拟南芥AtDGKs家族参与植物的生长发育以及在抵御干旱和盐胁迫中的作用,还需要深入的研究。
利用基因缺失表达的突变体为材料的反向遗传学研究策略是诠释基因功能的有效方法,目前拟南芥T-DNA 插入目的基因突变体库仍然是研究基因功能的主要材料来源。由于同源基因之间存在功能冗余,所以往往需要通过杂交的方法获得多重突变体方能根据表型进行功能研究,但当所需要研究的基因在同一条染色体上且距离较近时,则无法通过杂交获得多重突变体;另外,插入的片段是否对植物产生影响也需要给予考虑和检测。CRISPR/Cas9 技术是目前应用最广泛的基因编辑技术,该技术在植物中得到快速发展和广泛应用,弥补了上述限制,并且该技术产生的靶位点突变可以稳定遗传给下一代,也避免了因传代过多造成的插入片段丢失问题。因此CRISPR/Cas9 技术被越来越广泛地应用到各种突变体创制中[9]。
本实验室前期获得了多种T-DNA 插入不同AtDGK基因的突变体,并且借助杂交获得了不同组合的多重突变体。检测发现,AtDGK5基因的T-DNA插入突变体(SAIL_1212_E10)中,该基因仍有转录水平的表达,推测可能是由于该突变体的T-DNA插入到内含子区域所致。本研究拟通过CRISPR/Cas9 技术获得AtDGK5基因编辑的敲除突变体,以期为深入研究AtDGKs基因家族的生物学功能提供突变体材料奠定基础。
1 材料与方法
1.1 试验材料及试剂
野生型拟南芥(Arabidopsis thaliana,生态型为Columbia,Col)、农 杆 菌(GV3101)、大 肠杆菌(Trans1-T1)、CRISPR/Cas9 系统双元载体pHEE401 和中间载体pCBC-DT1T2 质粒均为本实验室保存;Taq酶、限制性内切酶和dNTP 为TaKaRa公司产品;引物合成和测序委托生工生物工程(上海)股份有限公司。
1.2 双靶点pHEE401-AtDGK5 重组质粒的构建
在AtDGK5(基因号:At2g20900)第1 和第3个外显子区域选择2 段带有PAM 区的序列作为靶位点,命名为sgRNA1 和sgRNA2;sgRNA2 靶位点处带有PstI 酶切位点,供编辑效果的检测(图1);利用四引物法构建双靶点基因敲除载体,参考文献[10]方法进行。引物序列见表1。以AtDGK5-2-F0、AtDGK5-2-BsF、AtDGK5-1-BsR 和AtDGK5-1-R0 为引物,pCBC-DT1T2 质粒为模板进行扩增,获得含有双靶位点的目的片段,同时也引入BsaI 酶切位点序列,PCR 条件为95 ℃ 2 min;95 ℃ 30 s;56 ℃ 30 s;72 ℃ 30 s(38 个循环);72 ℃ 10 min; 12 ℃ 10 min。将目的片段和pHEE401均用BsaⅠ 酶切后连接,转化至大肠杆菌,获得抗性菌落后用引物U626F 和AtDGK5-1-BsR(表1)进行菌落PCR 鉴定,将阳性转化子进行测序鉴定,将验证无误的重组质粒转化到GV3101 中,待转化拟南芥。
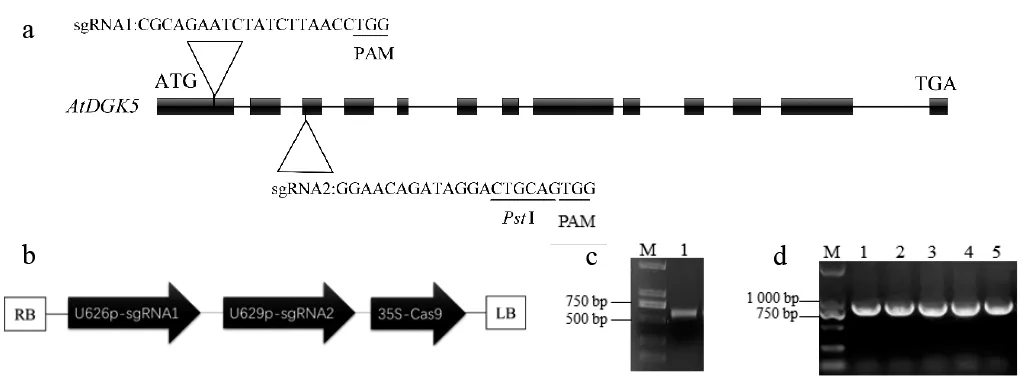
图1 AtDGK5 基因靶位点设计和pHEE401-AtDGK5 敲除载体的构建Fig.1 Target site design for the AtDGK5 gene construction of pHEE401-AtDGK5 gene knockout vector

表1 载体构建及鉴定引物Table 1 Primers used in this study
1.3 拟南芥的种植和遗传转化
拟南芥种子消毒及播种,参考文献[11]方法进行;拟南芥遗传转化,参照文献[12]方法进行,将含有重组质粒的GV3101 分别转化Col 和不同杂交组合的T-DNA 插入AtDGKs基因多重突变体中。
将获得的目的编辑植株atdgk5分别播种于分别含有120 mmol/L NaCl、10% PEG 和0.5 μmol/L ABA 的1/2MS 固体培养基上,统计种子萌发率和幼苗生长情况,分析编辑植株的表型和胁迫环境中的生长变化。
1.4 转基因编辑阳性苗的筛选和编辑基因的检测
利用潮霉素抗性筛选收获的T0代种子,10 d后选取潮霉素抗性幼苗,移栽后培养即T1代苗,继续培养21 d,剪取幼苗叶片,以基因组DNA 为模板。以AtDGK5(CRISPR)-F/R(表1)为引物扩增AtDGK5基因片段,对PCR 产物进行PstI 酶切后电泳检测,有未切开片段的阳性苗即为拟编辑植株,进一步将未被切开的片段回收连接T 载体转化Trans1-T1,选择克隆进行测序,验证基因被编辑情况。
1.5 外源DNA free 转基因株系的鉴定
获得AtDGK5基因被编辑的阳性苗后,进一步通过自交获得T2代植株,提取基因组DNA,以Cas9-F 和M13R 为引物(表1)进行扩增,未扩增出条带的阳性苗即为Cas9-free 编辑植株。
2 结果与分析
2.1 AtDGK5 靶位点设计和CRISPR/Cas9 基因编辑载体构建
从TAIR 数据库(https://www.arabidopsis.org/)下载拟南芥AtDGK5(At2g20900) 基因组DNA 序列和CDS 序列。根据CRISPR/Cas9 原理,设计了2 个19 bp 的序列作为靶位点,分别是第1 外显子上的sgRNA1: 5'-CGCAGAATCTATCTTAACCTGG-3'和第3外显子上的sgRNA2: 5'-GGAACAGATAGGACTGCAGTGG-3'(图1a)。按照方法1.2,构建的双靶点基因敲除重组质粒pHEE401-AtDGK5的结构如图1b 所示,四引物法扩增获得的目的片段与预期相符(图1c),随机挑取5 个单克隆进行菌落PCR鉴定,扩增片段与预期长度吻合(图1d);之后挑取单克隆进行测序,分别与2 个靶序列进行比对,确定AtDGK5的敲除载体构建成功。
2.2 AtDGK5 基因编辑敲除突变体atdgk5 的获得
2.2.1 T1代阳性苗的获得 将pHEE401-AtDGK5转化农杆菌GV3101,通过浸花法转化拟南芥(Col),获得T0代种子,经潮霉素抗性筛选后共获得22 株阳性苗。按照方法1.4 检测AtDGK5是否被编辑,结果获得16 株被编辑的阳性苗,如图2a 所示,WT泳道为正常的基因扩增片段经PstI 酶切后的条带,显示该片段被完全切开。由于扩增的AtDGK5片段为1 284 bp,而PstI 酶切位点该片段的中间位置,被切割片段分别为615 bp 和669 bp,2 个片段长度相似,因此电泳只显示出1 条带;而有15 株阳性苗除了有1 条与正常AtDGK5同样的酶切条带,还有1 条1 284 bp 的条带,说明这15 株苗的1 条同源染色体上sgRNA2靶位点因被编辑而破坏了酶切位点,是杂合突变体;而第11 株只有1 284 bp 的条带,说明该株系为sgRNA2 靶位点编辑的纯合突变体。
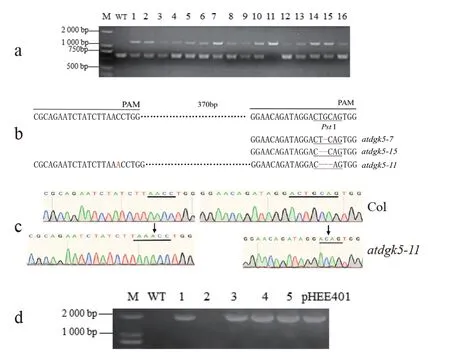
图2 AtDGK5 基因编辑敲除突变体atdgk5 的获得Fig.2 Acquisition of the AtDGK5 gene editing knockout mutant atdgk5
2.2.2 基因编辑效果分析 进一步选择第11 株和另外随机2 株(第7、15 株)阳性苗进行靶序列分析,测序结果显示,第7 株的sgRNA1 靶位点未被编辑,sgRNA2 靶位点处缺失了1 个碱基(G);第15 株的sgRNA1 靶位点未被编辑,sgRNA2 靶位点缺失2 个碱基(TG)。这2 株苗不仅因PstI 位点被编辑而失效,还造成了基因阅读框的移码,使得AtDGK5基因在第510 或531 个碱基处出现终止密码子,导致原本能够编码509 个氨基酸的AtDGK5仅能编码170 或176 个氨基酸;第11 株的sgRNA1靶位点插入了1 个碱基(A),在sgRNA2 靶位点处缺失了3 个碱基(图2b),最终造成编码阅读框发生变化,在第282 碱基处出现终止密码子,只能编码94 个氨基酸。因此,后续试验以第11 株为材料,命名为atdgk5。
2.2.3 Cas9-free 转基因株系的鉴定 单株收获atdgk5的T1代种子,播种T2代苗44 株,按照方法1.4 筛选,获得了8 株Cas9-free 的植株,图2d 显示未扩出Cas9 条带的第2 株;进一步从这8 株中选取6 株,扩增目的基因进行测序验证,得到2 株靶位点均为编辑纯合的植株,即AtDGK5基因编辑突变纯合体植株(图2c)。
2.3 atdgk5 的表型分析
在1/2 MS 培养基和分别含有120 mmol/L NaCl、10% PEG 的培养基中播种atdgk5和野生型拟南芥。结果发现,正常培养基中,atdgk5种子萌发和幼苗的生长与野生型拟南芥均相同,但在含120 mmol/L NaCl 的培养基中,播种2 d 后,atdgk5的种子萌发率较野生型高20.1%(P<0.05);在10 % PEG 下,播种1 d 后,种子萌发率较野生型低50.8%(P<0.05),但幼苗生长受抑制的程度与野生型相似(图3a 和b)。这些结果表明AtDGK5参与植物应答干旱和盐胁迫反应的生理过程。
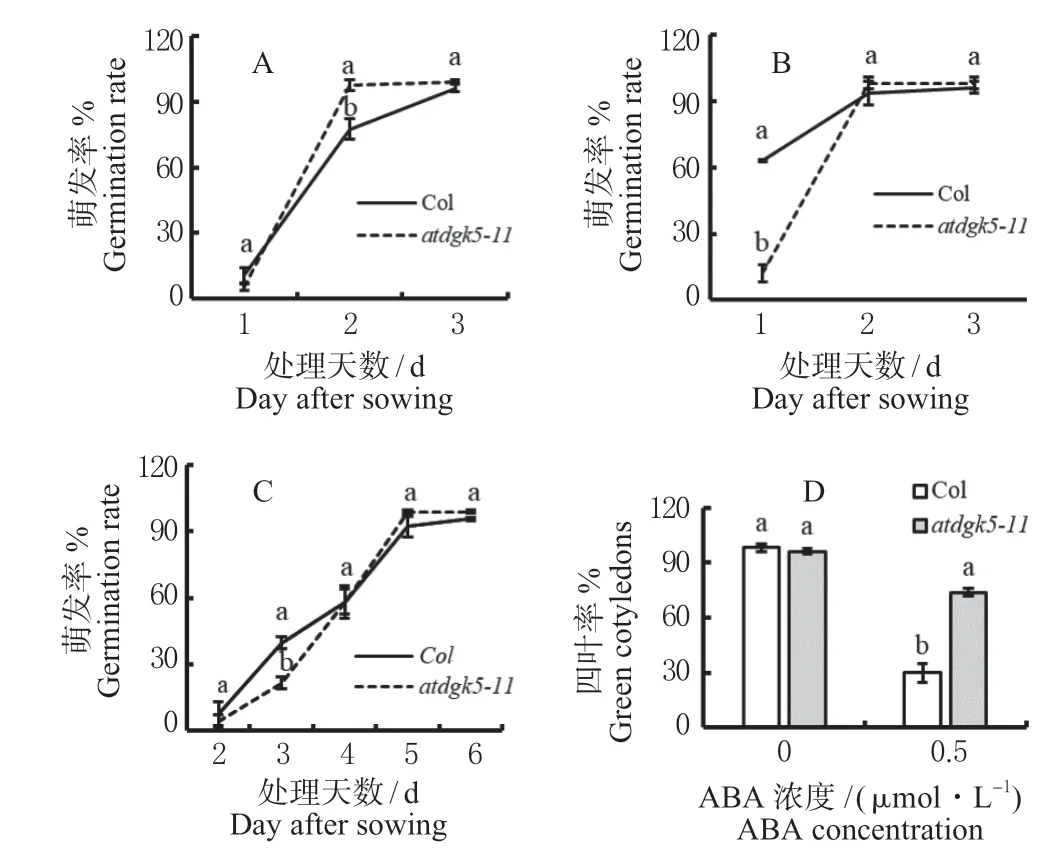
图3 atdgk5 单突在胁迫下的表型分析Fig.3 Phenotypic analysis of atdgk5 under stress
ABA 是参与渗透胁迫反应的主要激素,对种子萌发和早期幼苗发育都有抑制作用。检测atdgk5在0.5 μmol/L ABA 下的种子萌发率、幼苗生长和四叶率的结果显示(图3),种子萌发率无显著差异(P>0.05),但幼苗生长优先出现和四叶率较野生型高43.7%(P<0.05)且对ABA 不敏感(图3c和d),该结果暗示了AtDGK5参与拟南芥对胁迫的应答可能是依赖ABA 途径的。
2.4 atdgk3457 多重突变体的获得和生长表型观察
AtDGKs家族有7 个成员,同源基因之间的互补作用为反向遗传学研究基因功能的方法带来障碍,因此需要获得多基因突变体材料。前期实验室已经获得了T-DNA 分别插入AtDGK3/4/7基因的纯合突变体,本试验首先通过杂交获得了3 个基因的多重突变体atdgk347,检测显示该突变体的3 个基因均缺失表达。在该三突变体材料中,用同样的方法编辑了AtDGK5基因,按照前述实验步骤,目前获得了1 株atdgk3457四突变体,在AtDGK5的sgRNA2靶位点处缺少1 个碱基(G)(图4a),导致AtDGK5基因的移码,造成提前终止翻译。生长表型观察结果显示,正常生长条件下,atdgk5单突变体与野生型无差异,而atdgk347三突和atdgk3457四突无论是幼苗还是成熟期的莲座叶片,都显著小于野生型和单突变体,四突的莲座叶较三突更小(图4b 和c)。表示该家族的基因在拟南芥生长发育过程中发挥着作用。
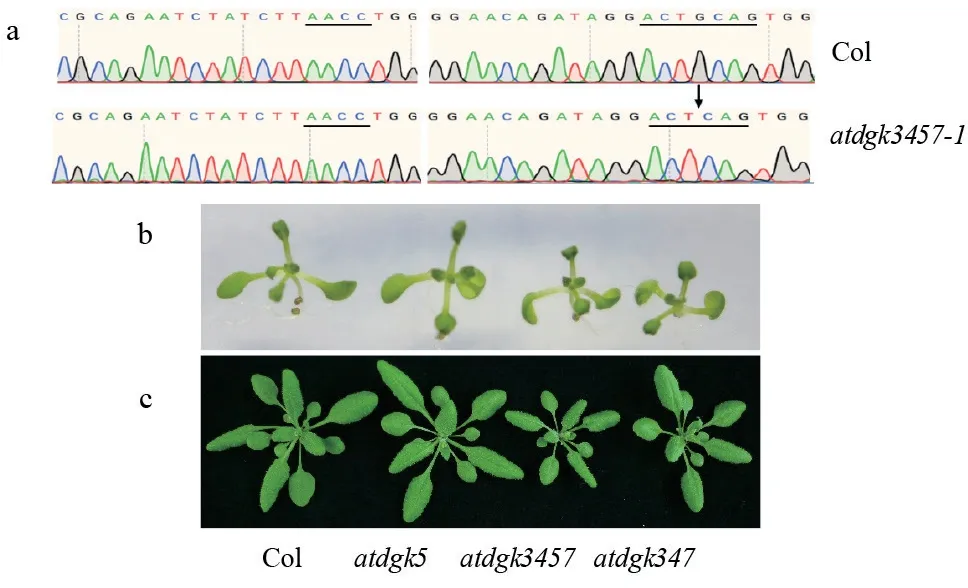
图4 atdgk3/4/5/7 的表型分析Fig.4 Phenotypic analysis of atdgk3/4/5/7
3 结论与讨论
3.1 利用CRISPR/Cas9 技术获得atdgk5 突变体
CRISPR/Cas9技术是一种强大的基因编辑工具,能够特异编辑各种生物体DNA 中的靶序列,在生物学基础研究和应用领域被越来越广泛地应用[13]。本试验研究拟南芥AtDGK5家族基因的功能,利用CRISPR/Cas9 技术获得该基因的缺失表达突变体,在AtDGK5的第1 和第3 个外显子分别设计1 个靶位点,同时构建到基因编辑载体pHEE401 中。预期被编辑的情况有以下几种:2 个靶位点单独被编辑,会造成阅读框移码,提前产生终止密码子;如果2个编辑靶位点都有活性即可能造成移码,也可能会发生DNA 双链断裂,删除370 bp。最终经过测序发现,本试验选择的2 个靶位点都有编辑活性,但并未造成断裂,检测结果显示选择的靶位点编辑效率很高,如带有酶切位点的sgRNA2 编辑效率达到72%,且T1代即获得了纯合突变体。本试验最终选择做后续功能研究的atdgk5突变体,AtDGK5基因在264 bp 处因增加1 个碱基而发生了移码,在283 bp 处出现了终止密码子,理论上表达蛋白的氨基酸数仅是完整蛋白的18.47%,达到了破坏该基因的效果。另外,由于AtDGK5与AtDGK3在同一条染色体上,利用杂交的方法很难获得多基因的突变体,因此采用相同的方法在atdgk347(分别为T-DNA插入突变体杂交而成)三突变体背景下导入针对AtDGK5的基因编辑载体,获得了atdgk3457四突变体,目前正将pHEE401-AtDGK5载体转入不同组合的基因突变体中,试图为研究该基因功能提供更多的材料。
3.2 AtDGK5 基因在盐和干旱胁迫下的生物功能
DGK 是一类保守的脂类激酶,可以将细胞膜上的脂类信号分子DAG 磷酸化为PA,PA 作为植物特有的新型第二信使近年来受到越来越多的关注,因此DGK 被认为是肌醇磷脂信号系统中的关键酶之一[14]。目前已在拟南芥、烟草、小麦、番茄、水稻、玉米等物种中检测出DGK 激酶活性[6,15-21]。拟南芥DGK基因家族中共有7 个成员。根据胁迫下的表达数据以及利用T-DNA 插入AtDGKS基因的拟南芥突变体的研究显示,AtDGK4可能作为NO的结合物,介导NO 信号对花粉管定向生长的调控[22];AtDGK2和4 在内质网中产生磷脂酸,用于花粉生长中信号转导和叶片中磷脂酰甘油的生物合成[23];AtDGK1/2/3/5/6均参与冷胁迫的应答[7,18,24];AtDGK7在整个拟南芥植株中均有表达,主要表达在幼苗和花器官中,且qRT-PCR 结果显示该基因受到干旱和盐胁迫的诱导[25];AtDGK5在鞭毛蛋白信号转导和植物及微生物互作中早期免疫应答中发挥作用[8]。其他如水稻、玉米、小麦等农作物中,也根据各自DGK在不同组织和胁迫条件下的表达数据,推论其参与了多种发育和应答环境刺激的调节作用[6,14,26]。
盐和干旱胁迫是影响农作物生长和产量的重要胁迫因子,研究植物对该胁迫应答的分子机制是生物学研究领域的重要课题[27]。肌醇磷脂信号系统参与渗透胁迫反应有诸多证据,但作用机理需要更多的试验数据。本试验获得Cas9-free 且AtDGK5基因表达缺陷的atdgk5纯合突变体后,首先检测了正常条件下的生长表型,发现与野生型拟南芥无明显差异。但给予高盐或干旱的胁迫条件后,该突变体的种子萌发过程与野生型相比都发生了变化;进一步检测胁迫激素ABA 对atdgk5的影响,发现ABA严重影响了atdgk5的幼苗生长过程。这些结果为AtDGK5基因参与拟南芥对盐和干旱的胁迫应答反应提供了证据。同源基因之间往往存在着功能互补,拟南芥AtDGK5家族有7 个成员,因此,明确各成员的功能,需要不同组合的多重突变体为材料。本研究获得atdgk3457四突后,初步检测了生长表型,发现多重突变体的生长较减缓,无论是幼苗还是成熟的莲座叶,都比野生型小,说明植物的正常发育过程是需要DGK基因的参与。
总之,本研究为初步解析AtDGK5基因及其同源基因的生物学功能提供了材料,也对探索植物响应盐和干旱胁迫的生物学过程具有重要意义。

