冷水鱼固着类纤毛虫PCR检测方法探讨及感染因素分析
王雨维 南汇珠 殷实 曹梦娟 刘莉雯 卢鑫 安瑞永 马磊

摘 要:针对冷水鱼养殖中固着类纤毛虫检测难和污染源不明确、种类鉴定难的问题,对冷水鱼养殖环境中固着类纤毛虫的主要寄生种类及感染因素进行调查分析,在不同季节于河北省内采集冷水鱼和水环境样本。首先,采用形态学方法对鱼体及水环境中的固着类纤毛虫进行初步鉴定;然后,建立PCR方法进行分子水平鉴定,并进行系统发育学分析;最后,对冷水鱼感染寄生虫的原因进行分析。形态学鉴定结果表明,冷水鱼寄生的固着类纤毛虫主要有累枝虫(Epistylis sp.)和钟虫(Vorticella sp.)2类;引物设计、敏感性和特异性试验结果显示,建立的寄生虫PCR检测方法有效,测序比对和系统发育分析结果进一步验证了其形态学结果;运用已建立的PCR方法检测出固着类纤毛虫在水环境中高达94.38%,鱼体广泛寄生,感染率达到了100%;且无季節差异,水体中的虫体可能是造成鱼长期感染的原因之一。研究数据可为冷水鱼病害的科学预测、预防和治疗提供依据,同时为冷水鱼养殖产业的可持续发展提供疫病防治参考。
关键词:动物寄生虫学;冷水鱼;纤毛虫;形态学;系统发育分析
中图分类号:Q959.17
文献标识码:A DOI:10.7535/hbkd.2023yx03008
收稿日期:2023-05-25;修回日期:2023-06-09;责任编辑:王淑霞
基金项目:中国博士后面上项目(2019M651061);河北省重点研发计划项目(22326703D);石家庄市厅市会商专项资金项目(225500395A)
第一作者简介:王雨维(1997—),女,河北唐山人,硕士研究生,主要从事水生动物学方面的研究。
通信作者:马 磊副教授。E-mail:lmahappy@hebtu.edu.cn
Discussion of PCR detection method and investigation of infection factors of sedentarius ciliates in cold-water fish
WANG Yuwei1,2, NAN Huizhu1,2, YIN Shi1, CAO Mengjuan1,2, LIU Liwen1,2, LU Xin1,2, AN Ruiyong1, MA Lei1,2
(1.Key Laboratory of molecular cell biology,Ministry of Education, College of Life Sciences, Hebei Normal University, Shijiazhuang, Hebei 050024, China; 2. Hebei Collaborative Innovation Center for Eco-Environment, College of Life Sciences, Hebei Normal University, Shijiazhuang, Hebei 050024, China)
Abstract:Aiming at the problem of difficult detection of sedentarius ciliates, unclear pollution sources and difficult identification of species in the cold-water fish farming, the major parasitic species of the parasites and the infective factors were investigated and analyzed. Samples of cold-water fish and water were collected in different seasons in Hebei Province. Firstly, the sedentarius ciliates on the fish body and in the water environment were initially identified by using morphology. Secondly, a PCR method was established for molecular level identification and phylogenetic analysis. Finally, the reasons for cold-water fish infecting the parasite were analyzed. Morphological identification reveals that the mainly parasitic species of sedentarius ciliates were Epistylis sp. and Vorticella sp.; A PCR method to test the parasites is successfully established. The results of sequences alignment and phylogenetic analysis verify the correctness of morphological test. The established PCR method is used to detect the prevalence of sessile ciliates in the water environment, which is as high as 94.38%, and the infection rate of the fish is up to 100% with no seasonal difference. The parasites in water may be one of the reasons for the long-term infection of the fish. The findings provide a scientific basis for predicting, preventing and treating cold-water fish diseases, as well as serving as a reference for disease prevention and control in the sustainable development of the cold-water fish farming industry.
Keywords:animal parasitology; cold-water fish; sedentarius ciliate; morphology; phylogenetic analysis
冷水鱼营养价值高,市场需求量逐年增加,野生捕捞量已经远远不能满足人们的需求,因此,冷水鱼养殖业正在不断扩大[1]。河北省西邻太行山、北邻燕山,冷泉水丰富,冷水鱼养殖量位列全国第5,是该省的支柱型产业之一[2-3]。随着集约化养殖及养殖密度的增加,冷水鱼的病虫害问题不断显现,固着类纤毛虫病害就是其中的一类[4]。
固着类纤毛虫隶属于纤毛门(Ciliophora)、寡膜纲(Oligohymenophorea)、固着目(Sessilida)。这类纤毛虫种类繁多且形态极其相似,包括钟虫、聚缩虫、单缩虫和累枝虫等,常见于近海岸环境之中,经常固着生活在惰性基质或活的生物体上,也有部分生活在淡水环境之下,自由或营寄生生活
[5],淡水中常见种类为累枝虫和钟虫。该类原生动物自由生活时,主要摄食水中的微小生物,寄生时主要定植于宿主组织,对组织产生压迫,寄生于鳃妨碍鱼类呼吸,同时引起细菌、病毒的继发感染[6]。在众多寄生虫种类中,累枝虫的危害最为巨大,大规模感染累枝虫会使鱼体表出现溃疡或棉花样的白斑,严重时造成鳞片脱落、脊柱出现红色病变[7];其次是钟虫,其广泛寄生在各种淡水鱼的鳃部和皮肤上,大量寄生在鱼体体表时能够引起宿主鳞片被侵蚀,同时使体表产生坑状的出血病变,降低其市场价值;大量寄生于鳃部时使鳃不能呼吸、影响排泄和渗透调节功能,最终导致鱼体死亡,尤其对幼鱼的危害极大,死亡率高[8]。在有机质含量较高、热污染程度严重的水体中极易暴发此类寄生虫病[9]。
本研究通过调查分析河北省冷水鱼中固着类纤毛虫的感染情况和感染因素,旨在科学预防及生态化防治该类寄生虫的感染,为保障冷水鱼养殖产业健康发展提供参考。
1 材料与方法
1.1 样本采集
2020-02—2022-07在河北省冷水鱼养殖场采集60尾冷水鱼(鲟鱼、虹鳟鱼、青海湖裸鲤),实验共采集组织样本143份(皮肤、体表黏液和鳃)和水样320份,组织样本采集后,取部分立即压片进行形态学观察,将部分样本迅速冷藏保存,用于后续基因组提取,对于不能及时进行基因组提取的样本应尽快放置在-80 ℃冰箱中保存。
1.2 实验仪器及材料
光学显微镜,购自Nikon公司;离心机,购自Thermo公司;凝胶成像系统和PCR仪,购自BioRad公司;恒温培养箱,购自宁波乐电仪器制造有限公司;动物组织/细胞基因组DNA提取试剂盒、琼脂糖凝胶DNA回收试剂盒和质粒小量提取试剂盒,均购自北京索莱宝生物科技公司;0.8 μm孔径滤膜,购自上海兴亚净化材料公司;PCR mix等试剂,均购自北京全式金生物技术有限公司。
1.3 实验方法
1.3.1 形态学鉴定
针对每尾鱼进行以下组织样本的采集,并进行形态学观察。
1)皮肤
肉眼观察鱼体皮肤是否有擦伤或腐烂,肌肉是否浮肿,鳃盖是否充血穿孔,鱼鳍是否分叉或蛀烂等现象。如有病变情况,则将病变组织及时压片,观察并采集保存。
2)体表黏液
用解剖镊刮取少量的体表黏液,压片后置于显微镜下观察。
3)鳃
用剪子剪取鱼体左右两侧完整的鳃放在培养皿中,仔细检查鳃片上是否有肉眼可见病变,剪取适量的鳃组织置于加有无菌生理盐水的载玻片上,盖上盖玻片,在显微镜下进行观察;将鳃瓣剪下,用解剖针把鳃丝逐条拉开检查,或用镊子将鳃的内含物刮下,用无菌生理盐水稀释,然后用塑料滴管吸取少量稀释液制成临时装片在显微镜下进行观察。
1.3.2 PCR检测方法的建立
根据NCBI数据库(www.ncbi.nlm.nih.gov)中公布的寄生固着类纤毛虫(ID: txid1974272)18S序列,利用软件Primer Premier 5设计引物,F: 5′-GGAAACTCATCAGGRCAAGAAGATT-3′; R: 5′-GGGCGRTGTGTACATTTTG-3′,并送至生工生物工程(上海)股份有限公司進行合成。合成固着类纤毛虫褶累枝虫Epistylis plicatilis的18S序列进行克隆后,以质料作为阳性模板待后续实验的使用[10]。探索实验条件:根据酶、引物退火温度及DNA浓度等,摸索最佳的PCR扩增条件,预期扩增片段长度约为440 bp。
1)特异性试验
为证明实验过程中引物的特异性,以淡水鱼类养殖中常见的原虫:周丛小车轮虫Trichodinella epizootica、剌钩斜管虫Chilodonella uncinata及尖前口虫Frontonia acuminata的DNA为模板进行PCR扩增;此外,分别以累枝虫和钟虫的DNA为模板进行二者的检测,扩增后用1.5%的凝胶电泳进行检测并观察。
2)敏感性试验
利用紫外分光光度计对褶累枝虫Epistylis plicatilis的18S基因阳性质粒进行浓度测定,按照公式:拷贝数(拷贝/μL)=[阿伏伽德罗常数×质粒质量浓度(ng/μL)×10-9]/[片段长度(bp)×660],阿伏伽德罗常数为6.02×1023,计算出DNA的拷贝数,用ddH2O对标准品以10倍梯度进行稀释,以稀释的质粒为模板进行PCR扩增,并进行结果观察。
1.3.3 组织和水中固着类纤毛虫的检测
本研究将获得的鱼体表黏液、鱼鳃和外表皮组织在液氮中充分研磨;向装有水样滤膜的EP管中加入1 mL的丙酮溶液充分溶解滤膜,再根据动物组织/细胞基因组DNA提取试剂盒的操作说明提取DNA后,即用或冷冻保存备用。采用1.3.2中建立的PCR方法进行上述样品检测,将阳性样本送至生工生物工程(上海)股份有限公司进行测序,并对测序结果进行比对分析。
1.3.4 固着类纤毛虫的系统发育分析
选取GenBank中固着目生物的18S序列,使用MAFFT(version 7)进行序列校对;使用BioEdit (version 7.2.5)人工裁剪对齐的序列。使用ModelFinder寻找最适模型用于后面分析,选择低BIC值模型;使用IQ-TREE (version 1.6.8)构建ML树,模型为K2P+R3,Bootstrap次数为100。使用MrBayes构建BI树,模型为K2P+I+G4,起始4条链,并行2个,运行1 000 000代,每500代取样1次,舍弃初始25%次取样。以ML树拓扑结构为基础,分别标注每个节点的标准自展值及后验概率。
1.3.5 数据统计与分析
经过测序和系统发育分析确定物种的样本并进行统计、利用SPSS软件,采用单因素方差分析对不同季节鱼体内固着类纤毛虫的感染率与水体中该类寄生虫的分布进行统计分析,所得数据均用平均数±标准差的方式表示。
2 结果分析
2.1 固着类纤毛虫的形态学观察
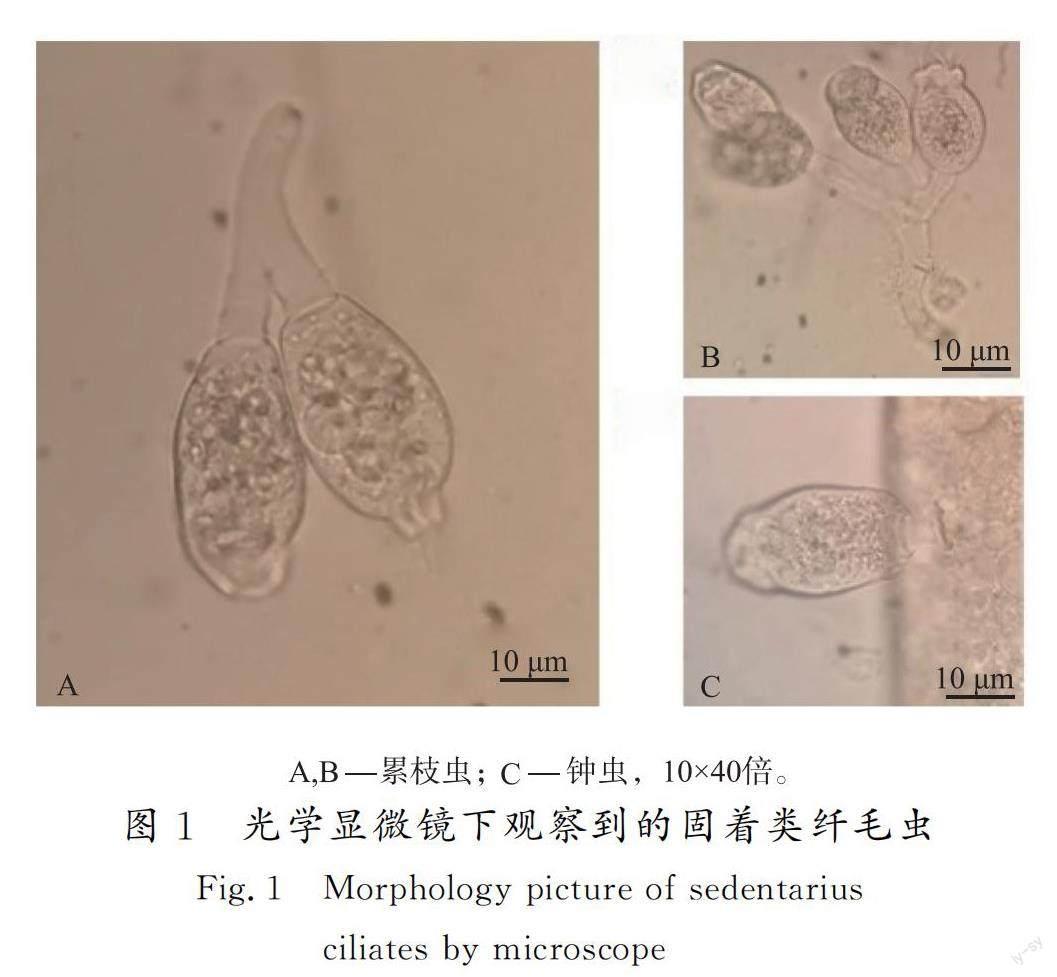
固着类纤毛虫种类丰富,构造大致相同,近似倒钟罩型,具有运动功能的反口纤毛环在显微镜下清晰可见。累枝虫与钟虫最大的区别在于柄是否能收缩,且在显微镜下观察发现,钟虫呈独立生存状态,不成群,累枝虫成群生活。显微镜下进行动态观察可见,各种固着类缘毛亚纲纤毛虫口围唇收缩,口围唇和口围盘可作为固着类缘毛亚纲纤毛虫分类的主要依据(见图1)。调查虽然显示出固着类纤毛虫存在于冷水鱼养殖环境中,然而该类寄生虫广泛生活在有机质含量高、热污染程度高的水环境中[11],间接说明了调查的冷水鱼养殖环境中有机质含量偏高。一般来说,养殖场中有机质的降解需要大量氧气的参与,当水中的溶解氧含量较低时,会造成缺氧环境,还原性物质会大量积累,恶化水质,影响鱼体的生长甚至造成鱼体死亡;当水体中有机质含量过高时,会引起病原微生物的大量繁殖,机体损伤、机能下降的养殖鱼类,极易被病原微生物感染,造成流行病暴发[12-13]。有报道显示,有机物质含量过高产生的原因有:1)养殖过程中过多投放饵料且在鱼进食后未能及时清理;2)养殖鱼类的排泄物未及时清理,导致大量积累;3)养殖池中的死鱼未及时捞出,池塘中动植物尸体通过微生物的分解会产生大量的有机物;4)淤泥与污水过多[14-15]。因此,加强养殖管理,如合理投放饲料、清除淤泥、增加水中溶氧量、及时清理池中的死鱼、杂草等,不仅能降低疾病暴发的风险,更有利于保证鱼类养殖业长久稳定发展。
2.2 PCR检测方法的建立
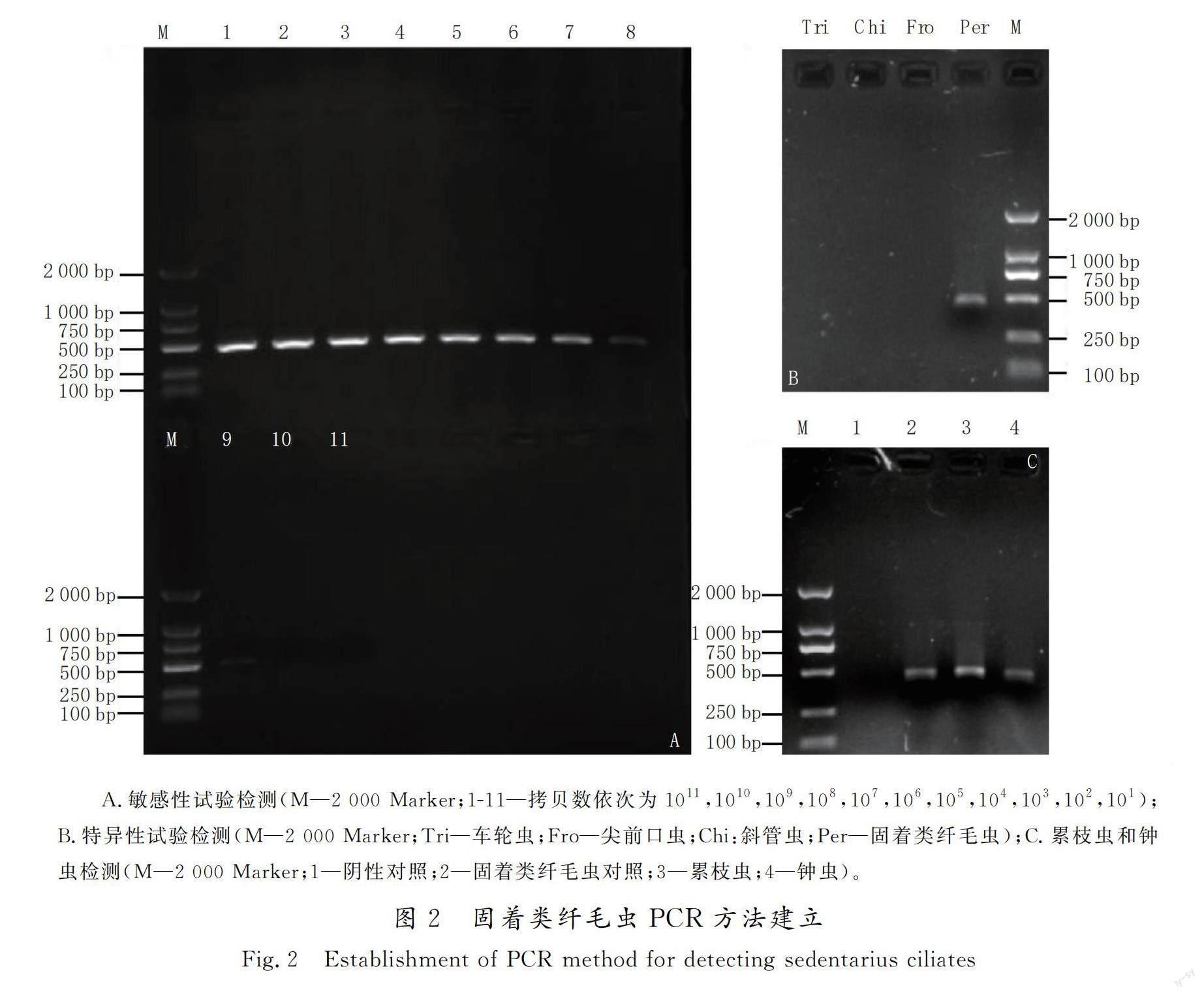
根据扩增体系,PCR检测最佳扩增条件确定为:预变性94 ℃,3 min;变性94 ℃,30 s,退火63 ℃,30 s,延伸72 ℃,30 s,共30个循环;终延伸72 ℃, 5 min;12 ℃保存。扩增结果显示,条带长度与预期条带大小441 bp相符,测序比对正确。敏感性试验结果显示,PCR反应的最低检测量为103拷贝/μL,表明所建立的PCR方法敏感性良好(见图2 A)。特异性试验结果显示,该方法对以车轮虫、斜管虫和尖前口虫为代表常见淡水原生动物扩增结果为阴性,只有固着类纤毛虫扩增出了约440 bp的目的条带(见图2 B),并且分别在累枝虫和钟虫的模板中扩增出了与预期大小相符的约440 bp特异性条带(见图2 C),试验结果表明该检测方法的特异性较好。PCR方法的建立为后续对冷水鱼中该类寄生虫的调查提供了技术便利。
通过已经建立的PCR检测方法,对河北省冷水鱼寄生固着类纤毛虫在鱼体及水体中的分布进行调查结果显示,固着类纤毛虫在养殖鱼中感染较为普遍,主要寄生于鱼体的鳃部及体表,水体中分布广泛(见图3)。测序比对结果初步显示,鱼体寄生和水中分布的固着类纤毛虫主要是累枝虫和钟虫2类,初步显示出本研究建立的PCR检测方法可应用于固着类纤毛虫的检测。
2.3 基于18S基因的系统发育分析
根据Lynn (2008)分类系统,累枝虫属(Epistylis)与钟虫属(Vorticella)均隶属于寡膜纲(Oligohymenophorea)、固着目(Sessilida)详见表1。
以累枝虫为例,累枝虫属(Epistylis)因其独特的生物特性而被作为水质指示生物。在以往分类中,常以银浸染色法所显示出来的银线系统区分其种类,但这对于构建系统发育关系,尤其是构建基于真实演化进程的分类系统来说,是不方便进行量化及聚类的。本文采用核糖体18S基因部分序列,综合GenBank序列数据和研究中所测序列数据,构建了Sessilida目的系统发育关系。基于Sessilida目33个种和Hymenostomatida目4个种(作为外群)的核18S-rDNA序列395个位点,依据最大似然法(ML)及贝叶斯法(BI)构建系统发育关系。结果显示,所采样品中存在固着类纤毛虫中有累枝虫(Epistylis sp.)和钟虫(Vorticella sp.)2类固着类纤毛虫(见图4和图5)。枝上方的值为ML标准自展值,枝下方的值为BI后验概率。字母F代表鱼体样本,字母W代表水样。
综合形态学、PCR及系统发育分析结果证实了冷水鱼养殖水环境中存在固着类纤毛虫,本次调查的冷水鱼中寄生有累枝虫和钟虫,但宿主鱼并未表现出异常状态(呼吸困难、游动迟缓、冒头、擦边等),也未发生大量染病与死亡,可能与之前报道的关于水生动物疾病的产生原因有关,即寄生虫的感染率高但是感染強度并不大,且池塘中无致病性细菌和病毒的存在不易引起鱼类疾病的暴发[16]。由于固着类纤毛虫并不会产生溶解酶,且不具备穿刺或穿透组织的能力。因此,长期以来人们都认为固着类纤毛虫不会对宿主产生机械性损伤,即使诱导了宿主的慢性炎症反应,也可能是由鱼与外界环境不断接触摩擦所产生的[17-18],直到20世纪70年代,固着类纤毛虫造成美国鱼类大量死亡事件之后,
才确定该类寄生虫是鱼类疾病重要的体外寄生虫之一,且固着类纤毛虫继发的细菌性疾病是造成鱼体大量死亡的真正原因,危害鱼类养殖业的发展[9,19-21]。由图4和图5可知,在同一养殖环境中鱼和水中的累枝虫具有较近的亲缘关系,表明累枝虫在养殖环境和鱼体之间存在相互传播的可能性及水质对鱼类养殖环境的重要性。有研究显示,寄生虫的丰度越大。对鱼体的危害越高,对于食源性寄生虫来说,能够传播到人体中的寄生虫的丰度急剧增加[22]。采取相同体积的水样并使用
相同的方法进行核酸检测发现,养殖水中的核酸富集量高于水源和尾水,说明冷水鱼的生存环境有利于该类寄生虫的繁殖。固着类纤毛虫寄生于冷水鱼,可能会威胁冷水鱼的健康,需要引起养殖人员高度重视。
2.4 固着类纤毛虫的季节性分布分析
对冷水鱼养殖的水源、养殖水及尾水调查结果显示,水源、养殖水及尾水中均有固着类纤毛虫,推测养殖池中存在固着类纤毛虫极有可能是因其水源受到了污染,因此,应加强对引入水源及水质的监控。统计分析发现,在全年各个季节均能检测到固着类纤毛虫,其检出率为100%;水体中平均检出率为94.38%,其中春季为90%、夏季为100%、秋季为100%、冬季为94.44%(见图6)。单因素方差分析结果显示,固着类纤毛虫的分布在各季节之间没有显著差异(见表2和表3),这可能是因为水体中有机质含量过高对感染率与分布率的影响远远超越了季节变化对它们造成的影响。通过对养殖水的主要生化指标进行监测发现,养殖池塘中总氮含量为3.91 mg/L,远超于0.5 mg/L(对鱼体产生毒害作用的临界值),氨氮含量的增多会使水体富营养化,破坏水体的生态平衡。有人提出质疑,水体中氨含量的大量增加会抑制纤毛虫的生长与繁殖,使其种群快速减少甚至消失,但是喂养的饲料中含有丰富的淀粉,糖类C/N比相对更高,碳源代谢的酸性物质与氮源代谢的碱性物质就会中和,所以即使寄生虫的种群密度达到峰值,外界pH值没有明显变化,种群密度也会在较长时间内维持在较高的水平[23]。一般养殖池塘水体的溶氧量应保持在5~8 mg/L,最低也应保持在4 mg/L[24],但是本次调查发现水体溶氧量较低,检测值仅为0.91 mg/L,会影响水体中有机质的降解。综上所述可以推测,与季节变化相比,养殖环境中的有机物质对该类寄生虫在鱼体与水体中分布的影响较大。
3 结 语
通过形态学以及固着类纤毛虫PCR检测方法,对河北省养殖冷水鱼类寄生固着类钟虫科纤毛虫进行了初步调查。结果表明,固着类纤毛虫在冷水鱼中广泛寄生,感染率可达100%,无季节性差异,水体中大量固着类纤毛虫的存在可能会感染到鱼体。对该类寄生虫的危害性进行预测,研究此类寄生虫病的病原危害和流行特点,为寄生虫病的预防与诊治提供了依据,对于促进河北省乃至中国冷水鱼养殖产业的稳定发展具有重要参考价值。
但本研究仅确定了鱼体和水环境中固着类纤毛虫的存在,并未检测寄生虫的感染强度,而感染强度可能是影响鱼类健康的重要因素。未来还需进一步探讨固着类纤毛虫对冷水鱼养殖的危害,发现危害冷水鱼养殖的其他寄生虫。
参考文献/References:
[1] 李美英.河北省养殖冷水鱼寄生虫病的初步调查和防治研究[D].石家庄:河北师范大学,2009.
LI Meiying.Study of Preliminary Investigation and Prevention on Parasitic Diseases of Farmed Cold Water Fish in Hebei Province[D].Shijiazhuang:Hebei Normal University,2009.
[2] 陳力,王圆圆,武艳丽,等.河北省冷水鱼养殖尾水治理技术初探[J].河北渔业,2019(12):54-57.
[3] 陈晓军.鲟鱼养殖产业现状及疾病防治技术[J].江西水产科技,2020(1):29-31.
[4] 张士斌.水产养殖滥用药物的危害及保障水产品质量安全的措施[J].黑龙江水产,2010(5):30-32.
[5] WU Tong,LI Yuqing,ZHANG Tengteng,et al.Morphology and molecular phylogeny of three Epistylis species found in freshwater habitats in China,including the description of E.foissneri n.sp.(Ciliophora,Peritrichia)[J].European Journal of Protistology,2021,78.DOI: 10.1016/j.ejop.2021.125767.
[6] BARRIOS-HERNNDEZ M L,BETTINELLI C,MORA-CABRERA K,et al.Unravelling the removal mechanisms of bacterial and viral surrogates in aerobic granular sludge systems[J].Water Research,2021,195.DOI: 10.1016/j.watres.2021.116992.
[7] KSEPKA S P,BULLARD S A.Morphology,phylogenetics and pathology of “red sore disease” (coinfection by Epistylis cf. wuhanensis and Aeromonas hydrophila) on sportfishes from reservoirs in the South-Eastern United States[J].Journal of Fish Diseases,2021,44(5):541-551.
[8] ELORANTA P K.Epizooic ciliates (Vorticella sp.) compete for food with their host Daphnia longispina in a small polyhumic lake[J].Oecologia,1987:203-206.
[9] VALLADO G M R,PEREIRA N L,VIADANNA P H,et al.Haematology and histopathology of Nile tilapia parasitised by Epistylis sp.,an emerging pathogen in South America[J]. Bulletin-European Association of Fish Pathologists,2015,35(1):14-20.
[10]李军,吕长荣,窦琳,等.小鼠Nanog基因原核表达载体的构建及表达[J].中国农业科学,2007,40(2):373-378.
LI Jun,LYU Changrong,DOU Lin,et al.Construction of prokaryotic expression vector of mouse Nanog gene and its expression[J].Scientia Agricultura Sinica,2007,40(2):373-378.
[11]ZHOU Tong,WANG Zhe,YANG Hao,et al.Morphological and molecular identification of epibiontic sessilid Epistylis semiciculus n.sp.(Ciliophora,Peritrichia) from Procambarus clarkia(Crustacea,Decapoda) in China[J].International Journal for Parasitology:Parasites and Wildlife,2019,10:289-298.
[12]姜傳奇,缪炜.四种淡水缘毛类纤毛虫的形态学研究[J].水生生物学报,2017,41(3):652-660.
JIANG Chuanqi,MIAO Wei.Morphology of four freshwater peritrichous ciliates[J].Acta Hydrobiologica Sinica,2017,41(3):652-660.
[13]RAMREZ-BALLESTEROS M,CRDENAS-VZQUEZ R,LUGO-VZQUEZ A,et al.Effect of Cothurnia variabilis and Epistylis gammari (Ciliophora:Peritrichia) on metabolic rate of the crayfish Cambarellus (Cambarellus) montezumae[J].Diversity,2021,13(7).DOI: 10.3390/d13070333.
[14]ESCH G W,HAZEN T C,DIMOCK R V,et al.Thermal effluent and the epizootiology of the ciliate Epistylis and the bacterium Aeromonas in association with centrarchid fish[J].Transactions of the American Microscopical Society,1976,95(4):687-693.
[15]牛志伟.浅谈南美白对虾养殖过程中纤毛虫寄生与细菌性白斑病的关系[J].科学养鱼,2016(7):59.
[16]MILLER R W,CHAPMAN W R.Epistylis and Aeromonas hydrophila infections in fishes from North Carolina reservoirs[J].The Progressive Fish-Culturist,1976,38(3):165-168.
[17]DE PDUA S B D,MARTINS M L,VALLADO G M R,et al.Host-parasite relationship during Epistylis sp. (ciliophora:Epistylididae) infestation in farmed cichlid and pimelodid fish[J].Pesquisa Agropecuária Brasileira,2016,51(5):520-526.
[18]刘乾甫,赖子尼,杨婉玲,等.珠三角地区密养淡水鱼塘水质状况分析与评价[J].南方水产科学,2014,10(6):36-43.
LIU Qianfu,LAI Zini,YANG Wanling,et al.Assessment of water quality of intensive ponds in the Pearl River Delta region[J].South China Fisheries Science,2014,10(6):36-43.
[19]李永吉,李文辉,李军勇,等.有机微量元素在水生养殖动物中的研究与应用策略[J].科学养鱼,2020(3):67-69.
[20]冯喜.池塘健康养殖鱼病综合防治技术[J].河南水产,2012(3):25-26.
[21]郑卫东.夏季鱼病增多的原因及防治[J].农家科技,2010(6):38.
[22]张卫芳.水产养殖对环境的影响及其可持续发展[J].广东蚕业,2020,54(9):60-61.
ZHANG Weifang.Impact of aquaculture on the environment and its sustainable development[J].Guangdong Sericulture,2020,54(9):60-61.
[23]凌建海.我国水产养殖对环境的影响及其可持续发展[J].农家参谋,2020(4):163.
[24]吴静,汪彦音,石宏武.不同温度及培养液对鲤斜管虫种群密度的影响[J].江西农业学报,2009,21(1):100-101.
WU Jing,WANG Yanyin,SHI Hongwu.Effects of media and temperature on population density of Chilodonella cyprini[J].Acta Agriculturae Jiangxi,2009,21(1):100-101.
[25]蒋宏斌,孙国华.节能型水产养殖——水底雾化曝气增氧[J].中国水产,2007(2):79-80.
[26]FIORENZA E A,WENDT C A,DOBKOWSKI K A,et al.It′s a wormy world:Meta-analysis reveals several decades of change in the global abundance of the parasitic nematodes Anisakis spp. and Pseudoterranova spp. in marine fishes and invertebrates[J].Global Change Biology,2020,26(5):2854-2866.

