载丹皮酚纳米纤维膜的制备、表征及性能评价
许海棠,廖华珍,周菊英,韦贻春,蓝艳姣
载丹皮酚纳米纤维膜的制备、表征及性能评价
许海棠,廖华珍,周菊英*,韦贻春,蓝艳姣
广西民族大学化学化工学院,林产化学与工程国家民委重点实验室,广西林产化学与工程重点实验室/协同创新中心,广西 南宁 530006
以丹皮酚、聚己内酯(polycaprolactone)、明胶(gelatin)为原料,利用静电纺丝技术制备载药纤维膜,并进行结构表征及性能评价。采用静电纺丝仪制备了聚己内酯/丹皮酚纤维膜、聚己内酯+明胶/丹皮酚纤维膜以及三层纤维膜(上下层为聚己内酯膜,中间层为聚己内酯+明胶/丹皮酚膜)。通过扫描电子显微镜、傅里叶变换红外光谱仪、X射线衍射仪、差示量热扫描仪对单层纤维膜的形貌与结构进行表征。通过CCK-8实验和溶血率测定法对载药纤维膜的安全性进行初步评价;并测定了聚己内酯+明胶/丹皮酚纤维膜的抗菌活性和抗氧化性;通过体外释放实验考察丹皮酚的释放规律。丹皮酚成功负载于电纺纤维中,CCK-8实验测得聚己内酯+明胶/丹皮酚纤维膜(载药量≤15%)对L929细胞存活率并无明显影响,溶血率实验测得样品纤维膜的溶血率都低于1%。聚己内酯+明胶/丹皮酚纤维膜对大肠杆菌和金黄色葡萄球菌具有良好的抑菌效果,其中对金黄色葡萄球菌的抑菌圈直径为(19.93±0.10)mm。聚己内酯+明胶/丹皮酚载药纤维膜对羟自由基的清除力较强,当丹皮酚的质量浓度为1.1 mg/mL,载药纤维膜的清除率为78.72%。体外释放实验表明药物的释放先是经过一个快速释放阶段后进入缓慢释放过程。3层纤维膜的缓释效果最好,累积释放率为94.58%。制备的丹皮酚纤维膜具有较好的生物相容性和抑菌活性及抗氧化活性,具有缓释性,其在生物医药领域的应用值得进一步研究。
纳米纤维膜;丹皮酚;聚己内酯;明胶;抑菌性;释药性;溶血率
丹皮酚又名牡丹酚,是从牡丹、芍药的干燥根皮等中药材中提取得到的有效成分。近年来,由于其治疗特性,丹皮酚已成为一个研究热点。体外和体内研究表明,丹皮酚具有广泛的药理活性,如抗炎活性[1]、抗菌活性[2]、抗氧化活性[3]、抗糖尿病活性[4]、抗过敏活性[5]、抗肿瘤活性[6]、抗动脉粥样硬化活性[7]以及缓解疼痛[8]的能力等。丹皮酚展现了广阔的应用前景,但是由于其水溶性低、稳定性差、口服生物利用度低[9],使其疗效和应用都受到了限制,所以在改善其负载方式与提高生物利用度方面仍需探索。
传统的口服、静脉注射及喷雾吸入等给药方式因不能确定具体的给药部位且难以控制药量等缺陷,可能达不到预期效果,而借助药物纳米载体可以有效弥补这方面的缺陷[10]。近年来,具有成本低、直径小、比表面积大、易实现等优点的静电纺丝作为一种新型的可制备载药纳米纤维的技术,成为了研究热点。由于电纺纳米纤维的高孔隙率和优良的连通性等特点,使其成为了多种药物和生物活性物质的储库,可实现增加溶解度,提高生物利用度、甚至达到可控释放或靶向递送的目的,受到了科研工作者的关注[11]。Kiss等[12]研发了能速释的姜黄素电纺纤维,使水溶性极低的姜黄素在2 min内溶出量达到(99.6±1.2)%。Rostami等[13]制备的载白藜芦醇电纺纤维,为肠道靶向释放,被肠道吸收的白藜芦醇量(约为840 μmol/L),是其抑制肿瘤细胞增殖和诱导细胞凋亡的最低剂量(50 μmol/L)的16倍多。Yildiz等[14]以磺丁基醚-β-环糊精为基质制备的磺胺异唑电纺纳米纤维,药物的溶解度提升了10倍。由此可见,电纺纳米纤维可望作为难溶性药物的载体,有效提高药物溶解度和生物利用度。因此,基于丹皮酚的性质,本课题组拟采用静电纺丝技术制备可负载丹皮酚的纤维,以期提高其利用率,为相关新剂型的研究提供参考。
1 仪器与材料
MAGNA-IR550型傅里叶变换红外光谱仪,美国Nicolet Magna公司;TAQ2000型差示扫描量热仪,美国TA公司;D8-Advance型X射线衍射仪,布鲁克AXS公司;Supra55 Sapphire型场发射扫描电子显微镜(SEM),德国卡尔蔡司公司;JDF04型静电纺丝机,长沙纳仪仪器科技有限公司;EnSpire型酶标仪,上海叶拓科技有限公司;UV 5100型紫外分光光度仪,上海元析仪器有限公司。
丹皮酚,质量分数99%,批号C10402579,麦克林试剂有限公司;明胶,批号11825056,阿拉丁试剂有限公司;聚己内酯,平均相对分子质量80 000,批号RQ1854-100g,上海瑞永生物科技有限公司;,-二甲基甲酰胺(DMF)、六氟异丙醇、二氯甲烷、无水乙醇、冰醋酸等分析纯试剂均购于国药集团化学试剂有限公司。
小鼠成纤维L929细胞购自南京科佰生物科技有限公司。
2 方法与结果
2.1 电纺溶液的配制
2.1.1 聚己内酯/丹皮酚纺丝液的配制 精密量取DMF 1 mL,二氯甲烷4 mL,置于小圆底烧瓶中,混匀;精确称量0.75 g聚己内酯加入混合液中,常温下磁力搅拌24 h。在上述溶液中分别加入质量分数(基于聚己内酯的质量)为7.5%、10.0%、12.5%、15.0%、20.0%的丹皮酚,继续磁力搅拌3 h,得到均匀透明的不同载药量的电纺溶液。
2.1.2 聚己内酯+明胶/丹皮酚纺丝液的配制 精确称取0.525 g聚己内酯和0.225 g明胶(聚己内酯-明胶7∶3)溶于5 mL六氟异丙醇中,滴入20 µL冰醋酸,常温下磁力搅拌12 h。在上述混合液中分别加入质量分数(基于聚己内酯和明胶的总质量)为7.5%、10.0%、12.5%、15.0%、20.0%的丹皮酚,继续搅拌3 h,得到均匀透明的不同载药量的电纺丝溶液[15]。
2.2 载丹皮酚纤维膜的制备
用5 mL注射器吸取制得的电纺溶液,采用18G针头,安装在电纺仪上,打开电源,在电压为16 kV,推进速度为0.6 mL/h,接收距离为15 cm的条件下制备聚己内酯/丹皮酚载药纤维膜;在电压为14 kV,推进速度为0.6 mL/h,接收距离为15 cm的条件下制备聚己内酯+明胶/丹皮酚纤维膜[15]。
将所制得的纤维膜收集好放置在真空干燥箱中恒温干燥24 h,温度为45 ℃,挥干溶剂备用。
2.3 结构与形貌表征
2.3.1 SEM表征 将真空干燥好的纤维膜裁剪成1 cm×1 cm的方形,喷金处理后利用SEM来观察形貌,电压为2 kV。使用Nano Measurer软件处理图片,测量纤维直径,作纤维直径分布图。
纺丝的SEM照片见图1-A。从图1-A-a、b可以看出,聚己内酯、聚己内酯/丹皮酚纤维表面平滑,无明显的药物晶体析出,相互连接形成具有孔隙的孔状结构。从纤维直径分布图(图1-B-a、b)可看出,聚己内酯纤维直径分布在50~550 nm,平均直径为(220±79)nm;聚己内酯/丹皮酚纤维直径分布在50~400 nm,平均直径为(190±59)nm。
从图1-A-c、d可看到聚己内酯+明胶纤维之间出现细丝连接,光滑性较差,这是因为明胶的亲水性较强,与聚己内酯混溶后溶液粘度变大,在纺丝过程中,明胶分子带有导电性,在电场的作用下进行移动从而使得电纺丝液变得不均匀[15-16]。从纤维直径分布图(图1-B-c、d)可看出,聚己内酯+明胶纤维的平均直径为(1118±359)nm,比聚己内酯纤维直径大很多,而载药后的纤维平均直径为 (1196±339)nm,二者的平均直径相差不大。
2.3.2 傅里叶变换红外光谱(Fourier transform infrared spectrum,FTIR)扫描分析 以溴化钾为背景,采用傅里变换叶红外光谱仪对丹皮酚及各纤维膜进行扫描测定,扫描范围为500~4000 cm−1。所测样品为各原料及载药纤维膜,结果如图2所示。

a-聚己内酯 b-聚己内酯/丹皮酚 c-聚己内酯+明胶 d-聚己内酯+明胶/丹皮酚
图2中的丹皮酚FTIR图,可观察到丹皮酚的特征峰。其中,3225 cm−1处为O-H伸缩振动峰;3082~3000 cm−1为芳氢基的伸缩振动峰[17]。1629 cm−1处有1个强峰,这是由于C=O伸缩振动形成;1206 cm−1处有C-O-C伸缩振动峰[18]。
聚己内酯纤维膜的FTIR图中,2934 cm−1出现的是聚己内酯链段端基O-H的特征峰,在1724 cm−1出现的强峰是羰基的伸缩振动峰[19]。将聚己内酯/丹皮酚纤维膜的FTIR谱线与丹皮酚的FTIR谱线对比,可以看出,丹皮酚在3225、3082、2681、1931 cm−1等特征吸收峰均消失;将其与聚己内酯的FTIR谱线对比,没有看到新的特征峰生成,说明丹皮酚和聚己内酯之间没有发生化学作用,丹皮酚被包裹在聚己内酯中,导致部分特征峰被掩盖。

图2 各样品的FTIR图
从聚己内酯+明胶的FTIR图可以看到,在3437 cm−1处有1个强峰,为N-H和O-H伸缩振动叠加而成[20]。2934 cm−1出现的是聚己内酯链段端基O-H的特征峰,1640 cm−1附近是明胶的N-H变形振动吸收峰。在聚己内酯+明胶/丹皮酚的FTIR谱线中,丹皮酚的特征峰消失了,没有生成新的特征峰,保留的是聚己内酯和明胶的特征峰,说明在聚己内酯+明胶/丹皮酚电纺纤维膜中,丹皮酚被包埋在纤维内部,与载体材料之间存在的是物理作用。
2.3.3 X射线衍射(X-ray diffraction,XRD)扫描分析 使用X射线衍射仪对丹皮酚及各载药纤维膜进行测试,入射光源为Cu-K α射线,波长0.154 1 nm;光管电压40 kV,光管电流40 mA;扫描范围10°~90°(2),步长0.02°,结果如图3所示。丹皮酚在11.7°~23.6°有多个强峰,峰型尖锐,提示丹皮酚是晶型结构[17]。聚己内酯在21.6°有1个强衍射峰,说明聚己内酯为半晶体结构[21]。可以看到,聚己内酯/丹皮酚衍射图与聚己内酯的相似,无丹皮酚的衍射峰,说明丹皮酚被包埋在纤维内部。对比丹皮酚、聚己内酯+明胶纤维膜与聚己内酯+明胶/丹皮酚纤维膜的XRD谱线,发现丹皮酚的衍射峰在聚己内酯+明胶/丹皮酚纤维膜中消失,说明丹皮酚被包埋于纤维内。
2.3.4 差示扫描量热(differential scanning calorimetry,DSC)法分析 采用DSC法对丹皮酚及各纤维膜的热性能进行测定,温度条件为20~200 ℃。升降温的速率均为10 ℃/min,整个实验在氮气保护下进行。图4展示了丹皮酚以及各纤维膜的DSC曲线。从丹皮酚的DSC曲线可以看到,丹皮酚在60.78 ℃时,吸热峰达到峰值,峰形尖锐,说明丹皮酚受热易挥发。从聚己内酯和聚己内酯+明胶的曲线可看出,温度为40~60 ℃时,曲线出现了变化,此为发生了玻璃化转变。将测得的数据计算可得,聚己内酯纤维膜的吸热焓变值为70.4 J/g;加入明胶后,纤维膜的吸热焓变值降至68.1 J/g。由此可见聚己内酯与明胶混合电纺之后,结晶度变低。聚己内酯的结晶度越低,表明聚己内酯与明胶的相容性越好,可以改善材料的性质。比较聚己内酯+明胶和载丹皮酚纤维膜的DSC曲线,发现二者没有明显区别,说明丹皮酚被保护在载体内部,热稳定性得到了提高。

图3 样品的X-射线衍射图

图4 样品的DSC谱图
2.4 生物相容性测试
2.4.1 细胞毒性测定 取各纤维膜的浸出液来检测其对L929纤维细胞的毒性大小。参照文献方法[22],在装有1 mL MEM培养液的离心管中,放入经紫外线灭菌过的各纤维膜(5 mg),使其完全浸润到培养液中,于37 ℃培养箱中培养48 h。
将小鼠成纤维L929细胞接种至96孔细胞培养板(每孔1×104个),置于37 ℃细胞培养箱中培养24 h。细胞分为实验组(聚己内酯/明胶组、载5%丹皮酚纤维膜组、载10%丹皮酚纤维膜组、载15%丹皮酚纤维膜和载20%丹皮酚纤维膜组)和空白对照组。待细胞贴壁后,实验组分别加入各组纤维膜浸出液100 μL,以MEM培养液作为空白对照组,每组平行培养3孔,培育24 h之后,除去上清液,每个孔中加入200 μL CCK-8/MEM(10%)培养液,培育4 h后,用酶标仪于450 nm波长处检测吸光度()值[15]。根据公式计算相对细胞活性。
相对细胞活性=实验/对照
当前,为了评价载药纤维膜的安全性,测定其细胞毒性是一项必要指标。利用载药纤维膜浸出液培养L929纤维细胞的结果见表1。从表1可知,聚己内酯+明胶纤维膜、载5%丹皮酚纤维膜和载10%丹皮酚纤维膜的相对细胞活性分别为98.12%、100.6%、100.9%,说明聚己内酯+明胶基体和低载药量的丹皮酚样品中对L929纤维细胞几乎没有毒性。随着丹皮酚载药量的增大,相对细胞活性有所下降,15%载丹皮酚纤维膜的相对细胞活性为90.22%,而20%载丹皮酚纤维膜的相对细胞活性降幅明显,仅为12.61%,这与药物自身毒性有关。

表1 各纳米纤维膜浸出液培养后的L929细胞相对活性(, n = 3)
本实验中,L929纤维细胞在载丹皮酚量≤15%时的纤维膜浸出液中的相对细胞活性都超过90%,说明在一定载药量范围内,所制备的聚己内酯+明胶/丹皮酚纤维膜具有优良的细胞相容性。
2.4.2 溶血率的测定 取新鲜兔血5.0 mL,加入3.2%柠檬酸钠抗凝。参照文献方法[23]稍加改动:以转速为1000 r/min,将抗凝全血离心10 min;弃去上清液,取0.4 mL红细胞沉淀,加入无菌生理盐水1.0 mL,混合,再次离心10 min,弃去上清液,加入0.5 mL的无菌生理盐水稀释红细胞,得到红细胞混悬液,备用。
将准备好的各纤维膜小圆片待测样品置于离心管中,加入无菌生理盐水,使得待测样品质量浓度分别为100、200、500、800、1000 μg/mL。1 mL生理盐水中加入20 μL红细胞混悬液为阴性对照组;1 mL蒸馏水中加入20 μL红细胞混悬液为阳性对照组;取各样品溶液1 mL,分别加入20 μL红细胞混悬液为样品组。将各溶液轻轻振摇,混合均匀,置37 ℃旋转式混匀仪培育2 h后,于1000 r/min的转速离心5 min,吸取上清夜0.2 mL至96孔板中,采用酶标仪于545 nm处测定值,平行测定3次,根据公式计算溶血率。
溶血率=(t-nc)/(pc-nc)
t、nc、pc分别为样品组、阴性对照组和阳性对照组的值
血液相容性是评价医药材料生物相容性最重要的指标之一。任何一种生物材料或设备植入体内后,与血液成分间的相互作用会影响下游事件的走向[24]。因此,测定溶血率是评价材料安全性的一项重要指标。实验结果显示,基材和载药纤维膜的溶血率都不到1%,表明聚己内酯、明胶和丹皮酚(试验质量浓度范围内)没有溶血作用,安全性高。
2.5 生物活性的测定
2.5.1 抗菌活性 采取抑菌圈法。将活化好的大肠杆菌、金黄色葡萄球菌菌液稀释后(浓度为1×106CFU/mL),涂布在固体培养基上。各纤维膜打成8 mm薄膜圆片,经紫外灯照射消毒后,贴在涂有菌液的培养基上。取含有0.4 μg的环丙沙星滤纸片作为阳性对照组,聚己内酯+明胶纤维膜作为阴性对照组。将培养皿放在生化培养箱内37 ℃培养24 h后,测量抑菌圈直径,结果如表2和图5所示。
从结果可知,聚己内酯+明胶/丹皮酚纤维膜对大肠杆菌和金黄色葡萄球菌的抑菌圈直径分别为15.96 mm和19.93 mm,都超过了15 mm,说明聚己内酯+明胶/丹皮酚纤维膜对大肠杆菌和金黄色葡萄球菌都具有较强的抗菌能力。而对金黄色葡萄球菌的抑菌圈直径大于阳性对照的抑菌圈直径,说明聚己内酯+明胶/丹皮酚纳米纤维膜保留了优异的抑菌活性。
2.5.2 抗氧化活性 根据Fenton反应原理,参照文献方法[25]测定丹皮酚和载药纤维膜清除羟自由基的能力。取3组试管,样品管组加入100 μL水杨酸溶液(9 mmol/L)和100 μL硫酸亚铁溶液(9 mmol/L),再分别加入纤维膜溶出液,加水至1.4 mL,最后加入过氧化氢(8 mmol/L)100 μL,得到含丹皮酚终质量浓度为500~1100 μg/mL的系列样品管,37 ℃下反应15 min,用紫外分光光度计于510 nm波长处测定值,记为1。将样品溶液换成水,同样操作得到0;将样品管中的过氧化氢溶液换成水测得对照吸光值2。平行测定3次,羟自由基清除率用公式进行计算。

表2 聚己内酯+明胶/丹皮酚纤维膜对大肠杆菌和金黄色葡萄球菌的抗菌活性(, n = 3)

图5 聚己内酯+明胶/丹皮酚纤维膜对大肠杆菌和金黄色葡萄球菌的抑菌圈
清除率=(0-1+2)/0
在初试验中发现丹皮酚清除其他自由基的活性较弱,所以,本实验以测定载药纤维膜对羟自由基的清除率来评价其抗氧化性能,并与丹皮酚原料药比较,结果见表3。从表3中可以看到,随着丹皮酚质量浓度的增大,清除率呈上升趋势,清除率与丹皮酚质量浓度呈正相关。当丹皮酚的质量浓度为1.1 mg/mL时,原料药的清除率为79.31%,载药纤维膜的清除率为78.72%。经SPSS 17.0软件分析,在实验质量浓度范围内,二者的清除能力相当,无显著性差异。

表3 样品对∙OH的清除能力(, n = 3)
2.6 丹皮酚体外释放研究
2.6.1 标准曲线的测定 精确称取10.0 mg丹皮酚,加入磷酸盐缓冲液(PBS,pH 7.4),溶解、定容,得到0.1 mg/mL的储备液。稀释成一系列质量浓度的标准溶液:4、6、8、10、12 μg/mL。采用紫外分光光度计,在274 nm处测定上述溶液的值,绘制标准曲线。
以值对丹皮酚溶液的质量浓度进行回归,得到标准曲线方程为=0.070 4+0.007 8,2=0.999 3,其中为值,为丹皮酚质量浓度。
2.6.2 丹皮酚饱和溶解度的测定 取过量的丹皮酚原料药,置于盛有20 mL磷酸盐缓冲溶液(pH 7.4)锥形瓶中,恒温振荡72 h,静置后取上清液,经0.22 μm微孔滤膜滤过,用紫外分光光度计在274 nm处测定值,平行测定3次,测得丹皮酚的饱和溶解度为(825±13)μg/mL。
2.6.3 丹皮酚体外释放测定 精密称取载丹皮酚纤维膜,放进盛有50 mL磷酸盐缓冲溶液(pH 7.4)的锥形瓶中,置于恒温摇床中,设置温度为37 ℃,振荡频率为100 r/min。定时从溶出介质中移取5.0 mL溶液作为待测样品,同时补充同体积PBS溶液。测定待测样品在274 nm处的值,参照文献方法中的公式[26],计算累积释放率,并作释放曲线图。
2.6.4 丹皮酚释放行为 图6展示了丹皮酚原料药和3种载丹皮酚纤维膜的体外药物累积释放率。从丹皮酚释放曲线图可以看出,丹皮酚原料药在4 h基本释放完全,累积释放率达到93.46%。从2个载药纤维膜的释放曲线图可看到,各浓度的聚己内酯/丹皮酚纤维膜和聚己内酯+明胶/丹皮酚纤维膜在1 h内均存在突释效应。明胶的加入,使得不同载药量的纤维膜累积释放率的差距增大,载药量为15%的纤维膜的累积释放率从31.26%提高到53.10%,但是突释现象没有得到改善。究其原因,可归结为混纺中常见的问题。共混静电纺丝法是在进行纺丝前将药物与聚合物溶液混合,直接溶解再纺丝。在这种方法中,聚合物的理化性质、聚合物与药物的相互作用决定了药物在纳米纤维中的分布以及药物的释放等。在共混静电纺纳米纤维的研究中发现,药物突释通常是由于2个原因造成,一是其直接与人体内环境接触导致容易扩散;二是单轴纤维易于快速降解,从而造成难以控制给药的局面。此外,溶解度差的药物会导致其在聚合物溶液中分布不均匀,药物向纤维表面的迁移,最终导致药物初始突释现象的出现。为了解决突释问题,本研究制备了3层载丹皮酚纤维膜:聚己内酯膜为上下层,聚己内酯+明胶/丹皮酚膜作为中间层。每一层的纺丝时间都为2 h,纺丝参数同上,并研究了其释药行为,结果见图6。比较3个载药纤维膜的释放曲线图可知,3层载药膜的丹皮酚累积释放率比单层载药膜的高得多。从三层膜载药释放图可看出,释放效果最好的纤维膜的中间层聚己内酯和明胶的比例为7∶3,在4 h时其药物累积释放率为20.62%,在前期没有突释效应;24 h时累积释放率达到47.83%,接着缓慢释放,120 h时累积释放率可达94.58%,几乎完全释放,与原料药比,具有缓释性。
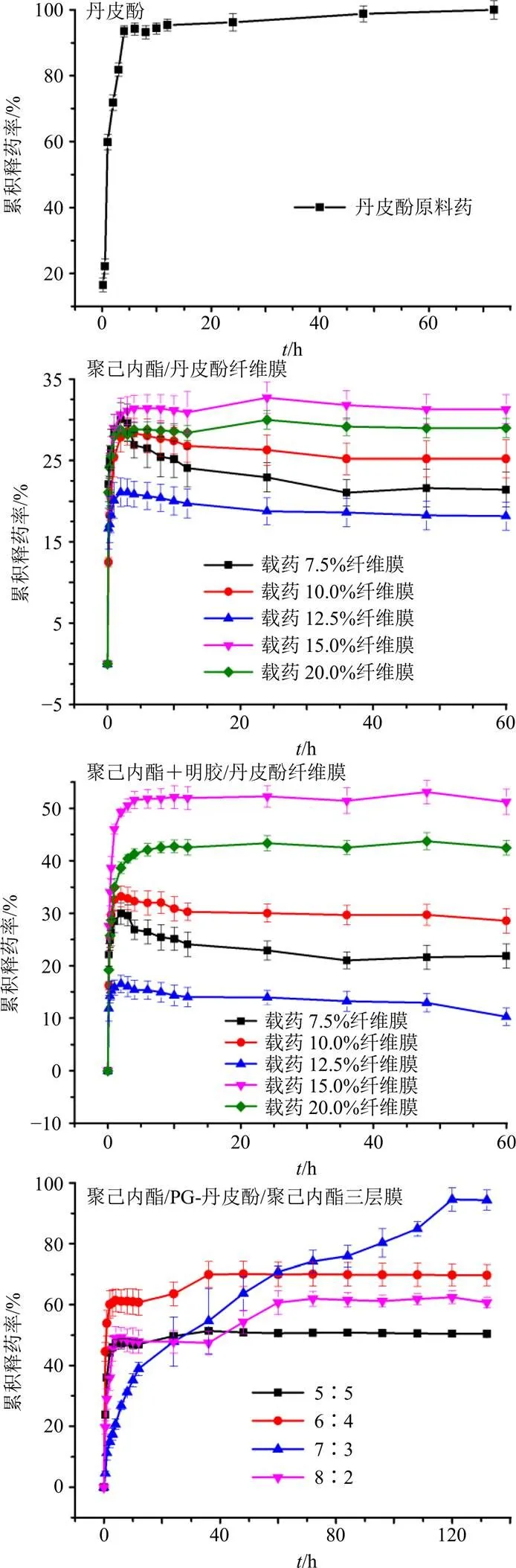
图6 载药纤维膜体外药物累积释放曲线(, n = 3)
3 讨论
本实验利用静电纺丝技术制备了不同载体的载丹皮酚纳米纤维膜,对其进行了表征、生物活性测试和体外药物释放行为研究。FTIR是表征丹皮酚是否与载体发生反应的有力测试手段,通过检测对比丹皮酚的特征峰,发现载药纤维膜的谱线中无丹皮酚的特征峰,与原材料红外图谱对比,也没有生成新的峰,说明丹皮酚与载体没有发生化学反应,只是被成功地包埋在纤维内部。分析TEM和XRD的表征结果与红外光谱图得到的结果一致。而DSC的检测结果说明,丹皮酚负载在纤维内部,被载体所保护,提高了热稳定性。
随着医药学与材料学的发展,生物材料在临床上的应用越来越广泛[27]。材料在应用于临床前,需对其进行生物相容性的评价。本实验中进行了细胞毒性实验和溶血率的测试,结果显示,聚己内酯+明胶载体纤维膜是安全的生物材料。而载丹皮酚纤维膜随着载药量的增大,出现了细胞毒性,因此,我们要把载药量控制在安全用药范围。在生物活性方面,聚己内酯+明胶/丹皮酚纤维膜表现出很强的抑制大肠杆菌、金黄色葡萄球菌的作用;对羟自由基具有较强的清除能力,可望在医学研究、生物医药及食品包装等领域开拓新的应用。
从体外释药试验结果来看,聚己内酯/丹皮酚和聚己内酯+明胶/丹皮酚纤维膜最佳的载药量都是15%,但是存在具有突释效应和累积释放率不高的缺点。考虑到聚己内酯的疏水性,可以控制药物释放前期的突释;而明胶的亲水性又可以在后续的过程中促进丹皮酚的释放。结合两者的特性,本实验设计制备了3层膜,通过摸索调控中间层2种材料之间的比例,在释药实验中获得了较为满意的效果。下一步可对3层载丹皮酚纤维膜做更多的研究,比如各项表征、药理活性及释药机制等,为开拓丹皮酚的临床应用提供依据。
利益冲突 所有作者均声明不存在利益冲突
[1] Zong S Y, Pu Y Q, Xu B L,. Study on the physicochemical properties and anti-inflammatory effects of paeonol in rats with TNBS-induced ulcerative colitis [J]., 2017, 42: 32-38.
[2] Himaya S W, Ryu B, Qian Z J,. Paeonol fromBleeler suppressed the neuro- inflammatory responsesvia NF-κB and MAPK signaling pathways [J]., 2012, 26(6): 878-887.
[3] 张鹏, 程凤琦, 金圣奇, 等. 丹皮酚的体内抗炎镇痛和体外抗氧化效果评价 [J]. 中国兽医杂志, 2022, 58(6): 96-100.
[4] Lau C H, Chan C M, Chan Y W,. Pharmacological investigations of the anti-diabetic effect ofand its active component paeonol [J]., 2007, 14(11): 778-784.
[5] Lee B M, Shin Y W, Bae E A,. Antiallergic effect of the root ofand its constituents paeoniflorin and paeonol [J]., 2008, 31(4): 445-450.
[6] Li M, Tan S Y, Wang X F. Paeonol exerts an anticancer effect on human colorectal cancer cells through inhibition of PGE2 synthesis and COX-2 expression [J]., 2014, 32(6): 2845-2853.
[7] Li H K, Dai M, Jia W. Paeonol attenuates high-fat-diet- induced atherosclerosis in rabbits by anti-inflammatory activity [J]., 2009, 75(1): 7-11.
[8] Zhang J Y, Lei L, Shang J,. Local application of paeonol prevents early restenosis: A study with a rabbit vein graft model [J]., 2017, 212: 278-287.
[9] Yao J J, Zhang Y X, Hu Q M,. Optimization of paeonol-loaded poly(butyl-2-cyanoacrylate) nanocapsules by central composite design with response surface methodology together with the antibacterial properties [J]., 2017, 101: 189-199.
[10] 周斐. 同轴载姜黄素抗氧化缓释纳米纤维膜的制备及其性能研究 [D]. 合肥: 安徽农业大学, 2022.
[11] 李铭岩, 杨柳榴, 王兵, 等. 静电纺丝技术在药物制剂中的应用研究进展 [J]. 中国医药工业杂志, 2022, 53(8): 1091-1100.
[12] Kiss K, Hegedüs K, Vass P,. Development of fast-dissolving dosage forms of curcuminoids by electrospinning for potential tumor therapy application [J]., 2022, 611: 121327.
[13] Rostami M, Ghorbani M, Aman Mohammadi M,. Development of resveratrol loaded chitosan-gellan nanofiber as a novel gastrointestinal delivery system [J]., 2019, 135: 698-705.
[14] Yildiz Z I, Celebioglu A, Uyar T. Polymer-free electrospun nanofibers from sulfobutyl ether 7-beta-cyclodextrin (SBE 7-β-CD) inclusion complex with sulfisoxazole: Fast-dissolving and enhanced water-solubility of sulfisoxazole [J]., 2017, 531(2): 550-558.
[15] 廖华珍. 静电纺载中药活性成分纳米纤维膜的制备及释放性能研究 [D]. 南宁: 广西民族大学, 2021.
[16] Li D W, Chen W M, Sun B B,. A comparison of nanoscale and multiscale PCL/gelatin scaffolds prepared by disc-electrospinning [J]., 2016, 146: 632-641.
[17] Ma H D, Guo D Y, Fan Y,. Paeonol-loaded ethosomes as transdermal delivery carriers: Design, preparation and evaluation [J]., 2018, 23(7): 1756.
[18] 赵吉平, 邹从早, 马海平. 丹皮酚固体分散体制备表征及体外溶出特性[J]. 中国医药科学, 2020, 10(9): 35-38.
[19] 胡运玖, 左奕, 邬均, 等. 聚己内酯载药微球的制备及释药性能研究 [J]. 材料导报, 2015, 29(2): 29-32.
[20] 付银鑫, 郭菲, 张明飞, 等. 聚己内酯/明胶电纺纳米纤维支架的制备与细胞相容性研究 [J]. 化工新型材料, 2014, 42(1): 110-112.
[21] Xue J J, He M, Liu H,. Drug loaded homogeneous electrospun PCL/gelatin hybrid nanofiber structures for anti-infective tissue regeneration membranes [J]., 2014, 35(34): 9395-9405.
[22] 陈星竹, 于明岳, 刘双, 等. 载氟聚碳酸丙烯酯牙贴片再矿化性能及其对小鼠成纤维L929细胞的毒性作用 [J]. 吉林大学学报: 医学版, 2022, 48(6): 1429-1436.
[23] 黄娜, 高慧敏, 陈两绵, 等. 金银花与山银花的体外溶血作用分析 [J]. 中国实验方剂学杂志, 2017, 23(12): 6-12.
[24] 沈勇. 仿生取向纤维的刚度变化对巨噬细胞极化与血液相容性的影响 [D]. 上海: 东华大学, 2021.
[25] 王晶晶, 仇建飞, 蔡玉红, 等. 富硒木耳水提物体外抗氧化作用研究 [J]. 东北农业科学, 2021, 46(6): 134-138.
[26] 杨佳佳, 韦世权, 李婉蓉, 等. 星点设计-效应面法优化丹皮酚脂微球处方工艺及其体外释药机制研究 [J]. 中草药, 2020, 51(15): 3901-3910.
[27] 秦政, 杨钦博, 苏白海. 血液接触生物材料的血液相容性评价研究进展 [J]. 高分子通报, 2021(2): 1-8.
Preparation, characterization and performance evaluation of nanofiber membranes loaded with paeonol
XU Hai-tang, LIAO Hua-zhen, ZHOU Ju-ying, WEI Yi-chun, LAN Yan-jiao
Key Laboratory of Chemistry and Engineering of Forest Products, State Ethnic Affairs Commission, Guangxi Key Laboratory of Chemistry and Engineering of Forest Products, Guangxi Collaborative Innovation Center for Chemistry and Engineering of Forest Products, Guangxi Minzu University, Nanning 530006, China
To prepare drug-loaded fiber membrane by using electrospin technology, with paeonol, polycaprolactone, gelatin as raw materials and performe their structural characterization and performance evaluation.Polycaprolactone/ paeonol fiber membrane, polycaprolactone + gelatin/paeonol fiber membrane and three layers of fiber film (which polycaprolactone membrane as the upper and lower layers and polycaprolactone + gelatin/paeonol membrane as the middle layer) were prepared. The morphology and structure of the single layer fiber membrane were characterized by scanning electron microscope, Fourier transform infrared spectrum, X-ray diffraction, and differential scanning calorimetry. The security of the loaded fiber membrane was assessed by CCK-8 and hemolysis test. The antibacterial activity and antioxidant properties of polycaprolactone + gelatin/paeonol were evaluated. Therelease rule of paeonol from drug loaded fiber membrane was investigated.Paeonol was successfully loaded in the electrospun fibers. CCK-8 test indicated that the polycaprolactone + gelatin/paeonol fiber membrane (drug loading capacity ≤ 15%) showed no influence to the cell viability, and hemolysis test showed hemolysis ratio of samples was under 1%. The excellent antibacterial effect of polycaprolactone + gelatin/paeonol fiber membrane againstand, which the diameter of the bacteriostatic ring for.was (19.93 ± 0.10) mm. Polycaprolactone + gelatin / paeonol had a strong clearance of hydroxyl radicals, when the concentration of paeonol was 1.1 mg/mL, the clearance rate of the membrane was 78.72%.release experiments show that the release of the drug first goes through a rapid release and then enters the slow release. The fiber membrane with the best sustained-release effect was three layers, which the cumulative release rate was 94.58%.The prepared paeonol fiber membrane has good biocompatibility, bacteriactivity and oxidation resistance, and slow release, and its application in the field of biomedicine is worth further study.
nanofiber membrane; paeonol; polycaprolactone; gelatin; antibacterial; release; hemolysis rate
R283.6
A
0253 - 2670(2023)14 - 4493 - 08
10.7501/j.issn.0253-2670.2023.14.009
2023-02-01
国家自然科学基金项目(52063004)
许海棠,硕士生导师,正高级实验师,研究方向为药物新剂型与制剂新技术。E-mail: xhthellen@163.com
周菊英,博士生导师,教授,研究方向为松香基功能材料的制备与应用。E-mail: zhoujuying@126. com
[责任编辑 郑礼胜]

