二氧化锰纳米复合材料的合成及其在肿瘤治疗中的应用进展
陈艾红,张子文,周诺馨,夏玮,邝运起,赵琳静,陆杰,罗宇,刘锡建
(上海工程技术大学 化学化工学院,上海 201620)
恶性肿瘤由于其难以治愈且易于转移,已成为危害人类健康的最严重的疾病之一。目前肿瘤治疗方法主要有:手术、放疗、化疗、分子靶向治疗,但都存在一定局限性,随着纳米科技的发展,给肿瘤治疗带来新的思路,新型的微创治疗方法也蓬勃发展起来,如光动力治疗(Photodynamic Therapy,PDT)、化学动力治疗(Chemodynamic Therapy,CDT)、声动力治疗(Sonodynamic Therapy,SDT)等[1-2]。
肿瘤微环境(TME)会影响肿瘤的生长、转移与治疗,肿瘤组织在生长过程中会导致肿瘤微环境呈现低氧、弱酸性、高谷胱甘肽(GSH)浓度、过氧化氢(H2O2)过度产生等特点,这些特点也是导致化疗和放疗等治疗手段疗效不佳的重要原因[3]。纳米二氧化锰(MnO2)具有过氧化氢酶活性,可以与H2O2发生化学反应,生成O2,缓解肿瘤微环境的乏氧状态,MnO2还可以与肿瘤中还原性的GSH反应,提高氧化应激,提高肿瘤治疗效果。另外,MnO2在分解后会生成Mn2+,Mn2+在肿瘤弱酸环境下可以发生芬顿反应,催化H2O2产生羟基自由基(·OH),从而导致肿瘤细胞死亡。同样的,纳米MnO2由于可降解的特性,可以作为肿瘤微环境响应的药物载体等,用于化疗药物、蛋白、基因等的递送[4]。
近年来MnO2在肿瘤治疗方面取得了重大研究进展,本文介绍了几种纳米MnO2的主要合成方法:模板法、水热法、溶胶凝胶法,对二氧化锰纳米材料在光动力治疗、化学动力治疗、声动力治疗、化疗等方面的应用进行了综述,展望了其研究发展方向。
1 二氧化锰纳米粒子的制备方法
二氧化锰(MnO2)纳米材料的制备方法主要有模板法、水热法和溶胶凝胶法。
1.1 模板法
模板法已广泛应用于MnO2纳米结构的合成,依据所用模板的物理性质,模板法可分为硬模板法和软模板法。
1.1.1 硬模板法
硬模板法主要采用二氧化硅、碳纳米管及聚苯乙烯等聚合物为模板,二氧化锰在其表面生长得到纳米二氧化锰。Cheng等[5]人首先合成二氧化硅纳米球为模板,然后加入氯化锰和尿素反应得到二氧化锰包覆二氧化硅核壳纳米粒子,高温焙烧后用NaOH将二氧化硅核刻蚀,得到空心的二氧化锰,二氧化锰表面改性后应用于药物负载和肿瘤成像,取得良好的效果,如图1所示。硬模板易制备出分散均一的纳米结构,但制作成本高,效率较低。
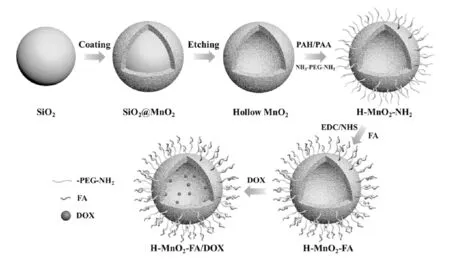
图1 H-MnO2-FA 的合成路线图[5]
1.1.2 软模板法
软模板主要采用表面活性剂、柔性有机分子和嵌段聚合体等形成不同形态的胶束模板,利用静电、氢键和范德华力等作用得到不同形态的纳米材料[6]。例如,油酸作为模板和还原剂,将KMnO4还原制备得到了粒径约136 nm蜂窝状MnO2纳米结构(H-MnO2)。通过调整反应体系及条件,软性模板法可被用来制备诸如纳米片、纳米球及纳米棒等多种形态的MnO2纳米结构[7]。软模板法方法简单,但均一性和尺寸不易控制,表面活性剂的去除也存在一定的问题。
1.2 水热法
水热法利用高温、高压在水热作用下,可以加快和促进离子和水解反应,此方法也是合成纳米二氧化锰的常见的方法。Hou等[8]利用硝酸锰水溶液和双氧水在250 ℃密封的聚四氟不锈钢高压反应釜内反应6 h,得到蒲公英状β-MnO2,水热法比较简单,但是高温高压存在一定的风险。
1.3 溶胶凝胶法
溶胶凝胶法是一种简单、低温的制备纳米结构金属氧化物的工艺,但其挥发溶剂需要较长时间。Hashemzadeh等人[9]将表面活性剂(十六烷基三甲基溴化铵、聚乙烯吡咯烷酮、P123嵌段聚合物等)溶于乙醇中,加入硝酸和乙酸锰后剧烈搅拌,形成均一的溶液后放置于干燥箱挥发溶剂,水洗涤后获得不同形貌的二氧化锰纳米材料。
2 MnO2纳米体系在肿瘤治疗中的应用
2.1 MnO2纳米材料协同PDT
光动力疗法(PDT)是一种新兴的、无创的、非侵入性的肿瘤治疗方法,在一定波长的激光照射下,光敏剂(PSs)被激发,光敏剂与氧气作用产生有毒性的活性氧(ROS),例如单线态氧(1O2),造成线粒体、细胞膜、溶酶体等亚细胞结构损伤,最终诱导细胞凋亡或者坏死[10]。由于肿瘤的无限增殖和血管畸形使得肿瘤微环境氧气供应不足,造成PDT效果下降。利用肿瘤微环境的弱酸性和高浓度的GSH和H2O2与MnO2反应生成O2克服肿瘤乏氧可以显著提高PDT效果[11]。
Cao等[12]通过将纳米药物(MnO2@Ce6)(Chlorin e6,Ce6)装载入间充质干细胞(MSCs)中制备MnO2@Ce6-MSCs“载氧导弹”。在间充质干细胞的细胞动力学作用下药物的靶向性和深层渗透得到增强,光敏剂Ce6通过利用物理吸附的作用与MnO2结合,提高了Ce6在血液循环中稳定性。“导弹”爆炸后释放的MnO2@Ce6对H+和H2O2具有高度敏感性,在原位生成O2,在633 nm激光照射下为1O2的生成提供原料,改善了肿瘤的缺氧环境。与此同时,MnO2分解释放Mn2+表现出较高T1弛豫用磁共振成像。这种方法实现了MSCs引导,Ce6转换,核磁共振监测的PDT为肿瘤的临床治疗提供新的策略。
2.2 MnO2纳米材料介导的CDT
化学动力学疗法(CDT)是步文博[13]课题组提出的一种基于活性氧(ROS)治疗癌症的新兴策略,利用肿瘤微环境弱酸、H2O2过表达等条件介导金属离子发生芬顿(Fenton)或类芬顿(Fenton-like)反应,将H2O2转化为高毒性的羟基自由基(·OH)杀死肿瘤细胞。
MnO2纳米粒可以在弱酸性的肿瘤微环境中与GSH反应生成Mn2+,从而降低GSH浓度,增强CDT效果。同时,触发MnO2纳米粒子的分解还可以催化H2O2原位产生O2,以缓解肿瘤环境缺氧的问题。Li等[14]在Cu/ZIF-8纳米球表面加载化疗药物双硫铵(DSF),并通过物理吸附的方式将葡萄糖氧化酶(GOD)包覆在Cu/ZIF-8纳米球表面,最后用MnO2纳米壳封装构建了Cu/ZIF-8@DSF-GOD@MnO2(CZ-DG-M),如图2a所示。在肿瘤微环境中MnO2消耗GSH破坏活性氧防御机制,同时产生氧气。DSF在生理环境中易被代谢为DTC,DTC易与Cu2+离子形成DTC-Cu络合物(CuET),可损伤肿瘤细胞的DNA、蛋白质,导致细胞凋亡。同时,生成的Cu+离子与H2O2发生类芬顿反应生成ROS,从而实现高效的治疗效果。此外,释放的Mn2+具有磁共振成像功能,可以跟踪纳米催化剂在体内运转。
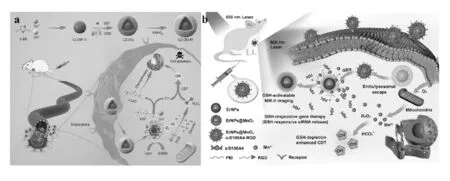
(a)CZ-DG-M的合成和增强CDT示意图[14];(b)发光纳米探针增强CDT的示意图[15]图2 MnO2纳米材料介导的CDT
Ming等[15]将MnO2纳米颗粒与siRNA结合构建一个基因传递载体(ErNPs@MnO2-siS100A4-RGD)如图2b所示。在高浓度的GSH肿瘤环境中,MnO2与GSH反应释放S100A4 siRNA(siS100A4),同时生成Mn2+,随后,镧系纳米探针(ErNPs)暴露于第二近红外区荧光(NIR-II)中,实现精确的基因定位治疗和类芬顿反应介导的CDT效应。
Li的团队[16]用中空MnO2纳米颗粒负载抗癌药物-盐酸阿霉素(DOX),并用聚乙烯亚胺(PEI)和柠檬酸酐修饰的聚L-赖氨酸(PLL(cit))包覆负载DOX的MnO2(HMDN)得到了一个多刺激响应的给药系统DOX@HMDN-PEI-PLL(cit)。在弱酸性的肿瘤微环境中,HMDNs纳米壳的快速破裂释放DOX,与此同时MnO2消耗GSH同步释放Mn2+催化类芬顿反应。
2.3 MnO2纳米材料增强SDT
声动力疗法(SDT)主要原理是利用低强度超声(0.5~4.0 W·cm-2)辐射,激活声敏剂产生活性氧(ROS),从而杀死肿瘤细胞。SDT具有非侵入性,可以利用纳米颗粒在肿瘤部位的聚集特性进行精确定向肿瘤治疗,相比于PDT,SDT利用机械波的高穿透性可有效地治疗深部恶性肿瘤。
超声波激发声敏剂产生电子和空穴,但它们很容易复合,导致活性氧产生效率降低。Zhou及其团队[17]构建了镧(La)掺杂MnO2的多孔纳米颗粒(LMO),可以极大地改善激发电子和空穴的分离效率,从而使ROS的产量得到明显的改善。Liu等[18]将声敏剂(IR780)和MnO2封装在PLGA中,并连接Angiopep-2(Ang)合成多功能纳米酶(Ang-IR780-MnO2-PLGA,AIMP)来增强SDT。在IR780和低强度聚焦超声辐照的作用下,AIMP穿透血脑屏障实现胶质瘤的靶向功能(尤其是线粒体)的靶向性,同时产生活性氧(ROS),诱导肿瘤细胞凋亡。另外,MnO2具有酶活性,与H+、H2O2和GSH发生反应,释放O2,增强了SDT的治疗效果。Mei团队[19]通过将金纳米颗粒(Au NPs)锚定在二维层状黑磷(BP)表面,并在表面涂覆MnO2外壳,随后修饰大豆磷脂(SP)构建了Au/BP@MS,包覆的MnO2可以消耗GSH释放O2,同时引起细胞内氧化应激放大;产生的Mn2+可作为MR成像剂,用于增强肿瘤特异性成像和检测。
2.4 MnO2纳米材料增强化疗
化疗是作为常用的治疗方法,通常使用化学药物来杀死肿瘤细胞[20]。化疗是一种全身性的癌症治疗方法,无论是口服,还是静脉、体腔注射,化学药物都会通过血液循环扩散到身体的大部分器官和组织,具有较大的毒副作用。
为了解决这一系列问题,Zhang等[21]将g-C3N4和DOX封装在ZIF-8中,然后装载MnO2纳米点,最后用F217表面修饰而成(FMZ/DC)。其中,将DOX包裹在ZIF-8载体中,减少了DOX的非特异性药物释放,最大限度地减少了药物的副作用。重要的是,负载的MnO2纳米点催化内源性H2O2产生溶解氧、持续释放DOX,这样可以降低对抗肿瘤药物的耐药性,提高了肿瘤治疗的效率(图3a)。
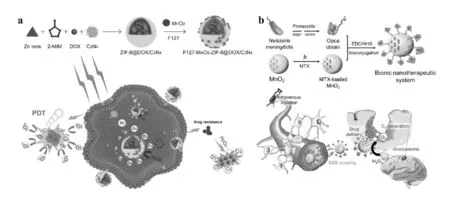
(a)FMZ/DC的制备和化疗示意图[21];(b)MTX@MnO2-Opca对胶质瘤的治疗示意图[22]图3 MnO2纳米材料协同化疗
脑胶质母细胞瘤被认为是无法治愈和最致命的癌症之一,由于血脑屏障(BBB)的存在,在生理环境下,血脑屏障阻止治疗药物循环血液进入肿瘤所在的大脑。为了实现药物无创通过血脑屏障的能力,Zhang的团队[22]利用脑膜炎奈瑟菌的Opca蛋白修饰装载有化疗药物甲氨蝶呤(MTX)的空心二氧化锰(MnO2)纳米颗粒(MTX@MnO2-Opca)。Opca蛋白的存在使药物能够穿过血脑屏障并渗透到肿瘤组织中。MTX@MnO2-Opca在肿瘤区域积累后,MnO2催化肿瘤组织中多余的H2O2分解产生O2,缓解肿瘤缺氧增强化疗效果(图3b)。
3 结论与展望
综上所述,本论文对MnO2纳米材料的性能、合成方法以及在肿瘤治疗的应用进行了综述。近年来,虽然以MnO2纳米复合材料的合成以及在肿瘤治疗中应用研究有了长足的发展,但MnO2纳米材料的进一步临床应用还面临着许多问题。虽然许多研究表明,MnO2纳米体系的生物相容性好、毒性低等,但其长期毒性还没有得到充分的评估,在临床应用时必须降低其毒性,加快其生物降解。
为了实现多种治疗方式相结合,在制备过程中需要加入各种功能成分,例如微粒、生物分子、高分子等,不同作用成分的加入给MnO2纳米材料的稳定可靠的制备带来新的挑战,尚待研究人员开发MnO2纳米材料的大规模、高品质的生产工艺。
单靠一种疗法无法完全实现根除的恶性肿瘤,而联合疗法则能弥补单一疗法的缺陷,提高治疗效率。但是MnO2纳米材料如何与其他功能试剂、药物等发挥协同和互补作用,还需要进一步验证和确认。

