头孢氨苄胶囊溶出曲线一致性研究
韩松涛 梁冬雪 王保森 孙海涛


【摘要】目的:建立头孢氨苄胶囊一致性评价方法。方法:采用篮法,转速100 r/min,分别以水、0.1 mol/L盐酸、pH4.5磷酸盐缓冲液和pH6.8磷酸盐缓冲液为溶出介质,溶出介质体积为900 mL;采用紫外法测定头孢氨苄胶囊溶出度,并计算其累积溶出量,绘制相应溶出曲线;评价溶出曲线的相似度。结果:在4种不同pH的溶出介质中,仿制产品和参比样品均在15 min内溶出量达到了85%以上,说明仿制产品与参比样品溶出行为基本一致,判定相似。结论:本方法可为头孢氨苄胶囊的质量一致性评价提供参考。
【关键词】头孢氨苄;溶出曲线;一致性评价
【DOI编码】10.3969/j.issn.1674-4977.2023.04.031
Consistency of Dissolution Curve of Cephalexin Capsules
HAN Songtao, LIANG Dongxue, WANG Baosen, SUN Haitao*
(Jilin Provincial Institute for Drug Control and Research, Changchun 130000, China)
Abstract: Objective to establish a method for consistency evaluation of Cefalexin Capsules. Methods the blue method was used. The rotating speed was 100r / min. water, 0.1 mol/L hydrochloric acid, pH4.5 phosphate buffer and ph6.8 phosphate buffer were used as the dissolution medium, and the volume of the dissolution medium was 900 mL; The dissolution of Cefalexin Capsules was determined by UV method, and the cumulative dissolution was calculated and the dissolution profile was drawn; The similarity of dissolution curves was evaluated Results in four different pH dissolution media, the dissolution amount of the imitation product and the reference sample reached more than 85% within 15 min, indicating that the dissolution behavior of the imitation product and the reference sample was basically the same, and the judgment was similar. Conclusion this method can provide reference for the quality consistency evaluation of Cefalexin Capsules.
Key words: cephalexin; dissolution curve; consistency evaluation
取頭孢氨苄胶囊,按照《溶出度与释放度测定法》第一法测定,分别采用水介质900 mL、pH4.5介质900 mL、pH6.8介质900 mL、0.1 mol/L盐酸介质900 mL,转数100转,分别在5、10、15、30 min,4个时间点取样5 mL并补加等量相同温度的溶出介质,测定后评价溶出曲线相似度[1],建立一致性评价方法[2]。计算溶出度进行体外溶出曲线相似性比较[3]。
1 水介质
精密称取头孢氨苄对照品14.94 mg,置10 mL量瓶中,加水溶解并稀释至刻度,再精密量取1 mL,置50 mL量瓶中加溶出介质纯化水稀释至刻度,作为对照品溶液,照正文方法进行检测,计算每片溶出量。供试品溶液稀释过程:精密量取参比样品5 min续滤液2 mL置10 mL量瓶中,用溶出介质稀释至刻度,精密量取参比样品10、15、30 min续滤液1 mL置10 mL量瓶中,用溶出介质稀释至刻度。作为参比样品的供试品溶液。精密量取仿制样品5 min续滤液4 mL置10 mL量瓶中,用溶出介质稀释至刻度,精密量取仿制样品10、15、30 min续滤液2 mL置10 mL量瓶中,用溶出介质稀释至刻度,作为仿制样品的供试品溶液。水介质实验结果见表1、表2。
结论:水介质参比制剂和仿制制剂在15 min平均溶出率均达85%以上,水介质时仿制和参比相似。
2 0.1 mol/L盐酸介质
精密称取头孢氨苄对照品14.88 mg,置10 mL量瓶中,加水溶解并稀释至刻度,再精密量取1 mL,置50 mL量瓶中加溶出介质0.1 mol/L盐酸[盐酸溶液(9→1000)]稀释至刻度,作为对照品溶液,照正文方法进行检测,计算每片溶出量。供试品溶液稀释过程:精密量取参比样品5、10、15、30 min续滤液1mL置10 mL量瓶中,加溶出介质0.1 mol/L盐酸[盐酸溶液(9→1000)]稀释至刻度,作为参比样品的供试品溶液。精密量取仿制样品5、10、1、30 min续滤液2 mL置10 mL量瓶中,加溶出介质0.1 mol/L盐酸[盐酸溶液(9→1000)]稀释至刻度,作为仿制样品的供试品溶液。0.1 mol/L盐酸介质实验结果见表 3、表4。
结论:0.1 mol/L盐酸介质参比制剂和仿制制剂在15 min平均溶出率均达85%以上,0.1 mol/L盐酸介质时仿制和参比相似。


3 pH4.5介质
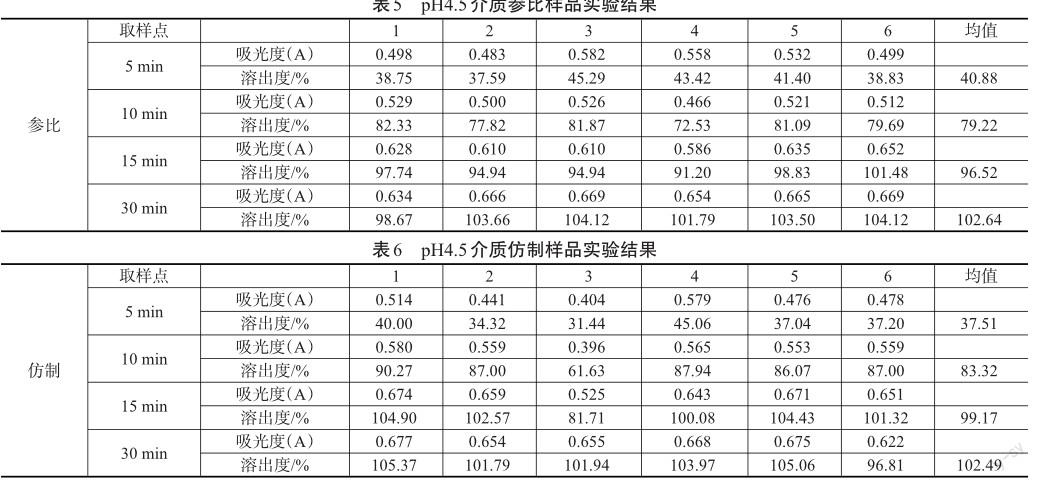
精密称取头孢氨苄对照品14.93 mg,置10 mL量瓶中,加水溶解并稀释至刻度,再精密量取1 mL,置50 mL量瓶中加pH4.5溶出介质(称取无水乙酸钠10.9 g和醋酸9.8 mL加水溶解并稀释至1000 mL,摇匀,即得)稀释至刻度,作为对照品溶液,照正文方法进行检测,计算每片溶出量。供试品溶液稀释:精密量取参比样品5 min续滤液2 mL置10 mL量瓶中,用pH4.5溶出介质稀释至刻度,精密量取参比样品10、15、30 min续滤液1 mL置10 mL量瓶中,用pH4.5溶出介质稀释至刻度。作为参比样品的供试品溶液。精密量取仿制样品5 min续滤液4 mL置10 mL量瓶中,用pH4.5溶出介质稀释至刻度,精密量取仿制样品10、15、30 min续滤液2 mL置10 mL量瓶中,pH4.5溶出介质稀释至刻度,作为仿制样品的供试品溶液。pH4.5介质实验结果见表5、表6。
结论:pH4.5介质参比制剂和仿制制剂在15 min平均溶出率均达85%以上,pH4.5介质时仿制和参比相似。

4 pH6.8介质
精密称取头孢氨苄对照品15.30 mg,置10 mL量瓶中,加水溶解并稀释至刻度,再精密量取1 mL,置50 mL量瓶中加pH6.8溶出介质(称取磷酸二氢钾6.8 g和氢氧化钠0.944 g,加水溶解并稀释至1000 mL摇匀,即得)稀释至刻度,作为对照品溶液,照正文方法进行检测,计算每片溶出量。供试品溶液稀释:精密量取参比样品5 min续滤液2 mL置10 mL量瓶中,用pH6.8溶出介质稀释至刻度,精密量取参比样品10、15、30 min续滤液1 mL置10 mL量瓶中,用pH6.8溶出介质稀释至刻度。作为参比样品的供试品溶液。精密量取仿制样品5 min续滤液4 mL置10 mL量瓶中,用pH6.8溶出介质稀释至刻度,精密量取仿制样品10、15、30 min续滤液2 mL置10 mL量瓶中,pH6.8溶出介质稀释至刻度,作为仿制样品的供试品溶液。pH6.8介质实验结果见表7、表8。
结论:pH6.8介质参比制剂和仿制制剂在15 min平均溶出率均达85%以上,pH6.8介质时仿制和参比相似。

5結论
水介质、0.1 mol/L盐酸介质、pH4.5介质、pH6.8介质参比制剂和仿制制剂在15 min平均溶出率均达85%以上,说明仿制制剂和参比制剂相似。因此本方法可为头孢氨苄胶囊的质量一致性评价提供参考。
【参考文献】
[1]牛剑钊,林兰,张启明.美国和日本溶出曲线相似性判定方法介绍[J].中国药物评价,2013,30(2):67-69.
[2]曾俊芬,宋金春.仿制药质量和疗效一致性评价思考[J].医药导报,2019,38(7):884-887.
[3]孔彬,李新霞,李文军,等.过程分析比较5个不同厂家格列吡嗪片的体外溶出相似性[J].西北药学杂志,2017,32(1):80-84.
【作者简介】
韩松涛,男,1982年出生,副主任药师,研究方向为药品检验。通讯作者:孙海涛,男,1971年出生,主任药师,研究方向为药品检验,联系电话:13504318008。
(编辑:侯睿琪)

