天然药物中抗乙型肝炎病毒活性成分研究进展
孙伍慧,姚思凡,张艺,赵碧清
〔摘要〕 乙型肝炎病毒(hepatitis B virus, HBV)是引起乙型肝炎的病原体,具有传染性强、发病率高和流行范围广等特点,严重威胁着人类的健康。目前临床使用的药物存在着较大缺陷,迫切需要更为高效安全的抗HBV新药,研究天然药物及其活性成分抗HBV已经成为一种趋势。通过查阅近十年文献,对天然药物中抗HBV活性单体成分的研究概况进行整理,按化学类别分类,总结出97个活性显著、靶点独特的天然药物活性成分及衍生物,主要包括苯丙素类、黄酮类、生物碱类、萜类等,并对HBV的感染与抑制机制进行归纳。旨在阐述抗HBV活性成分的新发现,为今后开发新的抗HBV药物提供参考。
〔关键词〕 天然药物;抗乙型肝炎病毒;活性成分;作用机制;研究进展
〔中图分类号〕R284 〔文献标志码〕A 〔文章编号〕doi:10.3969/j.issn.1674-070X.2023.08.030
Research progress on active ingredients of anti-hepatitis B
virus in natural medicines
SUN Wuhui, YAO Sifan, ZHANG Yi, ZHAO Biqing*
Hunan University of Chinese Medicine, Changsha, Hunan 410208, China
〔Abstract〕 As the pathogen of hepatitis B, hepatitis B virus (HBV) is characterized by strong infectivity, high morbidity, and wide prevalence, which seriously threatens human health. Currently, there are significant deficiencies in the clinical use of drugs against it, and more efficient and safer new anti-HBV drugs are urgently needed. It has become a trend to study natural medicines and their active ingredients against HBV. By consulting the literature in the past decade, the research progress on the active ingredients of anti-HBV in natural medicines was reviewed. According to chemical categories, 97 active ingredients and derivatives of natural medicines with notable activity and unique targets were summarized, mainly including phenylpropanoids, flavonoids, alkaloids, terpenoids, and others. Meanwhile, the mechanisms of HBV infection and inhibition were also summarized. This paper aims to elaborate the new findings of anti-HBV active ingredients and provide reference for the development of new anti-HBV drugs in the future.
〔Keywords〕 natural medicines; anti-hepatitis B virus; active ingredients; mechanism of action; research progress
乙型肝炎病毒(hepatitis B virus, HBV)是目前發现的能感染人类的最小嗜肝双链DNA病毒,基因组长约3.2 kb。据报道,全球约20亿人曾感染HBV,每年约有65万人死于HBV感染所致的肝衰竭、肝硬化和肝细胞癌[1]。
目前,国内外对HBV的治疗尚无特效疗法,临床使用的药物主要包括具有抗病毒作用的干扰素和能够抑制HBV逆转录的核苷类似物(如拉米夫定、恩替卡韦等)[2-3]。但这些药物存在严重的不良反应和耐药性,因此,开发安全有效、机制新颖的抗HBV药物是当前研究的重点[4-5]。
天然药物来自于植物、动物、微生物和海洋生物等,且以植物来源为主,其活性成分因其结构的多样性和复杂性成为发现新药或新的药物先导分子的重要源泉[6]。中国传统医学记载的许多天然药物在保肝降酶、抗肝纤维化等方面具有明显优势,且不良反应较少[7]。基于天然药物开发的乙肝宁、护肝片、齐墩果酸片,可以使一部分患者达到功能性治愈[8-9],并且天然药物中的活性成分(如水飞蓟素、苦参素)联合西药治疗的临床表现也优于常规西药治疗方案[10-11]。本文首次对近十年来报道的天然药物中具有代表性的抗HBV活性成分(共97个,包括19个人工合成衍生物)及其相关作用机制进行综述,旨在为今后抗HBV药物的深入研究提供参考。
1 HBV感染及抑制机制
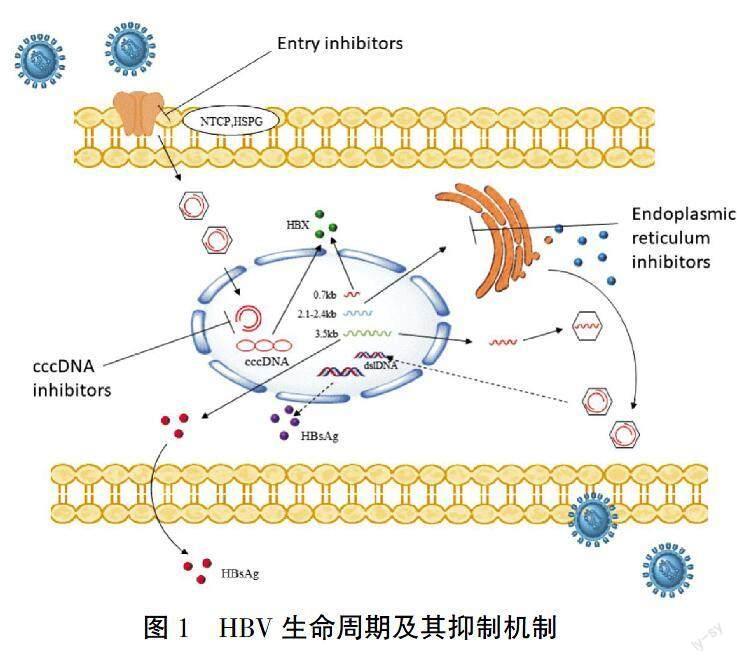
HBV通过L-HBsAg与钠离子-牛磺胆酸共转运蛋白(NTCP)结合以及S-HBsAg与肝细胞膜上的硫酸乙酰肝素蛋白聚糖(HSPG)结合进入肝细胞。病毒包膜与内体膜融合以释放核衣壳,核衣壳由运动蛋白沿微管向细胞核运输,随后核衣壳解体并将HBV rcDNA和一些核心蛋白释放到细胞核中。一旦HBV rcDNA进入细胞核,它将经历一系列生化过程,转化为共价闭合环状DNA(cccDNA),这是HBV生命周期中的关键中间体。cccDNA作为病毒 RNA 主要的转录模板,转录成3.5 kb、2.4 kb、2.1 kb和0.7 kb 4种HBV RNA,这些RNA翻译产生HBeAg、核心蛋白、P蛋白、L-HBsAg、M-HBsAg、S-HBsAg和HBx蛋白。移出细胞核的mRNA经蛋白质外膜包装后形成新的完整病毒分子,移出肝细胞(HBV生命周期及相关抑制机制见图1)。一部分核衣壳穿梭回细胞核以维持相对稳定的cccDNA池。清除cccDNA是治愈乙型肝炎的理想目标,但通过目前采用的抗病毒疗法几乎是不可能的,因此,基本将功能性治愈作为治疗的目标,即一种血清HBsAg丢失的状态[12-15]。
2 抗HBV天然药物化学成分
2.1 苯丙素类
苯丙素类化合物具有抗肿瘤、抗病毒、保肝等生物活性[16]。如五味子果实中多种木脂素具有护肝作用,能降低血清丙氨酸转氨酶水平。五味子甲素及其类似物已广泛用于慢性肝炎的治疗[17]。
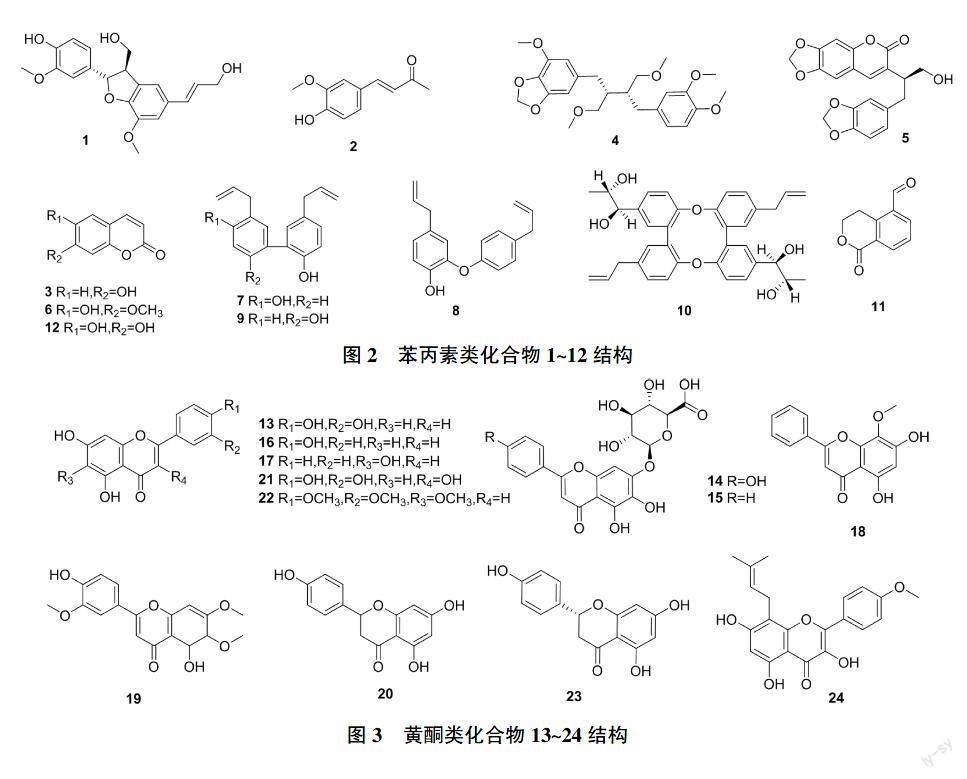
研究发现,(+)-dehydrodiconiferyl alcohol (1)[18]、dehydrozingerone(2)[18]、7-羟基香豆素(3)[19]能显著抑制HBsAg分泌(IC50值分别为1.96、0.50、0.89 mmol/L),降低HBV的感染。珠子草素(4)[20]、coumarinlignan(5)[21]、6-羟基-7-甲氧基-香豆素(6)[22]、和厚朴酚(7)[23]、异厚朴酚(8)[24]、厚朴酚(9)[24]、(7′R,8′S,7′′R,8′′S)-erythron-strebluslignanol G(10)[24]、erythrocentaurin(11)[25]能抑制HBsAg(IC50值分别为0.015、0.025、0.029、0.03、0.03、0.02、0.08、0.28 mmol/L)和HBeAg(IC50值分别为0.025、0.05、0.046、0.04、0.03、0.03、0.1、0.29 mmol/L)的分泌,4在体内也表现出良好的抗HBV活性,能显著抑制感染DHBV的小鸭ALT和AST的表达。7、10还对HBV-DNA的复制具有明显的抑制作用(IC50分别为0.09、0.08 mmol/L)。秦皮乙素(12)不仅能抑制HBV抗原和HBV-DNA的表达,还能剂量依赖性的抑制HBx蛋白的表达[26]。1~12结构见图2,其名称、靶点及来源见表1。
2.2 黄酮类
黄酮类化合物广泛存在于中草药中,具有多种生物活性[27],例如具有显著保肝效果的水飞蓟素,已成功发展成保肝药物,临床中常用于各种肝脏疾病的治疗[28]。
有研究表明,木犀草素(13)[29]、野黄芩苷(14)[30]、黄芩苷(15)[30]、芹菜素(16)[30]、黄芩素(17)[30]、汉黄芩素(18)[30]、3'-甲氧基蓟黄素(19)[31]、柚皮素(20)[32]对HBsAg(IC50值分别为0.02、0.05、0.1、0.029、0.03、0.04、0.08、1.3 mmol/L)和HBeAg(IC50值分别为0.02、0.03、0.08、0.03、0.06、0.03、0.02、0.03 mmol/L)有显著的抑制作用。王卫京等[33]通过分子对接技术发现,槲皮素(21)、异泽兰黄素(22)和(2R)-5,7-dihydroxy-2-(4-hydroxyphenyl)chroman-4-one(23)對HBx蛋白、核衣壳蛋白和聚合酶三个靶点起到抑制作用。淫羊藿素(24)被报道能通过增强HBP1对AFP的转导,阻止HBx与HBP1结合,抑制肝癌细胞发展成恶性肿瘤[34]。13~24结构见图3,其名称、靶点及来源见表1。
2.3 生物碱类
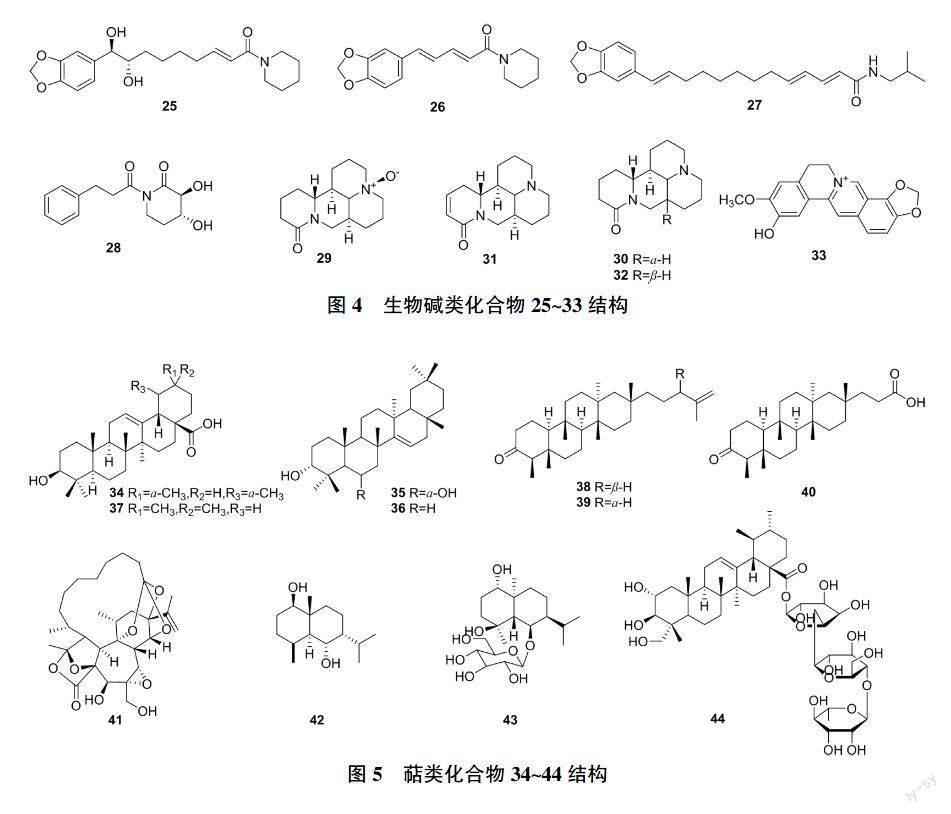
生物碱是一类含氮碱性有机化合物,具有多种抗病毒活性,主要包括抗流感病毒、抗HBV等,是发现抗病毒药物的重要来源[35]。其中erythro-1-[1-oxo-9(3,4-methylenedioxyphenyl)-8,9-dihydroxy-2E-nonenyl]-piperidine(25)[36]、胡椒碱[36](26)、几内亚胡椒碱胺(27)[36]、3β,4α-dihydroxy-1-(3-phenylpropanoyl)-piperidine-2-one(28)[37]、氧化苦参碱(29)[38]、苦参碱(30)[38]、槐果碱(31)[39]和槐定碱(32)[39]对HepG2.2.15细胞分泌HBsAg(IC50值分别为0.13、0.05、0.15、0.21、0.5、0.1、0.04、1.8 mmol/L)和HBeAg(IC50值分别为0.16、0.05、0.14、0.21、0.7、0.2、0.02、4.1 mmol/L)具有显著的抑制作用。且28还能联合恩替卡韦通过下调NTCP的表达同时抑制p38蛋白磷酸化达到抗病毒的效果,对耐药HBV也有很好的疗效[40]。ZENG等[41]从岩黄连中获得了一种季铵生物碱DHCH(33),不仅能抑制HBsAg和HBeAg的分泌(IC50值分别为0.15 mmol/L和0.07 mmol/L),而且能剂量和时间依赖性地降低HBV的细胞内外DNA和cccDNA的水平。25~33结构见图4,其名称、靶点及来源见表1。
2.4 萜类
萜类化合物是一类以异戊二烯为基本结构单元的化合物。具有广泛的生物活性,主要包括抗炎和抗病毒作用[42]。其中,熊果酸(34)[22]、sweriyunnangenin A(35)[25]、3-epitaraxerol(36)[25]、齐墩果酸(37)[25]可显著抑制HBsAg(IC50值分别为0.09、0.28、1.26、0.1 mmol/L)和HBeAg(IC50值分别为0.1、1.29、0.41、1.94 mmol/L)的分泌。有研究报道紫菀中的astataricusones B(38)[43]、astataricusol A(39)[43]和astershionones C(40)[44]可以抑制HBeAg(IC50值分别为0.17、0.13、0.02 mmol/L)的分泌以及HBV-DNA(IC50值分别为0.02、0.3、0.02 mmol/L)的复制。此外,37和39还能抑制HBsAg的分泌(IC50值分别为0.17 mmol/L和1.26 mmol/L)。张志强等[45]报道pimelotide C(41)抑制HBsAg作用十分显著,TI高达355.63。ZHAO等[46]报道7-eudesm-4(15)-ene-1β, 6α-diol(42)和pumilaside A(43)能显著抑制HBV-DNA复制(IC50值分别为0.02 mmol/L和0.01 mmol/L)。42还可以抑制HBsAg和HBeAg的分泌(IC50值分别为0.015 mmol/L和0.01 mmol/L)。从天胡荽中分离出的积雪草苷(44)[47]能有效抑制HBsAg和HBeAg的分泌,并通过抑制核心、s1、s2和x基因启动子活性,显著降低HBV-DNA的转录和复制。34~44结构见图5,其名称、靶点及来源见表1。
2.5 有机酸类
从菊苣中分离出的菊苣酸(45)[48]能通过抑制HBsAg(IC50值为0.03 mmol/L)和HBeAg(IC50值为0.07 mmol/L)的分泌来抑制HBV感染。Scoparamide
A(46)[49]、间羟基苯甲酸(47)[50]、对羟基苯甲酸(48)[50]、3,4-二羟基苯甲酸(49)[50]不仅能抑制HBsAg(IC50值分别为0.61、0.7、0.9、0.2 mmol/L)和HBeAg(IC50值分别为0.88、0.1、0.1、0.07 mmol/L)的分泌,还能抑制HBV-DNA复制(IC50值分别为0.47、0.09、0.06、0.06 mmol/L)。TSUKAMOTO等[51]建立了检测ε-RNA结合-Pol的下拉测定系统,发现迷迭香酸(50)通过特异性地靶向ε-多糖抑制HBV复制。并且分析了另外25种迷迭香酸衍生物,发现迷迭香酸的“两端两个酚羟基”和“咖啡酸样结构”是靶向ε-多糖的关键。ZHAO等报道[52]金银花中的绿原酸(51)、隐绿原酸(52)、新绿原酸(53)、3,5-二咖啡酰奎宁酸(54)、4,5-二咖啡酰奎宁酸(55)、3,4-二咖啡酰奎宁酸(56)具有较强的抗HBV-DNA复制活性(IC50值0.06~2.62 mmol/L)。45~56结构见图6,其名称、靶点及来源见表1。
2.6 苯环衍生物
研究人员发现间羟基苯甲醇(57)[50]、3,4-二羟基苯甲酸乙酯(58)[50]、2,5-二羟基苯甲酸乙酯(59)[50]、taraffinisoside A(60)[53]、descaffeoylcrenatoside(61)[53]和3,4-dihydroxyphenylethanol-8-O-[β-D-apiofuranosyl(1→3)]-β-D-glucopyranoside(62)[53]分别表现出显著的抑制HBsAg(IC50值分别为0.14、0.23、0.79、0.5、0.72、0.26 mmol/L)和HBeAg分泌的活性(IC50值分别为5.03、3.74、1.12、0.93、0.42、0.07 mmol/L),57~59还能抑制HBV-DNA复制(IC50值分别为0.22、0.29、0.02 mmol/L)。ZHOU等[54]报道3,3′,5-三羟基联苯(63)通过抑制HBeAg分泌来降低HBV感染。HUANG等[55]报道,对羟基苯乙酮(PHAP)(64)可显著抑制HBV復制,其机制可能是通过干扰内质网信号通路,参与调节表面蛋白基因的表达从而阻止病毒颗粒的释放。ZHAO等[56]继续研究发现一个PHAP衍生物2f(65)对HBV-DNA复制的抑制作用较强(IC50值为5.8 μmol/L,SI值为160.3)。一级结构-活性关系表明,PHAP糖苷和取代肉桂酸的共轭衍生物能明显增强抗HBV-DNA复制的活性。57~65结构见图7,其名称、靶点及来源见表1。
2.7 苯丙氨酸二肽类
马蹄金素(MTS)(66)是从植物药马蹄金中分离到的抗HBV活性成分,有研究者对其衍生物Y101(67)开展了系统的临床前研究并获得药物临床试验批件(药物名称:替芬泰)[57]。在此基础上,研究人员相继合成并筛选了能够显著抑制HBV-DNA复制的新型MTS衍生物(68~84),IC50值0.29~52.5 μmol/L[58-63]。66~84结构见图8,其名称、靶点及来源见表1。
2.8 其他
2.8.1 蒽醌类 蓝天云等[64]发现,金丝桃素(85)可以通过抑制多功能反转录酶P蛋白的活性达到与拉米夫定类似的抗HBV的作用。彭政等[65]从黄根中分离出的甲基异茜草素(86)能显著抑制多个靶点活性,有望成为一种新型抗HBV药物候选[66]。PARVEZ等[67]考察了关于芦荟提取物的衍生蒽醌的抗HBV潜能,结果表明,芦荟苷b(87)具有新的抗病毒作用,但芦荟大黄素(88)具有cyp3a4激活作用,更有希望开发成抗HBV药物。
2.8.2 烯二炔类 茵陈是我国用于治疗慢性肝病最常用的中草药[68]。GENG等[49,69]从茵陈中分离出3个具有抗HBV的活性化合物(抑制HBeAg、HBsAg、HBV-DNA的IC50值均<1 mmol/L)(89~91),并根据这些化合物的生物学效应总结了其构效关系。结果表明,羟基和糖基更适合维持抗HBV活性,咖啡酰基团有重要作用但替代位置并不关键。85~91结构见图9,其名称、靶点及来源见表1。
2.8.3 多糖类 近年来,临床上关于天然多糖防治乙型肝炎方面的研究逐渐增多,已有多种天然多糖类活性物质被证实具有抗HBV的作用[70]。ZHAO等[71]从香菇子实体中获得两种多糖组分(92、93),在体外具有强大的抗HBV活性,浓度为48.0 mg/mL时即可表现较高的HBeAg和HBsAg抑制率。刘小燕等[72]报道中国圆田螺多糖(94)具有体内抗DHBV活性。陈继岩等[73]通过体内外实验证明,羧甲基茯苓多糖(95)具有抑制HBV,调节TGF-β/Smad信号转导通路等作用。蒙明瑜等[74]发现,剑叶耳草多糖(96)有显著的抗HBV活性,其机制可能与激活JAK/STAT信号通路和促进抗病毒蛋白表达有关。张玲等[75]报道,猪苓多糖(97)穴位注射联合恩替卡韦治疗慢性乙型肝炎具有明显协同作用。
3 总结与展望
天然药物中的活性成分在临床上表现出一定的抗性效果[10-11],且经过药理学研究证实,具有抗HBV活性,具有多靶点、多通路的特点,因此,从天然药物中分离筛选抗HBV先导化合物是抗HBV新药研发的重要途径。
目前,研究者们已从天然药物中分离出很多结构新颖、抗HBV活性高的成分。其中黄酮类、苯丙素类、有机酸类成分的数量更多(表1),且抗HBV活性更为显著。此外,“咖啡酸样结构”“咖啡酰基团的数量”“羟基数量与位置”“羧基”等结构特征与抗HBV活性密切相关[32,51,69],可为今后抗HBV新药的研究提供参考。目前,对天然药物中抗HBV活性成分的研究主要集中在其简单分离和鉴定,而对抗HBV機制和靶点的深入研究相对较少。因此,要结合药理学、系统生物学等学科,深入系统开展天然产物中抗HBV活性成分的靶点和作用机制的研究,以期为临床上治疗HBV提供重要的理论依据。
参考文献
[1] YUEN M F, CHEN D S, DUSHEIKO G M, et al. Hepatitis B virus infection[J]. Nature Reviews Disease Primers, 2018, 4: 18035.
[2] LEE H W, LEE J S, AHN S H. Hepatitis B virus cure: Targets and future therapies[J]. International Journal of Molecular Sciences, 2020, 22(1): 213.
[3] NGUYEN M H, WONG G, GANE E, et al. Hepatitis B virus: Advances in prevention, diagnosis, and therapy[J]. Clinical Microbiology Reviews, 2020, 33(2): e00046-e00019.
[4] 娄晓月, 侯婷婷, 苗薇薇, 等. 抗乙肝药物研究现状[J]. 现代医学与健康研究电子杂志, 2019, 3(11): 12-13.
[5] SHAO J M, LIU Y, LIU L M, et al. Multiple drug-resistant HBV mutation may contribute to poor response of adefovir + entecavir in entecavir-resistant patients[J]. Journal of Infection in Developing Countries, 2021, 15(1): 131-140.
[6] NEWMAN D J, CRAGG G M. Natural products as sources of new drugs over the nearly four decades from 01/1981 to 09/2019[J]. Journal of Natural Products, 2020, 83(3): 770-803.
[7] 邹必英. 中药抗乙型肝炎病毒的研究进展[J]. 临床合理用药杂志, 2017, 10(30): 180-181.
[8] 陈 珊, 龙云升, 伍灵南, 等. 乙肝宁颗粒剂治疗慢性乙型肝炎的临床观察[J]. 中国实用医药, 2018, 13(35): 104-105.
[9] 龙继塔, 李莲彩, 霍云岗, 等. 中草药治疗乙肝的临床探讨[J]. 求医问药(下半月), 2012, 10(5): 79.
[10] 赵晓迎. 水飞蓟素与干扰素α-2b联合恩替卡韦治疗乙肝肝硬化患者的效果比较[J]. 中国民康医学, 2021, 33(18): 145-147.
[11] 陈俊平. 苦参素注射液联合恩替卡韦治疗乙肝肝硬化患者的疗效评价[J]. 内蒙古医学杂志, 2020, 52(9): 1095-1096.
[12] ALLWEISS L, DANDRI M. The role of cccDNA in HBV maintenance[J]. Viruses, 2017, 9(6): 156.
[13] WATASHI K. HBV slow maturation process leads to infection[J]. Trends in Microbiology, 2016, 24(8): 597-599.
[14] HERRSCHER C, PASTOR F, BURLAUD-GAILLARD J, et al. Hepatitis B virus entry into HepG2-NTCP cells requires clathrin-mediated endocytosis[J]. Cellular Microbiology, 2020, 22(8): e13205.
[15] FANNING G C, ZOULIM F, HOU J L, et al. Author Correction: Therapeutic strategies for hepatitis B virus infection: Towards a cure[J]. Nature Reviews Drug Discovery, 2020, 19(4): 291.
[16] 张高荣, 黄锡山, 黄 艳, 等. 鹊肾树属植物的化学成分及药理活性研究进展[J]. 中草药, 2021, 52(19): 6066-6075.
[17] 胡 荻, 魏国伟, 曲中原. 五味子保肝作用的研究进展[J]. 药学研究, 2019, 38(4): 229-232.
[18] HE K, GENG C A, CAO T W, et al. Two new secoiridoids and other anti-hepatitis B virus active constituents from Swertia patens[J]. Journal of Asian Natural Products Research, 2016, 18(6): 528-534.
[19] 吴 芳. 艾叶EA部位抗HBV活性成分分析[D]. 郑州: 郑州大学, 2016.
[20] LIU S, WEI W X, SHI K C, et al. In vitro and in vivo anti-hepatitis B virus activities of the lignan niranthin isolated from Phyllanthus niruri L[J]. Journal of Ethnopharmacology, 2014, 155(2): 1061-1067.
[21] SU W, ZHAO J P, YANG M, et al. A coumarin lignanoid from the stems of Kadsura heteroclita[J]. Bioorganic & Medicinal Chemistry Letters, 2015, 25(7): 1506-1508.
[22] LI L Q, LI J, HUANG Y, et al. Lignans from the heartwood of Streblus asper and their inhibiting activities to hepatitis B virus[J]. Fitoterapia, 2012, 83(2): 303-309.
[23] CHEN H, LI J, WU Q, et al. Anti-HBV activities of Streblus asper and constituents of its roots[J]. Fitoterapia, 2012, 83(4): 643-649.
[24] LI J, MENG A P, GUAN X L, et al. Anti-hepatitis B virus lignans from the root of Streblus asper[J]. Bioorganic & Medicinal Chemistry Letters, 2013, 23(7): 2238-2244.
[25] CAO T W, GENG C A, JIANG F Q, et al. Chemical constituents of Swertia yunnanensis and their anti-hepatitis B virus activity[J]. Fitoterapia, 2013, 89: 175-182.
[26] HUANG S X, MOU J F, LUO Q, et al. Anti-hepatitis B virus activity of esculetin from Microsorium fortunei in vitro and in vivo[J]. Molecules, 2019, 24(19): 3475.
[27] 杨玲娟, 宋蒙蒙, 狄留庆, 等. 天然黄酮类化合物对芳香烃受体的调控作用研究进展[J]. 南京中医药大学学报, 2021, 37(6): 958-964.
[28] LV D D, WANG Y J, WANG M L, et al. Effect of silibinin capsules combined with lifestyle modification on hepatic steatosis in patients with chronic hepatitis B[J]. Scientific Reports, 2021, 11(1): 655.
[29] WANG H L, GENG C A, MA Y B, et al. Three new secoiridoids, swermacrolactones A-C and anti-hepatitis B virus activity from Swertia macrosperma[J]. Fitoterapia, 2013, 89: 183-187.
[30] 周凌凌. 半枝蓮黄酮抗乙肝病毒活性成分筛选及化学成分研究[D]. 南京: 南京农业大学, 2015.
[31] 赵志鸿, 吴 芳, 郑立运, 等. 艾叶提取物的化学成分及抗HBV活性分析[J]. 中国实验方剂学杂志, 2016, 22(9): 30-34.
[32] GE L L, XIAO L Y, WAN H Q, et al. Chemical constituents from Lonicera japonica flower buds and their anti-hepatoma and anti-HBV activities[J]. Bioorganic Chemistry, 2019, 92: 103198.
[33] 王卫京, 詹世平, 丁仕强. 多靶点分子对接研究艾叶抗乙肝病毒的有效成分[J]. 化工设计通讯, 2020, 46(9): 157-159.
[34] CAO Z Y, CHENG Y N, WANG J Y, et al. HBP1-mediated transcriptional repression of AFP inhibits hepatoma progression[J]. Journal of Experimental & Clinical Cancer Research, 2021, 40(1): 118.
[35] 梁晓莲, 刘纤纤, 李文莉, 等. 生物碱类化合物抗病毒研究进展[J]. 辽宁中医药大学学报, 2021, 23(4): 51-57.
[36] JIANG Z Y, LIU W F, ZHANG X M, et al. Anti-HBV active constituents from Piper longum[J]. Bioorganic & Medicinal Chemistry Letters, 2013, 23(7): 2123-2127.
[37] JIANG Z Y, LIU W F, HUANG C G, et al. New amide alkaloids from Piper longum[J]. Fitoterapia, 2013, 84: 222-226.
[38] 冉賢金, 胡虞乾. 氧化苦参碱和拉米夫定体外抗乙肝病毒的比较[J]. 中国生化药物杂志, 2012, 33(2): 142-144.
[39] 张明发, 沈雅琴. 苦参碱类生物碱抗乙型肝炎病毒的临床药理作用研究进展[J]. 抗感染药学, 2018, 15(1): 1-6.
[40] 陈佳欣, 沈宏辉, 刘晓琼, 等. 苦参碱类生物碱联合恩替卡韦抗耐药HBV的作用效果及机制分析[J]. 中国实验方剂学杂志, 2017, 23(1): 107-113.
[41] ZENG F L, XIANG Y F, LIANG Z R, et al. Anti-hepatitis B virus effects of dehydrocheilanthifoline from Corydalis saxicola[J]. The American Journal of Chinese Medicine, 2013, 41(1): 119-130.
[42] 张建红, 刘琬菁, 罗红梅. 药用植物萜类化合物活性研究进展[J]. 世界科学技术: 中医药现代化, 2018, 20(3): 419-430.
[43] ZHOU W B, ZENG G Z, XU H M, et al. Astataricusones A-D and astataricusol A, five new anti-HBV shionane-type triterpenes from Aster tataricus L. F[J]. Molecules, 2013, 18(12): 14585-14596.
[44] ZHOU W B, ZENG G Z, XU H M, et al. Astershionones A-F, six new anti-HBV shionane-type triterpenes from Aster tataricus[J]. Fitoterapia, 2014, 93: 98-104.
[45] 张志强, 李石飞, 张立伟, 等. 黄芫花化学成分及其抗乙肝病毒作用[J]. 中草药, 2017, 48(7): 1292-1297.
[46] ZHAO Y, GENG C A, SUN C L, et al. Polyacetylenes and anti-hepatitis B virus active constituents from Artemisia capillaris[J]. Fitoterapia, 2014, 95: 187-193.
[47] HUANG Q F, ZHANG S J, HUANG R B, et al. Isolation and identification of an anti-hepatitis B virus compound from Hydrocotyle sibthorpioides Lam[J]. Journal of Ethnopharmacology, 2013, 150(2): 568-575.
[48] ZHANG H L, DAI L H, WU Y H, et al. Evaluation of hepatocyteprotective and anti-hepatitis B virus properties of Cichoric acid from Cichorium intybus leaves in cell culture[J]. Biological & Pharmaceutical Bulletin, 2014, 37(7): 1214-1220.
[49] GENG C A, HUANG X Y, CHEN X L, et al. Three new anti-HBV active constituents from the traditional Chinese herb of Yin-Chen (Artemisia scoparia)[J]. Journal of Ethnopharmacology, 2015, 176: 109-117.
[50] CAO T W, GENG C A, MA Y B, et al. Chemical constituents of Swertia mussotii and their anti-hepatitis B virus activity[J]. Fitoterapia, 2015, 102: 15-22.
[51] TSUKAMOTO Y, IKEDA S, UWAI K, et al. Rosmarinic acid is a novel inhibitor for Hepatitis B virus replication targeting viral epsilon RNA-polymerase interaction[J]. PLoS One, 2018, 13(5): e0197664.
[52] ZHAO Y, GENG C A, MA Y B, et al. UFLC/MS-IT-TOF guided isolation of anti-HBV active chlorogenic acid analogues from Artemisia capillaris as a traditional Chinese herb for the treatment of hepatitis[J]. Journal of Ethnopharmacology, 2014, 156: 147-154.
[53] ZHOU X L, WEN Q W, LIN X, et al. A new phenylethanoid glycoside with antioxidant and anti-HBV activity from Tarphochlamys affinis[J]. Archives of Pharmacal Research, 2014, 37(5): 600-605.
[54] ZHOU N J, GENG C A, HUANG X Y, et al. Anti-hepatitis B virus active constituents from Swertia chirayita[J]. Fitoterapia, 2015, 100: 27-34.
[55] HUANG T J, LIU S H, KUO Y C, et al. Antiviral activity of chemical compound isolated from Artemisia morrisonensis against hepatitis B virus in vitro[J]. Antiviral Research, 2014, 101: 97-104.
[56] ZHAO Y, GENG C A, CHEN H, et al. Isolation, synthesis and anti-hepatitis B virus evaluation of p-hydroxyacetophenone derivatives from Artemisia capillaris[J]. Bioorganic & Medicinal Chemistry Letters, 2015, 25(7): 1509-1514.
[57] FAN H R, ZHANG A J, LIAO C P, et al. In vitro metabolism and in vivo pharmacokinetics of bentysrepinine (Y101), an investigational new drug for anti-HBV-infected hepatitis: Focus on interspecies comparison[J]. Xenobiotica, 2020, 50(4): 468-478.
[58] 况安香, 曾晓萍, 曹 盼, 等. 含氟或氯取代的马蹄金素衍生物的合成及其抗乙肝病毒活性研究[J]. 贵州医科大学学报, 2019, 44(4): 418-422,452.
[59] 况安香, 卢 苇, 曾晓萍, 等. 含藜芦酸单元的马蹄金素衍生物的合成及其抗HBV活性研究[J]. 中国新药杂志, 2019, 28(12): 1523-1530.
[60] 黄维杰, 况安香, 邵晓霜, 等. 氟代马蹄金素二肽模拟物的合成及其抗HBV活性初探[J]. 药学学报, 2022, 57(4): 1095-1105.
[61] 崔 晶, 卢 苇, 邱净英, 等. 三氟甲基取代马蹄金素衍生物的合成及其抗乙肝病毒活性研究[J]. 中国药学杂志, 2019, 54(13): 1045-1053.
[62] 姜欣怡, 曾晓萍, 韦可心, 等. 新型N-甲基马蹄金素衍生物的合成及抗乙肝病毒活性[J]. 合成化学, 2019, 27(4): 244-252.
[63] 周 晨, 徐广灿, 胡占兴, 等. 新型马蹄金素三触角半乳糖苷衍生物的合成及其抗乙肝病毒活性[J]. 合成化学, 2018, 26(3): 160-167.
[64] 蓝天云. 金丝桃素抗乙肝病毒作用及机制研究[D]. 昆明: 昆明理工大学, 2016.
[65] 彭 政, 田 炜, 蓝 富, 等. 黄根提取物抗乙型肝炎病毒活性的初步研究[J]. 广西医科大学学报, 2017, 34(6): 820-822.
[66] PENG Z, FANG G, PENG F H, et al. Effects of Rubiadin isolated from Prismatomeris connata on anti-hepatitis B virus activity in vitro[J]. Phytotherapy Research, 2017, 31(12): 1962-1970.
[67] PARVEZ M K, AL-DOSARI M S, ALAM P, et al. The anti-hepatitis B virus therapeutic potential of anthraquinones derived from Aloe vera[J]. Phytotherapy Research, 2019, 33(11): 2960-2970.
[68] CAI Y, ZHENG Q, SUN R, et al. Recent progress in the study of Artemisiae Scopariae Herba (Yin Chen), a promising medicinal herb for liver diseases[J]. Biomed Pharmacother, 2020, 130: 110513.
[69] GENG C A, YANG T H, HUANG X Y, et al. Anti-hepatitis B virus effects of the traditional Chinese herb Artemisia capillaris and its active enynes[J]. Journal of Ethnopharmacology, 2018, 224: 283-289.
[70] 秦晓波. 天然多糖类活性物质抗乙肝病毒的研究进展[J]. 世界最新医学信息文摘, 2017, 17(20): 25-26.
[71] ZHAO Y M, YANG J M, LIU Y H, et al. Ultrasound assisted extraction of polysaccharides from Lentinus edodes and its anti-hepatitis B activity in vitro[J]. International Journal of Biological Macromolecules, 2018, 107: 2217-2223.
[72] 劉小燕, 李朝品, 王克霞, 等. 中国圆田螺多糖体内抗鸭乙肝病毒作用的研究[J]. 中国病原生物学杂志, 2014, 9(12): 1104-1107.
[73] 陈继岩. 羧甲基茯苓多糖抗乙型肝炎病毒的体内与体外研究[J]. 中国生化药物杂志, 2015, 35(2): 66-70.
[74] 蒙明瑜, 黄仁彬, 梁 红. 剑叶耳草多糖对乙型肝炎病毒的抑制作用及其机制研究[J]. 中药药理与临床, 2019, 35(4): 38-43.
[75] 张 玲, 王丽娟. 猪苓多糖穴位注射配合恩替卡韦治疗慢性乙型肝炎23例疗效观察[J]. 内蒙古中医药, 2016, 35(8): 103.
(本文编辑 苏 维)

