氯化胆碱对大肠杆菌发酵生产L-酪氨酸的影响
李长庚,赵思宇,李旭,赵春光,徐庆阳,3,4*
(1.天津科技大学 生物工程学院,天津 300457;2.宁夏伊品生物科技股份有限公司,银川 750100;3.代谢控制发酵技术国家地方联合工程实验室,天津 300457;4.天津市氨基酸高效绿色制造工程实验室,天津 300457)
L-酪氨酸(L-tyrosine)是一种条件必需氨基酸,在动物及人体的新陈代谢和生长发育中起重要作用,广泛应用于医药、食品、化工等行业[1-5]。随着对酪氨酸功能开发研究的逐渐深入,其市场需求仍在不断扩大。当前工业化生产L-酪氨酸的方式主要为提取法、酶催化法、化学法及生物发酵法[6],而利用代谢工程改造的大肠杆菌以葡萄糖为原料的生物发酵法具备成本低、生产周期较短、环境污染相对较小等优点适合工业化生产,成为目前最具潜力的大规模工业化生产L-酪氨酸的方式之一。但目前此方法生产L-酪氨酸依然存在产量和糖酸转化率偏低及副产物较多等问题,这些问题亟待解决。
探究合适的发酵培养基配方且对发酵工艺进行优化是提升大肠杆菌发酵能力的有效方法之一[7]。而胆碱类物质是磷脂、卵磷脂合成过程中的前体物,在调节细胞生命活动中起到非常重要的作用[8-9]。研究表明,提供适量的氯化胆碱有利于菌体细胞膜的合成,可提高菌体生长速率[10];氯化胆碱作为甲基供体能够在菌体代谢中的多种甲基化反应中提供所需的活性甲基,进而提高菌体活力,利于产酸[11]。因此,本试验以氯化胆碱作为优化因素,以达到提升大肠杆菌L-酪氨酸发酵能力的目标。
本研究探究了发酵培养基中氯化胆碱的最佳添加量,并在此基础上探究不同的添加方式对发酵能力的影响,从中选定最佳添加方式为全营养流加,并对此进行工艺优化。优化后的菌体量、L-酪氨酸产量及转化率得到不同程度的提升,且副产物的积累也大幅度降低,为今后大肠杆菌工业发酵生产L-酪氨酸提供了一定的参考依据。
1 材料与方法
1.1 材料与试剂
1.1.1 菌种
大肠杆菌TYR-05(PT7-aroGfbr+PT7-tyrAfbrtyrB+PxylF-T7RNAP+ΔpheLA):天津科技大学代谢工程实验室保藏菌种。
1.1.2 培养基
斜面培养基:酵母浸出粉5 g/L,氯化钠2.5 g/L,KH2PO41.0 g/L,MgSO40.2 g/L,牛肉膏10 g/L,琼脂粉25 g/L,葡萄糖1 g/L,蛋白胨10 g/L,pH 7.0~7.2,121 ℃湿热灭菌20 min。
种子培养基:葡萄糖30 g/L,微量元素混合液1 mL/L,柠檬酸钠 2.0 g/L,酵母粉5 g/L,MgSO4·7H2O 2 g/L,KH2PO43.0 g/L,蛋白胨2.0 g/L,(NH4)2SO44.0 g/L,FeSO4·7H2O 5 mg/L,MnSO4·H2O 1.2 mg/L,VH1 mg/L,VB混合液 0.5 mg/L,微量元素混合液 1 mL/L,pH 7.0~7.2,115 ℃湿热灭菌15 min。
发酵培养基:葡萄糖10 g/L,柠檬酸钠 2.0 g/L,FeSO4·7H2O 30 mg/L,酵母粉5.0 g/L,(NH4)2SO45.0 g/L,KH2PO4·3H2O 4.0 g/L,MgSO4·7H2O 2.0 g/L,MnSO4·H2O 10 mg/L,VH1 mg/L,VB混合液 0.5 mg/L,微量元素混合液 1.5 mL/L,pH 7.0~7.2,115 ℃湿热灭菌15 min。
1.1.3 试剂
MgSO4·7H2O、FeSO4·7H2O、(NH4)2SO4、KH2PO4、MnSO4·H2O(均为分析纯):天津市光复科技发展有限公司;蛋白胨、酵母粉(均为生化试剂):英国Thermo Fisher Oxoid公司;NaCl(分析纯):天津市登峰化学试剂厂;一水合葡萄糖(食品级):天津金汇太亚化学试剂有限公司;柠檬酸钠(分析纯):上海阿拉丁生化科技股份有限公司;谷氨酸(分析纯):天津希恩思生化科技有限公司;氯化胆碱、酪氨酸(均为分析纯):上海麦克林生化科技有限公司;乙酸(色谱级)、乙腈(色谱纯):国药集团化学试剂有限公司。
1.2 仪器与设备
UV1800系列紫外分光光度计 上海菁华科技仪器有限公司;TG16-W高速台式离心机 湖南湘仪实验室仪器开发有限公司;SBA-40E 生物传感分析仪 山东省科学院生物研究所;YXQ-LB-100SⅡ立式压力蒸汽灭菌器 上海博迅医疗生物仪器股份有限公司;5 L机械搅拌发酵罐 上海保兴生物设备工程有限公司;JADE-PAK®ODS-AQ C18高效液相色谱柱(250 mm×4.6 mm,5 μm) 广州太玮生物科技有限公司;LC-UV100液相色谱仪 上海伍丰科学仪器有限公司;
1.3 方法
1.3.1 菌种培养与发酵
取试验菌株大肠杆菌TYR-05划线接种于活化斜面,37 ℃培养12 h后转接至茄形瓶中继续培养12 h;取适量无菌水于茄形瓶中,将菌液接入含种子培养基的发酵罐中继续培养,pH维持在7.0~7.2,温度恒定在37 ℃,溶氧在30%~50%;待种子菌体量(OD600 nm)达到25左右时,按照20%接种量将种子液接入新鲜的发酵培养基中,定容至3 L。发酵过程中pH控制在7.0~7.2,温度维持在37 ℃,溶氧在30%~60%,每2 h取1~3 mL发酵液进行测定,pH通过蠕动泵流加氨水维持。
1.3.2 试验方法
1.3.2.1 氯化胆碱添加浓度优化试验
在不同批次发酵培养基底物中分别添加浓度为0,0.2,0.4,0.6 g/L的氯化胆碱进行5 L发酵罐试验,确定最佳的浓度。
1.3.2.2 氯化胆碱添加方式优化试验
氯化胆碱的添加方式见表1。

表1 氯化胆碱的添加方式Table 1 Addition methods of choline chloride
1.3.2.3 氯化胆碱全营养流加工艺优化试验
氯化胆碱在底物培养基与流加培养基中比例优化试验见表2,氯化胆碱的流加时间与流加速度优化试验见表3。

表2 氯化胆碱在底物培养基与流加培养基中比例优化试验Table 2 Optimization test of choline chloride ratio in substrate medium and fed-batch medium

表3 氯化胆碱的流加时间与流加速度优化试验Table 3 Optimization test of feeding time and feeding speed of choline chloride
1.3.3 检测方法
发酵过程中pH、温度、溶氧、罐压、通风量、菌体量、残糖的测定方法见参考文献[12]。
L-酪氨酸浓度的测定:将发酵液进行适当倍数的稀释以使L-酪氨酸晶体全部溶解,以13 000 r/min离心2 min,再用去离子水将上清液稀释至一定倍数,经0.22 μm微孔滤膜过滤后用高效液相色谱仪(HPLC)进行检测。色谱条件:JADE-PAK®ODS-AQ C18高效液相色谱柱(250 mm×4.6 mm,5 μm),流动相为10%乙腈溶液,流速为1.0 mL/min,柱温为30 ℃,保留时间为12 min,紫外检测波长为230 nm[13]。
1.3.4 糖酸转化率的计算
糖酸转化率的计算见参考文献[14]。
1.3.5 乙酸等副产物的测定
乙酸的检测见参考文献[15],谷氨酸的检测见参考文献[16]。
2 结果与分析
2.1 氯化胆碱浓度对发酵能力的影响
在原发酵培养基中分别添加浓度为0,0.2,0.4,0.6 g/L的氯化胆碱,并以0 g/L的发酵组作为空白组,探究添加不同浓度的氯化胆碱对大肠杆菌发酵生产L-酪氨酸的影响。
2.1.1 氯化胆碱浓度对菌体生长与L-酪氨酸产量的影响
由图1可知,随着氯化胆碱添加浓度逐渐增加,发酵前期的生长速率也随之加快,且进入菌体稳定期的时间缩短,当培养基中氯化胆碱添加量大于0.4 g/L时,菌体生长速率提升不明显,最大菌体量也随添加浓度的增加而提高。当氯化胆碱浓度为0.6 g/L时达最高,此时OD600 nm为86.6,较空白组提升了14.55%;随着底物中氯化胆碱添加浓度逐渐增加,L-酪氨酸的最终产量也随之增长,当添加量为0.6 g/L时达最高产量50.5 g/L,较空白组提高了7.91%。

图1 氯化胆碱添加浓度对菌体量和L-酪氨酸产量的影响Fig.1 Effect of choline chloride addition concetration on biomass and L-tyrosine yield
2.1.2 氯化胆碱浓度对副产物与糖酸转化率的影响
乙酸和谷氨酸都是大肠杆菌有氧发酵中常见的副产物,其中乙酸的积累不仅会限制菌体的生长[17-18],而且会抑制产物的合成[19],但蛋氨酸可以有效缓解乙酸积累对大肠杆菌的抑制作用[20],乙酸与谷氨酸的形成仍会造成碳源的流失进而降低糖酸转化率[21]。
由图2可知,随着氯化胆碱添加浓度的提高,乙酸及谷氨酸的产量均呈上升趋势,添加0.6 g/L氯化胆碱组最高,较空白对照组分别提高了53.23%、48.57%;糖酸转化率随氯化胆碱添加浓度的增加呈下降趋势,0.2 g/L组、0.4 g/L组与0.6 g/L组较空白对照组分别下降了1.54%、2.32%、6.79%,其中0.6 g/L组下降幅度较大。

图2 氯化胆碱添加量对副产物量与糖酸转化率的影响Fig.2 Effect of choline chloride addition amount on the yied of by-products and sugar-acid conversion rate
以上试验结果显示,当氯化胆碱添加浓度为0.4,0.6 g/L时,对L-酪氨酸最终产量及菌体生长均有较明显的促进作用,但两组之间影响效果差异较小;除此之外,随着氯化胆碱添加浓度的增加,乙酸等副产物增多,糖酸转化率随之下降,但0.4 g/L组下降趋势较小,此时糖酸转化率比0.6 g/L组高4.8%。故选择氯化胆碱的最佳添加浓度为0.4 g/L,此时L-酪氨酸终产量和最大菌体量较空白组分别提升了6.2%、13.36%。
2.2 氯化胆碱的添加方式对L-酪氨酸发酵生产的影响
本部分试验以2.1中底物添加0.4 g/L氯化胆碱浓度发酵组为对照组(对应图3与图4中A组),探究氯化胆碱的添加方式对L-酪氨酸发酵的影响。
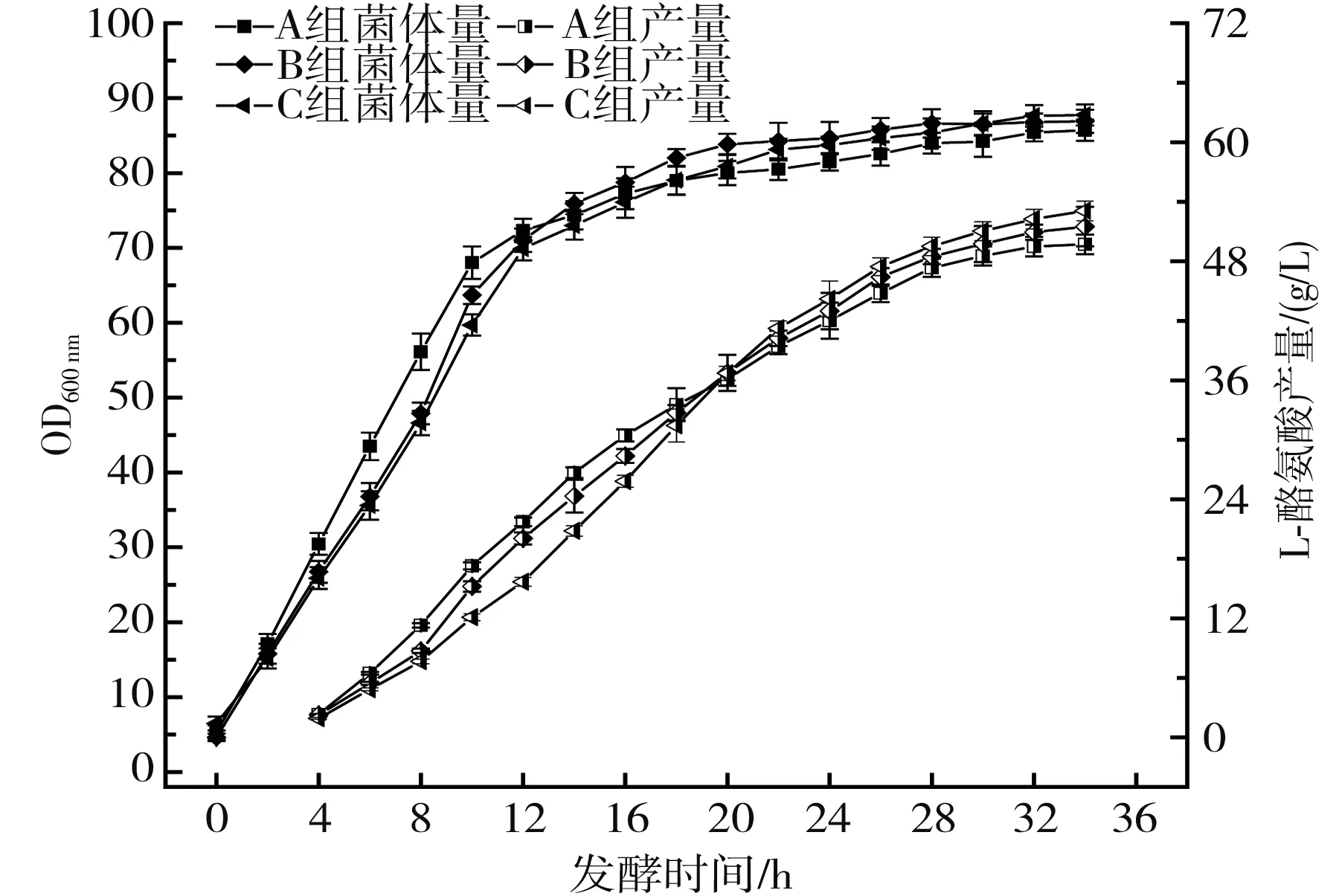
图3 氯化胆碱添加方式对L-酪氨酸发酵生产的影响Fig.3 Effect of choline chloride addition methods on L-tyrosine fermentation production

图4 氯化胆碱添加方式对副产物产量和糖酸转化率的影响Fig.4 Effect of choline chloride addition methods on the yield and sugar-acid conversion rate of by-products
由图3和图4可知,添加方式A组由于在底物培养基中一次性加入了全部量氯化胆碱,使得原体系中的营养充足,菌体在前10 h生物量的增长速度最快,但是随着发酵的进行,方式A组的弊端逐渐显露,后期由于氯化胆碱的缺乏,菌体无法保持前期的生长态势。添加方式B组的结果显示在补料添加后的4 h内,菌体量增长速度有一定程度的提升,随后涨幅逐渐下降,最高的OD600 nm和产量分别为86.90,51.50 g/L,较方式A组分别提高了1.4%和3.6%。添加方式C组使得整个发酵周期内菌体所需的氯化胆碱都处于一个相对稳定的水平,在第20 h达到菌体量稳定期,较A组延长了4 h,从最终的结果来看,添加方式C组展现出了持续流加的优势,最终的菌体生物量(OD600 nm)为88.98,较方式A组和方式B组分别提高了3.82%和2.39%,最终的L-酪氨酸产量为53.08 g/L,较方式A组和方式B组分别提高了6.79%和3.06%,除此之外,添加方式C组有效降低了乙酸和谷氨酸等副产物的产量,较方式A组分别降低了29.8%、26.7%,随着糖酸转化率的增加有所提高,较方式A组提升了4.58%。
2.3 氯化胆碱全营养流加工艺优化试验
全营养流加工艺[22]是将传统分批补料发酵工艺中全部的发酵培养基分成两部分:一部分直接投入罐内,为发酵初期提供营养物质;另一部分单独分装,在发酵过程中按需流加,为不同生长阶段的菌体提供最适的营养物质浓度。
2.3.1 底物与流加培养基中氯化胆碱添加比例对L-酪氨酸发酵生产的影响
本部分研究以2.2中添加方式C(底物添加∶流加添加为2∶8)发酵组为对照组。由图5和图6可知,C组菌体前期生长受到明显的抑制,生长速度低于其余3组,但在18 h时,仍保持着一定活力,于第20 h达到菌体稳定期;E组、F组在发酵前期的菌体生长和产量增长曲线与D组基本类似,说明底物中30%的氯化胆碱达到菌体发酵前期需求的临界值,随着流加培养基的持续流入,发酵后半程依旧处于营养过饱和状态,从而导致乙酸等副产物产量增高,糖酸转化率降低,并不能发挥出流加的优势;D组氯化胆碱的分配接近亚适量状态,即最大程度利用营养物质,在各个发酵时期恰好够支撑菌体生长,保持菌体活力。D组最终L-酪氨酸产量及最大菌体量(OD600 nm)分别为54.30 g/L、92.15,较对照组分别提高了2.3%、3.6%;副产物乙酸及谷氨酸分别为0.9,2.2 g/L,较对照组分别降低了25%、33%;此时糖酸转化率达到最高,为23.2%,较对照组提升了1.5%。

图5 底物与流加培养基中氯化胆碱不同的添加比例对L-酪氨酸发酵生产的影响Fig.5 Effect of different addition ratios of choline chloride in substrate medium and fed-batch medium on the fermentation production of L-tyrosine

图6 底物与流加培养基中氯化胆碱不同的添加比例对副产物产量和糖酸转化率的影响Fig.6 Effect of different addition ratios of choline chloride in substrate medium and fed-batch medium on the yield of by-products and sugar-acid conversion rate
2.3.2 流加培养基流加持续时间及各阶段流加速度对L-酪氨酸发酵生产的影响
以2.3.1中D组(对应表3中恒速流加至发酵末期)为对照组,进一步对全营养流加工艺进行优化。
由表4可知,G组是将总量70%的氯化胆碱以恒速流加至菌体稳定期,菌体量和产量与对照组相比无明显差异,但最终副产物乙酸及谷氨酸产量较对照组分别提升了8.7%、18.2%;糖酸转化率下降了2.6%。H组随菌体生长速度提高流加速度是指在葡萄糖亚适量[23]状态下,始终保持稳定的低溶氧(dissolved oxygen,DO)变速流加。H组最大菌体量为98.32,较对照组提高了6.7%,但L-酪氨酸产量提升不明显,副产物也大量积累,乙酸和谷氨酸产量较对照组分别提升了30.4%、27.3%,糖酸转化率下降了2.6%。I组营养物质亚适量流加是指在葡萄糖亚适量状态下,当DO缓慢上升时,提高补糖速率,DO未见明显下降,此时流加营养物质,DO迅速下降,即认为此时为营养亚适量状态[16],应提高流加培养基流加速度。I组最终L-酪氨酸产量达到55.7 g/L,较对照组提高了2.6%,最大菌体量(OD600 nm)为95.15,较对照组增长了3.3%,副产物乙酸及谷氨酸产量较对照组分别降低了65.2%、29.1%,糖酸转化率提高了3.9%,为本优化试验最佳方案。
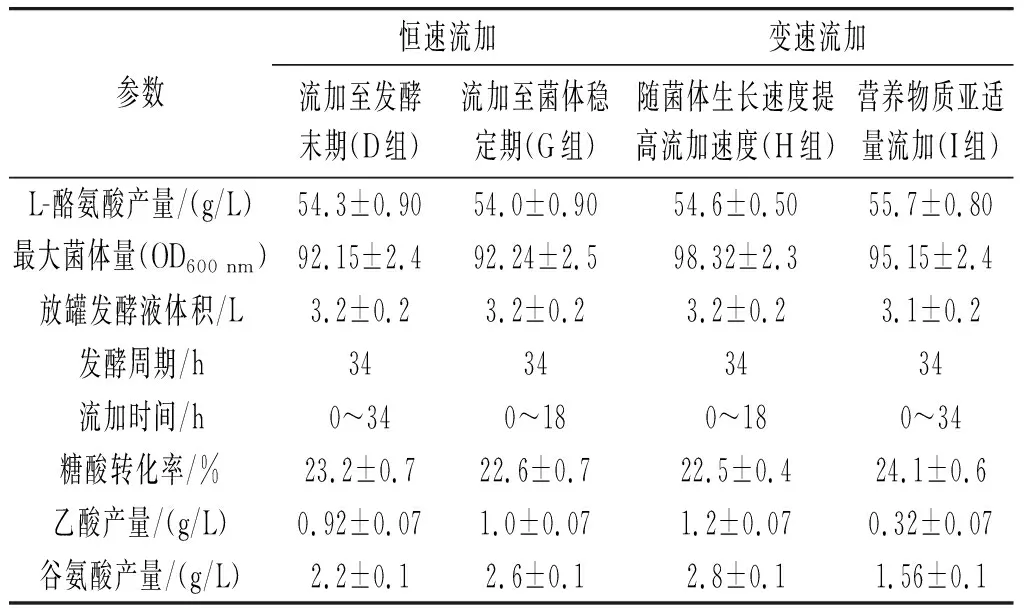
表4 流加培养基流加持续时间及各阶段流加速度对L-酪氨酸发酵生产的影响Table 4 Effect of feeding duration time of fed-batch medium and feeding speed at each stage on the fermentation production of L-tyrosine
3 结论
本文通过探究不同浓度的氯化胆碱对L-酪氨酸发酵生产的影响,发现适量添加氯化胆碱能够有效加快菌体生长,提高菌体产酸能力,并且确定了氯化胆碱的最适添加浓度为0.4 g/L,在此基础上探究不同的添加方式对发酵能力的影响,得出全营养流加工艺具有一定发酵优势,并对该工艺进一步优化,最终确定了底物与流加培养基中氯化胆碱的添加比例为3∶7,流加培养基的流加速度随罐内溶氧值的波动而变化,以维持营养物质亚适量状态的全营养流加工艺。优化后的最大菌体量(OD600 nm)、L-酪氨酸产量及糖酸转化率分别达到了95.15、55.7 g/L、24.1%,较优化前分别提升了25.9%、19.0%、7.7%;副产物乙酸和谷氨酸产量分别为0.32,1.56 g/L,较优化前分别降低了74.2%、55.4%。本研究所确定的新发酵工艺与原发酵策略相比,不仅实现了最大菌体量、L-酪氨酸产量及糖酸转化率不同程度的提升,且大幅降低了副产物谷氨酸、乙酸的积累,为今后工业化发酵生产L-酪氨酸提供了一定的参考依据。

