紫皮大蒜多酚分离纯化及体外降血糖活性研究
李琳琳,王乐,尹卫,代爽,刘晓军,梁健,王煜伟*
(1.青海大学省部共建三江源生态与高原农牧业国家重点实验室,西宁 810016;2.浙江清华长三角研究院,浙江 嘉兴 314006)
大蒜(AlliumsativumL.)是百合科葱属植物,具有悠久的应用历史,被誉为天然的“药用植物黄金”,是一种世界上广泛种植的蔬菜种类之一[1]。大蒜中含有丰富的活性成分,如含硫化合物、挥发油、氨基酸、多糖、维生素、皂苷类化合物、多酚类化合物、黄酮类化合物、生物活性酶及微量元素等[2-4]。这些活性成分具有抗氧化、防治心血管疾病、抗肿瘤、降血脂等作用[5-7]。
多酚类化合物是果蔬中最重要的植物次生代谢产物之一[8]。多酚类化合物是天然的还原性物质,具有抗氧化、抗炎杀菌、抗肿瘤和抑制心血管疾病等多种生理功能[9-13]。其中大蒜多酚类化合物还有没食子酸、绿原酸、阿魏酸、芹菜素、鞣花酸、儿茶素、香豆酸、槲皮素和山奈酚等[14]。植物中多酚可以起到降血糖的作用[15-17],其能改善机体的胰岛素功能和提高生物体的氧化还原作用。现有研究表明,多酚提取物可抑制α-葡萄糖苷酶和α-淀粉酶的活性,从而降低人体的血糖水平[18-20]。
多酚类化合物的分离纯化在多种植物中已有研究报道,但是紫皮大蒜中多酚化合物的分离纯化研究报道相对较少。本研究基于此,采用微波辅助溶剂提取法提取紫皮大蒜中的多酚物质,用XDA-7大孔树脂对提取的紫皮大蒜多酚进行纯化,以阿卡波糖为阳性对照组,研究了紫皮大蒜多酚对α-葡萄糖苷酶、α-淀粉酶的抑制活性。通过增加紫皮大蒜多酚提取物的含量,促进紫皮大蒜酚类化合物的开发和使用,应用于紫皮大蒜深加工技术,为提高农产品和副产品的综合利用提供了参考。
1 材料与设备
1.1 材料与试剂
1.1.1 材料
大蒜样品为课题组种植于青海乐都的葱科葱属紫皮大蒜。
1.1.2 试剂
没食子酸:天津市科密欧化学试剂有限公司;福林酚试剂:北京索莱宝科技有限公司;XDA-7大孔树脂、α-葡萄糖苷酶、α-淀粉酶、脂肪酶、阿卡波糖、奥利司他:上海源叶生物科技有限公司;对硝基苯基-β-D-吡喃葡萄糖苷(4-Nitrophenyl-β-D-glucopyranoside,PNPG):上海宝曼生物科技有限公司;其他试剂均为市售分析纯。
1.2 仪器与设备
AL204电子天平 梅特勒-托利多仪器有限公司;JP-060S超声波清洗机 深圳市洁盟清洗设备有限公司;DK-8D三孔电热恒温水槽 上海一恒科学仪器有限公司;赛默飞Varioskan LUX多功能酶标仪 北京昊诺斯科技有限公司;梅特勒FE28-Standard pH酸度计 上海右一仪器有限公司;NRY-2102C恒温振荡摇床 上海南荣实验室设备有限公司。
2 试验方法
2.1 紫皮大蒜多酚含量测定
没食子酸标准曲线的测定:精准量取0.0,1.0,2.0,3.0,4.0,5.0 mL质量浓度为100 μg/mL的没食子酸标准储备液于6个25 mL容量瓶中,加入2.0 mL福林酚试剂静置5 min,加入2.0 mL质量分数为10%的Na2CO3溶液,摇匀后静置6 min,用蒸馏水定容后在25 ℃的恒温水浴锅中加热显色60 min,以试剂空白作参比,于760 nm处测定吸光值,以没食子酸质量浓度X(μg/mL)为横坐标,吸光值Y为纵坐标,绘制标准曲线,得到标准曲线方程:Y=0.104 2X-0.061 9,R2=0.999 2。
多酚提取量(mg/g)=(C×N×V)/M。
式中:C为样品浓度(mg/mL),N为稀释倍数,V为待测液体积(mL),M为样品质量(g)。
2.2 单因素试验
2.2.1 乙醇体积分数对紫皮大蒜多酚提取量的影响
称取紫皮大蒜样品2.0 g,在提取温度30 ℃、料液比1∶10(g/mL)、提取时间60 min的条件下,研究20%、40%、60%、80%、100%的乙醇体积分数对紫皮大蒜中多酚提取量的影响。
2.2.2 提取温度对紫皮大蒜多酚提取量的影响
称取紫皮大蒜样品2.0 g,在提取时间60 min、乙醇体积分数60%、料液比1∶10(g/mL)的条件下,研究20,30,40,50,60 ℃的提取温度对紫皮大蒜中多酚提取量的影响。
2.2.3 提取时间对紫皮大蒜多酚提取量的影响
称取紫皮大蒜样品2.0 g,在提取温度30 ℃、乙醇体积分数60%、料液比1∶10(g/mL)的条件下,研究10,20,40,60,80 min的提取时间对紫皮大蒜中多酚提取量的影响。
2.2.4 料液比对紫皮大蒜多酚提取量的影响
称取紫皮大蒜样品2.0 g,在提取温度30 ℃、提取时间60 min、乙醇体积分数60%的条件下,研究1∶3、1∶5、1∶10、1∶15、1∶20(g/mL)的料液比对紫皮大蒜中多酚提取量的影响。
2.3 正交试验
在单因素试验的基础上设计正交试验,以乙醇体积分数(A)、提取温度(B)、提取时间(C)、料液比(D)作为4个变量因素,以紫皮大蒜多酚提取量为指标,采用L9(34)正交表,并分析结果范围,进一步优化提取紫皮大蒜多酚的工艺条件,见表1。

表1 正交试验因素水平Table 1 Factors and levels of orthogonal test
2.4 纯化试验
2.4.1 XDA-7树脂预处理
将XDA-7树脂先用去离子水冲洗,除去破碎的树脂,在2倍量的95%乙醇中浸泡24 h后用去离子水重复清洗,除去乙醇,然后改用酸碱处理,将XDA-7树脂浸入5% HCl溶液中24 h后用去离子水清洗直至pH变为中性,然后浸入5% NaOH溶液中24 h后用去离子水清洗直至pH变为中性,最后在去离子水中进行储备。
2.4.2 XDA-7树脂静态吸附和解吸曲线
称取15 g XDA-7大孔树脂于三角瓶中,加入45 mL紫皮大蒜多酚粗提液,在100 r/min的频率下摇床振荡3 h,每隔1 h测定一次紫皮大蒜多酚浓度,并绘制静态吸附曲线;吸附结束后过滤,去除吸附液,将已吸附饱和的XDA-7树脂置于三角瓶中,加入60 mL的 60%乙醇溶液,在100 r/min的频率下摇床振荡3 h,每隔1 h测定一次紫皮大蒜多酚浓度,并绘制静态解吸曲线。
2.4.3 吸附与解吸单因素试验
2.4.3.1 大蒜多酚浓度对紫皮大蒜多酚纯化的影响
称取XDA-7树脂30 g,在乙醇体积分数60%、解吸液pH为4的条件下,考察大蒜多酚浓度0.5,1.0,1.5,2.0,2.5 mg/mL对紫皮大蒜多酚纯化的影响。
2.4.3.2 乙醇体积分数对紫皮大蒜多酚纯化的影响
称取XDA-7树脂30 g,在大蒜多酚浓度2 mg/mL、解吸液pH为4的条件下,考察乙醇体积分数15%、30%、60%、75%、90%对紫皮大蒜多酚纯化的影响。
2.4.3.3 解吸液pH对紫皮大蒜多酚纯化的影响
称取XDA-7树脂30 g,在乙醇体积分数60%,大蒜多酚浓度2 mg/mL的条件下,考察解吸液的pH 1,2,3,4,5,6,7对紫皮大蒜多酚纯化的影响。
2.5 降血糖活性试验
2.5.1 紫皮大蒜多酚对α-淀粉酶的抑制作用
将0.25 mL的样品溶液与0.25 mL的1 U/mLα-淀粉酶溶液混合,在37 ℃下预热10 min,加入0.5 mL的0.1 g/mL底物溶液预热10 min,放回37 ℃培养箱中孵化3 min,然后加入0.5 mL DNS显色剂,混匀后沸水浴加热8 min,冷却至室温。用超纯水稀释至5 mL后在540 nm处测定吸光值,每个样品重复3次。以超纯水作为空白对照组,以阿卡波糖作为阳性对照组。
抑制率(%)=[1-(A1-A2)/(A3-A4)]×100。
式中:A1为样品组的吸光值,A2为样品不加酶的吸光值,A3为空白对照组的吸光值,A4为空白对照不加酶的吸光值。
2.5.2 紫皮大蒜多酚对α-葡萄糖苷酶的抑制作用
在1 mL离心管中,依次加入磷酸缓冲液、抑制剂溶液和底物并混合均匀,在37 ℃培养箱中保温10 min,结束后加入酶溶液,在37 ℃培养箱中反应20 min,加入200 μL的Na2CO3溶液终止反应,取200 μL反应液于96孔板中,在405 nm处测吸光值。以不加抑制剂和酶溶液作为空白组,不加抑制剂溶液作为对照组,不加酶溶液作为样品空白组,阿卡波糖作为阳性对照。
抑制率(%)=[1-(A4-A3)/(A2-A1)]×100。
式中:A1为空白组的吸光值,A2为对照组的吸光值,A3为样品空白组的吸光值,A4为样品组的吸光值。
3 结果与分析
3.1 单因素试验结果
3.1.1 乙醇体积分数对紫皮大蒜多酚提取量的影响
由图1可知,当以不同体积分数的乙醇提取大蒜多酚时,大蒜多酚提取量呈现先上升后下降的趋势,在体积分数为60%时达到最高值2.12 mg/g,是最低值的2.03倍,差异显著(P<0.05)。因此,选择最佳乙醇体积分数为60%。这可能是因为大蒜多酚在乙醇溶液中的溶解度随乙醇体积分数的升高而逐渐增加,当乙醇体积分数达到80%以上时,由于提取液中除多酚外的其他杂质逐渐增多导致溶液的通透性变差,无法准确测量其中的多酚含量。
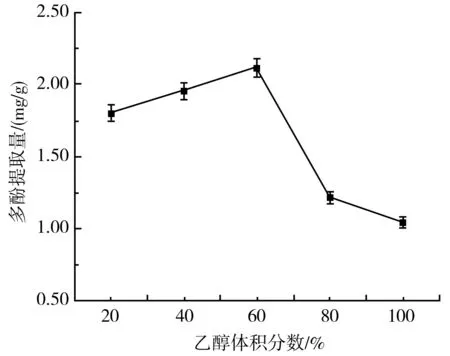
图1 乙醇体积分数对紫皮大蒜多酚提取量的影响Fig.1 Effect of ethanol volume fraction on the extraction amount of polyphenols from purple-skin garlic
3.1.2 提取温度对紫皮大蒜多酚提取量的影响
由图2可知,大蒜多酚提取量在提取温度为30 ℃时最高,达到0.94 mg/g,相对于20 ℃时的多酚提取量提高了1.58倍,差异显著(P<0.05)。因此,选择最佳提取温度为30 ℃。可能的原因是紫皮大蒜中各物质之间的氢键和疏水键被温度上升所产生的大量热能破坏,致使大量多酚物质扩散出来;提取温度达到30 ℃以后,紫皮大蒜中多酚提取量的下降可能与多酚的热稳定性或者多酚氧化酶催化作用的加强有关。

图2 提取温度对紫皮大蒜多酚提取量的影响Fig.2 Effect of extraction temperature on the extraction amount of polyphenols from purple-skin garlic
3.1.3 提取时间对紫皮大蒜多酚提取量的影响
由图3可知,提取时间不同时,大蒜多酚提取量在40 min时最高,达到2.49 mg/g,相比于80 min时的多酚提取量提高了2.63倍,差异显著(P<0.05)。因此,选取最佳提取时间为40 min。可能的原因是紫皮大蒜中多酚物质的溶解程度随着时间的增加而逐渐增强,在40 min时达到峰值,已接近于饱和,再继续增加提取时间,多酚物质会受光照、高温、多酚氧化酶等外界因素的影响而氧化。因此,40 min后多酚提取量反而随着时间的延长而下降。

图3 提取时间对紫皮大蒜多酚提取量的影响Fig.3 Effect of extraction time on the extraction amount of polyphenols from purple-skin garlic
3.1.4 料液比对紫皮大蒜多酚提取量的影响
由图4可知,不同的料液比提取多酚时,多酚提取量呈先升高后低降的趋势,在料液比为1∶5时最高,达到2.55 mg/g,相对于1∶20时的多酚提取量提高了1.41倍,差异显著(P<0.05)。因此,选择最佳料液比为1∶5。可能是因为随着溶剂量的增加,紫皮大蒜中的多酚物质在提取液中的溶解度逐渐降低。

图4 料液比对紫皮大蒜多酚提取量的影响Fig.4 Effect of solid-liquid ratio on the extraction amount of polyphenols from purple-skin garlic
3.2 紫皮大蒜多酚提取工艺正交试验
在单因素试验的基础上通过正交试验对提取工艺进行优化,研究乙醇体积分数、提取温度、提取时间和料液比对紫皮大蒜多酚提取量的影响。以单因素试验结果作为试验数据范围,以乙醇体积分数、提取温度、提取时间、料液比作为考察因素,以多酚提取量作为指标,正交试验设计及结果见表2。

表2 正交试验设计及结果Table 2 Orthogonal test design and results
由表2可知,多酚作为极性有机溶剂,在萃取过程中,受到提取剂浓度、提取时间、提取温度、料液比等各种外界条件的影响。通过紫皮大蒜中多酚物质提取的正交试验结果分析可知,4个因素对紫皮大蒜多酚提取量的影响主次顺序为提取时间(C)>提取温度(B)>乙醇体积分数(A)>料液比(D)。其中提取时间对紫皮大蒜多酚提取量的影响最大,料液比对紫皮大蒜多酚提取量的影响最小,优化后的最优组合为A2B2C2D2,即乙醇体积分数60%、提取温度30 ℃、提取时间40 min、料液比1∶5。在此条件下紫皮大蒜多酚提取量最高,为2.92 mg/g。
3.3 纯化试验
3.3.1 XDA-7树脂静态吸附和解吸曲线
由图5可知,XDA-7树脂对紫皮大蒜多酚物质的吸附呈现先升高后降低的趋势,在接近120 min时,吸附作用逐渐平缓并趋于饱和,因此,吸附时间选择120 min为宜。

图5 吸附曲线Fig.5 Adsorption curve
由图6可知,XDA-7树脂对紫皮大蒜多酚物质的解吸呈现先增加后平缓的趋势,在60 min之后,紫皮大蒜多酚物质基本完全解离,因此,解吸时间选择60 min为宜。
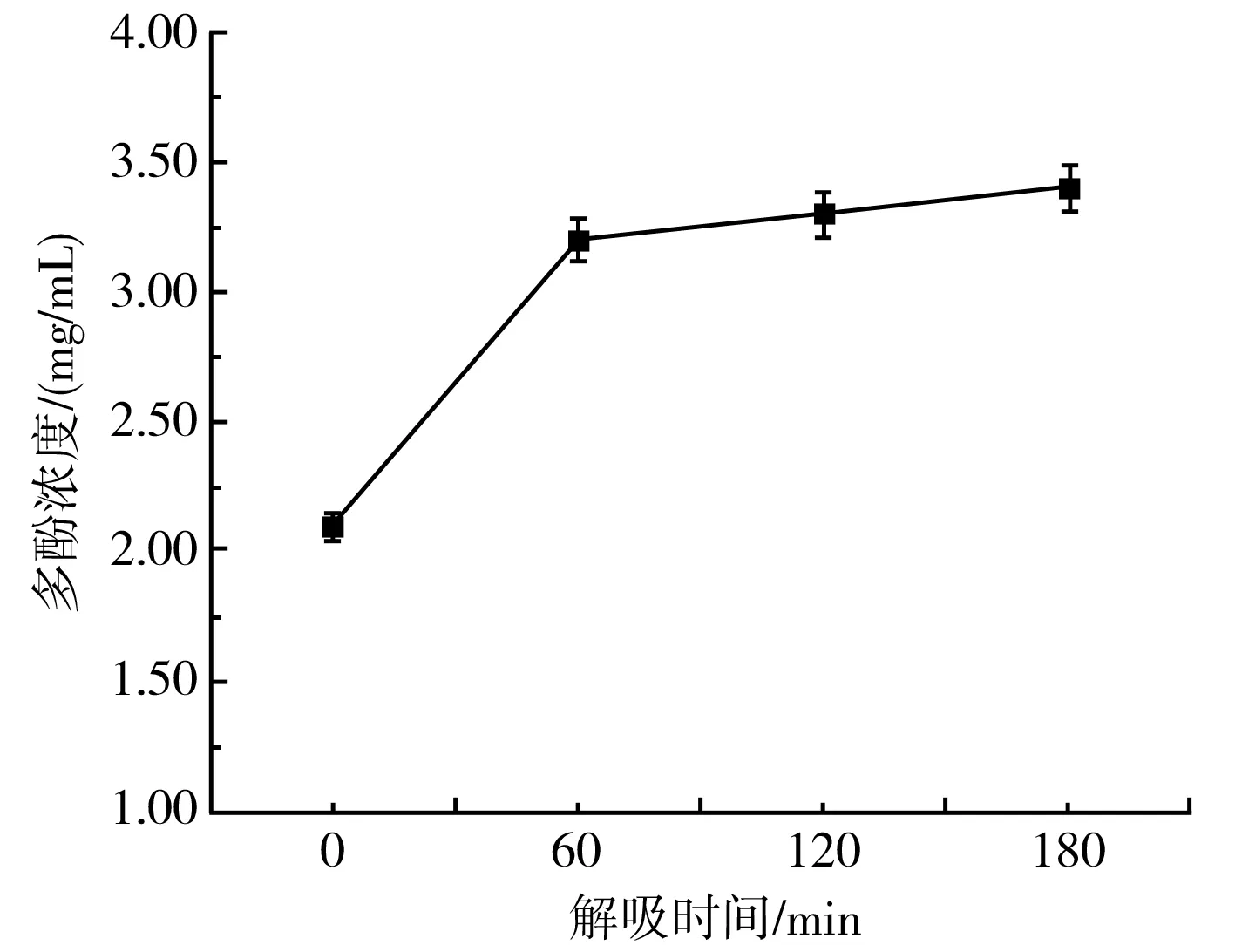
图6 解吸曲线Fig.6 Desorption curve
3.3.2 吸附与解吸单因素试验
3.3.2.1 大蒜多酚浓度对紫皮大蒜多酚纯化的影响
由图7可知,紫皮大蒜多酚浓度对树脂吸附能力具有显著影响,当紫皮大蒜多酚的浓度逐渐增加时,大孔树脂的吸附能力随之增强。由于溶液中酚类化合物浓度过高时,酚类化合物分子间相互作用,产生絮凝现象,从而阻塞树脂孔洞,不利于树脂对酚类化合物的吸附,因此,紫皮大蒜多酚浓度选择2.5 mg/mL为宜。

图7 大蒜多酚浓度对纯化紫皮大蒜多酚的影响Fig.7 Effect of garlic polyphenol concentration on the purification of purple-skin garlic polyphenols
3.3.2.2 乙醇体积分数对紫皮大蒜多酚纯化的影响
由图8可知,随着乙醇体积分数的增加,解吸量呈先增加后减少的趋势。当乙醇体积分数为60%时,解吸量最大,并且60%乙醇的极性最接近紫皮大蒜多酚。因此,解吸液选择60%的乙醇为宜。
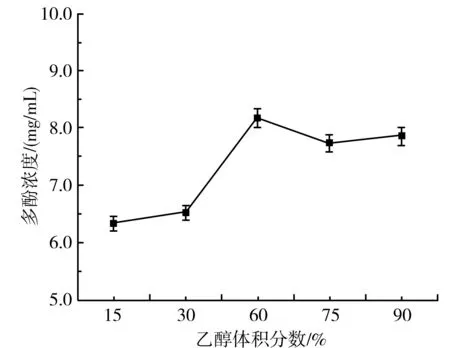
图8 解吸液浓度对纯化紫皮大蒜多酚的影响Fig.8 Effect of desorption solution concentration on the purification of purple-skin garlic polyphenols
3.3.2.3 解吸液pH对紫皮大蒜多酚纯化的影响
由图9可知,当解吸液pH为1~4时,紫皮大蒜多酚含量差别不大,而当pH为5左右时,紫皮大蒜多酚浓度明显上升。结果表明酸性环境对解吸是有利的,因为60%乙醇体积分数本身的pH值约为5,因此无需调节pH值。

图9 解吸液pH对纯化紫皮大蒜多酚的影响Fig.9 Effect of pH of desorption solution on the purification of purple-skin garlic polyphenols
3.4 紫皮大蒜多酚降血糖活性研究
3.4.1 紫皮大蒜多酚对α-淀粉酶活性的抑制作用
由图10和图11可知,随着紫皮大蒜多酚浓度和阿卡波糖浓度的增加,它们对α-淀粉酶的抑制率也逐渐增大,呈剂量-效应关系。计算得出紫皮大蒜多酚和阿卡波糖的IC50值分别为5.076 mg/mL和7.613 mg/mL。阿卡波糖是目前控制2型糖尿病的主要药物,有腹胀、肠道胀气、腹泄等副作用,还可能伴有红斑、皮疹等。这种副作用是由于过度抑制胰腺中的α-淀粉酶,导致未消化的碳水化合物在结肠中被不良的细菌发酵。相比之下,紫皮大蒜多酚对α-淀粉酶的IC50值比阿卡波糖的低,说明紫皮大蒜多酚比阿卡波糖抑制α-淀粉酶的活性更强,如果代替阿卡波糖用于治疗2型糖尿病,因为过度抑制α-淀粉酶消化而引起的副作用将可以减少。

图10 紫皮大蒜多酚对α-淀粉酶活性的抑制作用Fig.10 The inhibitory effect of purple-skin garlic polyphenols on α-amylase activity
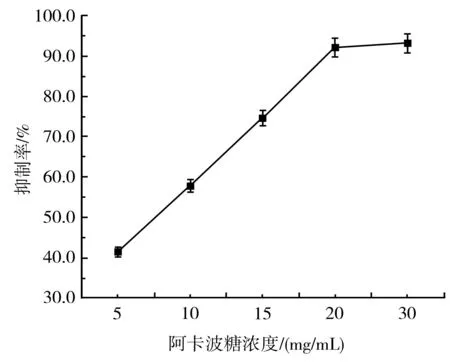
图11 阿卡波糖对α-淀粉酶活性的抑制作用Fig.11 The inhibitory effect of acarbose on α-amylase activity
3.4.2 紫皮大蒜多酚对α-葡萄糖苷酶活性的抑制作用
由图12和图13可知,随着紫皮大蒜多酚浓度和阿卡波糖浓度的增加,它们对α-葡萄糖苷酶活性的抑制作用逐渐增强。试验中,PNPG底物在α-葡萄糖苷酶的作用下释放出对硝基苯,对硝基苯在405 nm处有最大吸收峰,通过测定对硝基苯的含量变化即可确定抑制剂对酶的抑制能力。计算得出紫皮大蒜多酚和阿卡波糖对α-葡萄糖苷酶活性的半抑制浓度IC50值分别为5.501 mg/mL和8.068 mg/mL,表明紫皮大蒜多酚对α-葡萄糖苷酶有抑制作用。

图12 紫皮大蒜多酚对α-葡萄糖苷酶活性的抑制作用Fig.12 The inhibitory effect of purple-skin garlic polyphenols on α-glucosidase activity

图13 阿卡波糖对α-葡萄糖苷酶活性的抑制作用Fig.13 The inhibitory effect of acarbose on α-glucosidase activity
4 结论
紫皮大蒜多酚最佳提取工艺为乙醇体积分数60%、料液比1∶5、提取时间40 min、提取温度30 ℃,此时紫皮大蒜多酚提取量为2.92 mg/g。使用XDA-7大孔树脂进行紫皮大蒜多酚纯化试验,得到最佳纯化条件是吸附时间2 h,紫皮大蒜多酚浓度2.5 mg/mL;解吸时间1 h,解吸溶液为60%乙醇溶液,溶液的pH为5.0。最后通过验证,纯化后的紫皮大蒜多酚含量为5.32 mg/g,多酚含量提高了1.82倍。降血糖活性研究结果显示,紫皮大蒜多酚对α-淀粉酶和α-葡萄糖苷酶的半抑制浓度IC50值分别为5.076 mg/mL和5.501 mg/mL,紫皮大蒜多酚可以通过抑制α-葡萄糖苷酶和α-淀粉酶的活性从而达到降血糖的作用。

