中药草本液的体外抗菌性能检测
张桓硕,张 瑞,赵兴刚,刘 俊,林明玥,王晨鑫,李雨帆,陈 立,邹 琴*
(1.四川大学分析测试中心纳米生物材料研究中心,四川成都 610065;2.深圳蔚多科技有限公司,广东深圳 518000;3.广西蔚多科技有限公司,广西防城港 538000;4.四川大学分析测试中心,四川成都 610065)
西湖龙井草本液是以龙井提取物、薄荷脑为主要抗菌成分的中药草本液产品,其主要功能为抗菌消炎、清热解毒、利咽润喉,主要使用方式为雾化吸入。中药结合雾化技术区别于传统的闻香吸入和烟熏吸入,形成了新型给药模式,有着雾化颗粒小、易吸收、药物利用率高的特点,可以针对治疗呼吸系统炎症[1]。龙井提取物含有的茶多酚和薄荷醇2种中药材料提取物均具有广谱抗菌性能,将茶多酚与薄荷醇联合使用的抗菌机理的研究鲜见报道。为验证本草本液疗效,开展对草本液的体外抗菌活性和抗菌机理的研究。该研究选取了革兰氏阴性菌大肠杆菌(Escherichiacoli)、革兰氏阳性菌金黄色葡萄球菌(Staphylococcusaureus)和真菌白色念珠菌(Candidaalbicans)3种菌,这3种菌均为人类活动中易接触的致病菌种。大肠杆菌易导致肠道外感染,如化脓性感染或者泌尿道感染;金黄色葡萄球菌易导致化脓性感染,如毛囊炎、伤口化脓等;白色念球菌可以造成皮肤、黏膜、内脏和中枢神经系统的急、慢性感染[2]。该研究通过测定草本液对这3种菌的最小抑菌浓度(minimal inhibitory concentration、MIC)、最低杀菌浓度(minimum bactericidal concentration,MBC)来研究其抗菌效果,利用抑菌环试验、Live-Dead 荧光染色以及扫描电子显微镜试验考察草本液对3种菌的抗菌活性以及细菌表面微观结构在草本液作用前后的变化,研究天然植物中药提取物的抗菌机理。
1 材料与方法
1.1 试剂西湖龙井草本液(深圳蔚多科技有限公司);金黄色葡萄球菌(CMCC26003)、大肠杆菌(CMCC(B)44102)、白色念球菌[CMCC(F)98001]均购自上海保藏生物技术中心;营养琼脂(北京奥博星生物技术有限公司);磷酸盐缓冲液药片(phosphate buffer solution,PBS,赛默飞世尔科技有限公司);生理盐水(山东科伦药业有限公司);无水乙醇(成都市科隆化学品有限公司);扫描电镜专用固定液(北京索莱宝科技有限公司);胰蛋白胨(上海阿拉丁试剂有限公司);Live-Dead试剂盒(赛默飞世尔科技有限公司);青霉素钠(山东圣旺药业股份有限公司);冰乙酸(上海阿拉丁试剂有限公司)。
1.2 仪器扫描电子显微镜(scanning electron microscope,SEM,型号HITACH S530,日本电子株式会社);无菌工作台(型号SW-CJ-2FD,苏州净化设备有限公司);立式蒸汽灭菌锅(型号YXQ-LB-50SII,上海博迅实业有限公司);恒温培养箱(型号SPX-160B-2,上海福玛实验设备有限公司);精密电子天平(型号BT-25S,德国Sartorius AG 集团);荧光倒置显微镜(型号Eclipse TI-U,日本Nikon公司)。
1.3 试验方法
1.3.1细菌培养。称取3 g胰蛋白胨于试剂瓶中,加入100 mL蒸馏水,超声分散至溶解,得液体培养基,立式蒸汽灭菌锅灭菌(表压1.7 kg/cm2,121 ℃,30 min),冷却备用。取营养琼脂33 g,加入1 000 mL蒸馏水中,超声分散溶解,立式蒸汽灭菌锅灭菌,倒入培养皿,放凉后得固体培养基备用。取少量甘油封存的细菌接种于液体培养基中37 ℃恒温培养24 h后备用[3]。
1.3.2抑菌率测定。分别将100 μL菌液(1×104~9×104CFU/mL)加入4管5 mL草本原液(试验组)或4管5 mL生理盐水(对照组),混合均匀,分别作用2、5、10、20 min后,各取0.5 mL加入含5 mL PBS 的试管内,充分混匀后,PBS稀释102、103倍后接种于固体培养基,37 ℃培养48 h,进行活菌菌落计数。试验重复3次,按下式计算抑菌率:
式中:α为抑菌率(%);β为生理盐水对照组平均菌落数(CFU);γ为草本原液试验组平均菌落数(CFU)。
1.3.3抑菌环测定。移取100 μL菌液(1×106~1×108CFU/mL)与10 mL未凝固的固体培养基混合,倒入培养皿,分别取草本原液(试验组)、丙三醇(对照组)滴加于空白纸片5 mm圆形滤纸片若干,并置于混合细菌的固体培养基上,放37 ℃恒温培养箱24 h,拍照并计算抑菌圈直径,试验重复3次[4]。
1.3.4MIC和MBC测定。在96孔板中,每孔加入100 μL液体培养基,一列共12孔。利用对倍稀释法,在第1孔处加入100 μL草本原液后混匀,然后从第1孔用移液枪吸取100 μL混合液(草本原液浓度50%)加至第2孔后混匀,再在第2孔吸取100 μL(草本原液浓度25%)加至第3孔,混匀。如此重复稀释至第11孔,在第11孔吸取100 μL弃去,第12孔为不含样本的对照。向每孔加入100 μL菌液(0.5×106~0.5×108CFU/mL)。将96孔板置于37 ℃培养箱中培养24 h。以肉眼观察,药物浓度最低且培养基不出现浑浊,无细菌生长孔即是该菌的MIC。确认MIC后,用接种环分别蘸取包括MIC浓度孔的左右共5孔的样本并接种于固体培养基,将培养基置于37 ℃培养箱中培养24 h,用活菌计数法检查菌落数,平均数小于5个的最小稀释浓度即为该菌的MBC[5]。试验均重复3次以上。
1.3.5Live-Dead染色。在2个96孔板中将100 μL菌液分别加入100 μL草本原液(试验组)、100 μL丙三醇(阴性对照组)、100 μL冰乙酸[6](白色念珠菌阳性对照组)、100 μL青霉素钠(0.192 mg/mL,大肠杆菌和金黄色葡萄球菌阳性对照组),最终菌液浓度为5× 105~5 × 107CFU/mL。将96孔板置于37 ℃培养箱中分别培养2和5 min。避光条件下,分别将等量 Live-Dead 试剂A液和B液混合得到Live-Dead染色剂。将染色剂加入96孔板中,混匀后孵育20 min,使用荧光倒置显微镜观察并拍照。
1.3.6SEM观察。在24孔板中放入无菌圆形玻片,移取100 μL菌液(1×106~1×108CFU/mL)与100 μL草本原液样本于24孔板中,培养24 h后吸出样本菌液混合液体后,将玻片用PBS清洗1次,然后使用扫描电镜专用固定液固定1.5 h,再用梯度乙醇溶液(30%、40%、50%、60%、70%、80%、90%、95%、100%)进行脱水(其中100%乙醇脱水3次),每个梯度脱水10 min,真空干燥12 h,样品表面喷金,使用SEM观察样品表面细菌表面结构[7]。
1.4 统计学方法采用Excel 软件的T.TEST函数进行数据分析,组间比较采用独立样本t检验;以P<0.05 为差异有统计学意义。
2 结果与分析
2.1 抑菌率草本液原液对白色念珠菌、大肠杆菌和金黄色葡萄球菌菌悬液(1×104~9×104CFU/mL)不同作用时间下抑菌率如表1所示,37 ℃恒温培养48 h后,根据固体培养基上的菌落数计算出草本原液对3种菌的抑菌率,草本原液对3种菌有较强的抑制作用且原液在与菌液接触的2 min内就表现出明显的抑菌作用,不同作用时间草本液的抑菌率均大于99.9%。

表1 草本原液作用于3种菌的抑菌率
2.2 抑菌环草本液原液滴加于5 mm滤纸片作用后的白色念珠菌、大肠杆菌和金黄色葡萄球菌的抑菌环和抑菌环直径如图1所示,草本原液作用后的3种菌均出现了抑菌环(图1a~c),其直径分别为(8.1±0.5)、(8.4±0.3)、(9.9±0.3)mm,与草本原液作用有显著差异(P<0.001),草本原液与对照丙三醇作用也有显著差异(P<0.001),表明草本原液对3种菌均有抑制作用。草本液作用的金黄色葡萄球菌抑菌环显著大于白色念珠菌和大肠杆菌的抑菌环,可知草本原液对金黄色葡萄球菌的抑制作用高于对白色念珠菌和大肠杆菌的抑制作用(P<0.001)。

注:a.白色念珠菌;b.大肠杆菌;c.金黄色葡萄球菌。d.***P<0.001。
2.3 MIC和MBC表2是白色念珠菌、大肠杆菌和金黄色葡萄球菌在不同倍数和浓度原液的作用下的生长情况。从表2可以看出,2倍是培养基不出现浑浊且药物浓度最低的稀释倍数,而到了3倍则抑菌效果显著下降,孔内较为浑浊,生长了大量的真菌细菌。故将草本原液对3种菌的MIC定为2倍稀释浓度。
表3是用接种环蘸取2倍稀释倍数左右5孔样本的3种菌并接种在固体培养基上的生长情况。从表3可以看出,1倍和2倍平均菌落数量均少于5个,而3倍及以上稀释浓度的3种菌在固体培养基上则生长了大量菌落。故确定草本原液对3种菌的MBC为2倍稀释浓度。

表3 不同稀释倍数草本液与3种菌作用后菌落生长情况
2.4 活死细菌荧光染色活死细菌染液的成分为 SYTO9染色剂(钙黄素AM,A液)和PI染色剂(碘化丙啶,B液)。A液在单独使用时,将标记样品内所有的菌种(无论活死);B液在单独使用时,将标记细胞壁破损的细菌真菌。将A液与B液混合加入样品后使用荧光倒置显微镜观察,B液将抑制A液产生的荧光,从而区分菌种的活(绿光)死(红光)。从图2和图3可以看出,阴性对照组(丙三醇)的白色念珠菌、大肠杆菌、金黄色葡萄球菌均有大量绿色荧光,红色荧光几乎不可见,说明3种菌均生长状态良好,具有较强的活性。同时阳性对照组(青霉素钠)对大肠杆菌、金黄色葡萄球菌和阳性对照组(冰乙酸)对白色念珠菌有大量红色荧光而且绿色荧光几乎不可见,说明阳性对照组中有大量死菌且活菌几乎不可见。而草本原液作用2和5 min的白色念珠菌、大肠杆菌、金黄色葡萄球菌,均有大量红色荧光,而绿色荧光存在较少。因此,试验组中死菌大量可见而活菌几乎不可见。上述现象说明3种菌与草本原液作用2和5 min内大量菌死亡,表明草本原液有较强的抑菌能力,也印证了抑菌率中原液在与菌液接触的2 min内就表现出明显抑菌作用的结论。

注:阳性对照组中白色念珠菌使用冰乙酸;大肠杆菌和金黄色葡萄球菌使用青霉素钠。

注:阳性对照组中白色念珠菌使用冰乙酸;大肠杆菌和金黄色葡萄球菌使用青霉素钠。
2.5 细菌表面结构变化从图4可以看出,在SEM下正常生长的白色念珠菌形态饱满,呈球形,表面光滑,菌体完整,有菌丝,呈念珠状;经草本原液作用的白色念珠菌表面明显缺损,无菌丝,菌体周围可见大量碎絮状物质。 正常生长的大肠杆菌呈杆状,表面光滑,形态完整,菌体完好;经原液作用后的大肠杆菌长度短小,菌体皱缩,表面结构变得粗糙,部分菌体皱缩、干瘪、变形,细菌形态受到严重破坏,菌体周围可见大量碎片状物质。金黄色葡萄球菌球形饱满充盈、呈葡萄状聚团、外表致密光滑;经原液作用的金黄色葡萄球菌外表严重皱缩,粗糙。
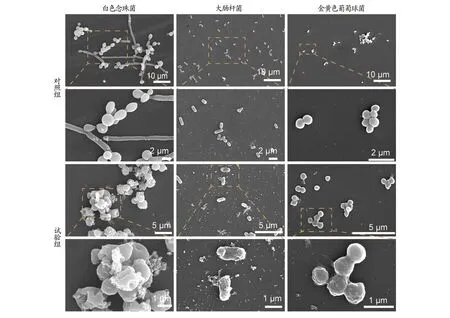
图4 草本原液和生理盐水对3种菌表面形态作用的扫描电子显微镜照片
3 讨论
对比抗生素药物,中药治疗感染有着独特的优势,中药来源广、活性成分多样、不易产生耐药性,因此可以成为抗耐药菌感染的新宝库[8]。早在20世纪50年代我国医药工作者即开始了中药抑菌作用与抑菌成分研究,并发现许多具备抗菌作用的中药[9]。该研究的草本液主要成分为龙井提取物、薄荷脑、甘油,其中茶多酚和薄荷醇为草本液的主要抗菌成分。草本液含有的龙井提取物含有包括茶多酚、生物碱、芳香物质在内的500多种物质[10],其中茶多酚是茶叶的主要有效成分,有着广谱有效抑菌功能,同时也有抗病毒、抗癌、抗氧化作用[11]。牛知慧等[12]通过西湖龙井的茶多酚提取物对多种细菌进行抗菌试验,证实了茶多酚具备较强抗菌性能。茶多酚通过与细菌细胞壁结合使得细胞壁的通透性增加,其内容物、金属离子和蛋白质外泄,最终导致细菌代谢发生紊乱,从而产生直接的抗菌作用[13]。中药薄荷脑又称薄荷醇,广泛应用于食品工业、制药工程、日用化工等行业,也具备广谱抗菌性能[14],有着治疗风热感冒、头痛、目赤、咽喉肿痛、口舌生疮、牙痛、荨麻疹、风疹的作用[15]。薄荷醇是一种天然环状萜醇类化合物,对白色念珠菌的外毒素、菌丝和被膜的产生起到抑制作用[16]。同时,低浓度的薄荷醇可以显著抑制金黄色葡萄球菌中的α-溶血素、肠毒素A和B以及中毒性休克综合征毒素1的表达[17],薄荷醇干扰白色念珠菌和金黄色葡萄球菌的外毒素等表达而非干扰菌种的生长,从而大大降低细菌的感染能力。
在抑菌率试验中,本草本液对白色念珠菌、大肠杆菌和金黄色葡萄球菌不同时长的抑菌率均大于99.9%。MIC和MBC试验说明该草本液有在2倍稀释浓度下杀灭白色念珠菌、大肠杆菌和金黄色葡萄球菌的能力。在抑菌环试验中,3种菌均出现抑菌圈,而且金黄色葡萄球菌的抑菌圈大于大肠杆菌和白色念珠菌的抑菌圈。根据李德全等[14]的研究,由于白色念珠菌为真菌,细胞结构相对复杂,其对消毒因子的敏感性一般弱于细菌。而大肠杆菌和金黄色葡萄球菌分别为革兰氏阴性菌和革兰氏阳性菌,2种菌在细胞壁成分结构功能上有很大不同,可能导致大肠杆菌和金黄色葡萄球菌的抑菌环的大小差异。以上试验可以证明草本液有较强的抗菌功能。SEM观察草本液作用后的3种菌,茶多酚对3种菌的作用导致细胞壁皱缩粗糙甚至疑似破损,充分验证了以上抗菌机理。同时,占茶多酚总量65%~80%的儿茶素成分也通过抑制大肠杆菌和金黄色葡萄球菌的生长对数期具备抑菌效果[18]。
茶多酚联合薄荷醇将进一步提高草本液联合抗菌的能力,茶多酚与细胞壁结合破坏其通透性,薄荷醇干扰菌种外毒素表达而不抑制菌种生长。该草本液通过雾化作用直接作用于呼吸系统,虽然体外抗菌试验已证明其有抗菌活性,但是通过雾化作用的治疗效果还需要进一步研究,因此需要该草本液雾化后进行动物试验以确定其作用效果,也需要对所研究中药提取物分离、纯化、鉴定,以确定其抗菌活性和抗菌机理,进一步研发出人体无害、治疗效果好、作用机理明确的中药草本液。

