方解石与萤石同质转化及浮选分离机理研究
谢顺昕 李育彪 陈锦凤 杨 旭 刘瑞庆
(1.武汉理工大学资源与环境工程学院,湖北 武汉 430070;2.关键非金属矿产资源绿色利用教育部重点实验室,湖北 武汉 430070)
萤石(CaF2)是氟化工行业的基础原料[1-3],分布广泛且不可再生,是我国重要的战略性非金属矿产[4-5],广泛应用于新能源、半导体、医疗、冶金、国防军工等领域[6-8]。我国萤石资源分布较广、储量较丰富,常与碳酸盐矿物、硅酸盐矿物及金属硫化矿等伴生,一般嵌布粒度细、品位较低、伴生情况复杂、难以单体解离,综合利用率较低[9-10]。随着萤石资源的开采与利用,单一萤石矿日趋枯竭,伴生萤石矿开采与利用越来越重要[11]。
自然界中伴生萤石矿主要类型有:碳酸盐型、石英型、硫化物型、重晶石型、硅质岩型等,其中碳酸盐型矿物是萤石资源最主要的赋存形式[12],开采、利用前景可观[13]。但碳酸盐-萤石型矿物的利用目前仍存在问题,其主要脉石矿物方解石(CaCO3)与萤石具有相似的晶体结构、相近的表面性质[14],两者表面钙离子为脂肪酸类捕收剂的吸附提供了理想的活性位点[15-16],分离选择性不强。而目前常见的碳酸盐类抑制剂以水玻璃[17-18]、改性水玻璃(酸化水玻璃、碱性水玻璃)[19-20]、六偏磷酸钠[21]等为主,在实际工业生产中,往往用量较多且受pH 值影响较大,需要在高碱性环境下浮选,对浮选循环水造成了一定污染,增加了选矿成本[15,17-18]。此外,由于萤石与方解石均为半可溶性矿物[22],在二者混合浮选体系中,部分萤石及方解石会以溶解离子(Ca2+、F-、CO23-)形式进入溶液体系内,从而改变矿物在溶液中的溶解平衡,导致两种矿物表面产生新的物相,使萤石和方解石表面性质趋于同质化[23]。胡岳华[24]根据溶液化学原理对萤石及方解石的共浮选体系进行了理论计算,证明了萤石表面与CO23-反应可生成CaCO3。
此外,张英等[25]基于密度泛函理论的第一性原理进行计算,结果表明:萤石及方解石的Ca 原子态密度组成十分相似,导致两者表面化学性质非常相似,体现出近似的浮选行为。黄国智等[26]研究发现,溶液中的F-会在方解石表面发生反应并生成CaF2,同时CO23-也会在萤石表面发生反应并生成CaCO3,改变了萤石及方解石的表面化学性质,使二者难以浮选分离。金赛珍等[1]研究发现,F-与CO23-对萤石及方解石的影响作用与萤石及方解石饱和溶液的pH值紧密相关,当矿浆pH 值小于萤石及方解石饱和溶液的pH 值时,F-与CO23-会抑制萤石及方解石的浮选行为,两种阴离子均不能使溶液中的Ca2+沉淀,但可以与其发生反应并吸附在矿物表面,从而改变其表面电性;当矿浆pH 值大于萤石及方解石饱和溶液的pH 值时,F-与CO23-对萤石与方解石的浮选行为表现出促进效果。王震等[27]将油酸钠作为捕收剂、单宁作为抑制剂对萤石及方解石进行浮选分离,考察了当pH=9 时,矿物饱和溶液对二者浮选行为的影响,并利用Visual MINTEQ 软件进行模拟研究,对矿浆体系中各离子形态及含量进行了计算,结果表明:萤石在方解石饱和溶液中的浮选行为明显受到抑制,使其浮选回收率大幅下降。因此,在萤石与方解石共存的溶液体系中存在同质转化现象,降低了碳酸盐-萤石型矿物的浮选分离效率。
综上可知,大部分研究基于溶液化学探究萤石与方解石的同质转化,忽略了萤石及方解石在浮选体系中的溶解与沉淀对浮选行为的影响。因此,本研究将以萤石与方解石单矿物为对象,基于表面性质,系统研究F-、CO23-对萤石与方解石浮选行为的影响,结合溶液化学计算、分子动力学计算、接触角及药剂吸附量测试分析,研究两种矿物同质转化与表面特性的关系,阐明萤石与方解石同质转化过程中的相似性和差异性,揭示两种矿物在浮选体系中对油酸钠吸附的影响机理,为含钙矿物尤其是碳酸盐性萤石矿的高效浮选分离提供科学依据。
1 试验原料及试验方法
1.1 试验样品及药剂
试验所用萤石原矿来源于湖南某地,方解石原矿来源于湖北某地。试验样品经手选—破碎—筛分—磨矿—分级后,取74 ~38 μm 粒级粉末样品,在超纯水中超声洗涤3 次,转移至真空干燥箱中,在313 K温度下烘干,干燥后的样品经混匀缩分后放至干净的封口袋中备用。萤石、方解石样品经X 射线荧光光谱(XRF)及X 射线衍射(XRD)测试,结果如表1、图1 所示。
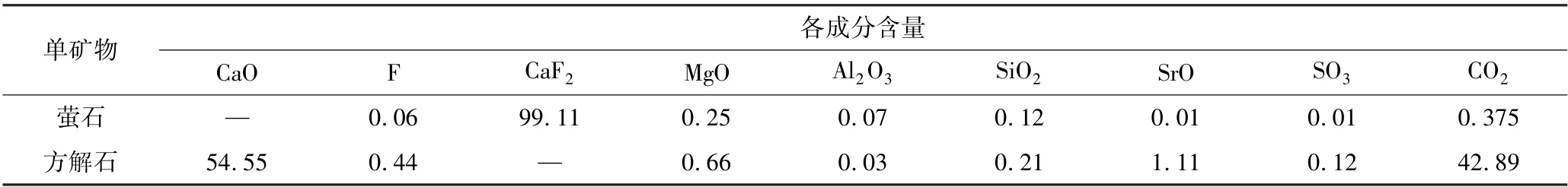
表1 萤石及方解石单矿物元素含量分析结果Table 1 Fluorite and calcite single mineral element content analysis results%
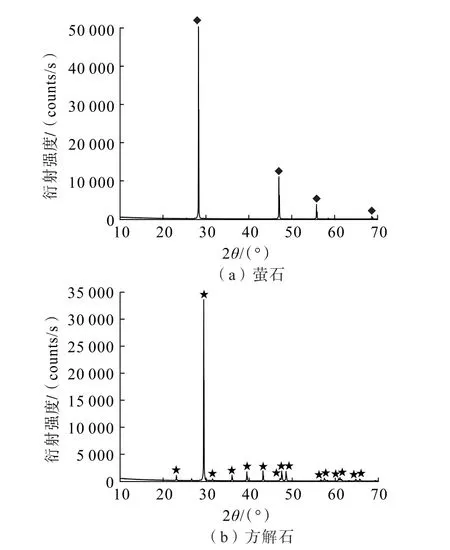
图1 萤石和方解石单矿物X 射线衍射分析结果Fig.1 X-ray diffraction analysis results of fluorite and calcite single minerals
由表1 可知,萤石单矿物CaF2含量为99.11%。将由表1 中CO2以碳元素为基准转化为碳酸根,并与CaO 中的Ca 含量相加,可以推出方解石中CaCO3含量为97.44%。将图1 与两矿物XRD 标准卡片对比,均未出现其他杂质的衍射峰,证明矿物纯度较高,满足单矿物浮选试验要求。
试验所用碳酸钠(Na2CO3)、氟化钠(NaF)、pH调整剂(NaOH、HCl)、抑制剂硅酸钠[(模数2.4)(Na2O(SiO2)2.4·xH2O)]、捕收剂油酸钠(NaOL)皆为分析纯;试验用水为超纯水。其中,Na2CO3与NaF的作用是通过分别向萤石和方解石两种单矿物浮选矿浆中加入对应矿物的可溶性钠盐,探究在浮选体系中CO23-与F-对萤石与方解石浮选行为的影响。
1.2 浮选试验
单矿物浮选试验采用XFG 型挂槽式浮选机,容积35 mL,转速1 200 r/min。每次试验取萤石或方解石矿样2.0 g,加入25 mL 超纯水或离子溶液调浆2 min,使用浓度为0.1 mol/L 的HCl 和NaOH 溶液作为pH 调整剂,搅拌5 min 至pH 值调整为所需值,再依次添加硅酸钠、油酸钠,每次加药后均搅拌2 min。浮选采用人工刮泡,刮泡时间4 min。浮选结束后,精矿与尾矿分别过滤、烘干、称重,计算回收率。浮选试验流程如图2 所示。

图2 单矿物浮选试验流程Fig.2 Flotation test of single minerals
1.3 分子动力学计算
基于密度泛函理论(DFT)的第一性原理和分子动力学(MD)进行模拟计算,首先使用CASTEP 模块进行萤石与方解石的晶胞构建和几何优化;校正近似使用广义梯度近似(GGA)的交换相关泛函的PW91梯度;萤石及方解石模拟计算过程中所确定的参数与文献[28]计算所用的参数相同。萤石及方解石的结构优化和电子结构计算采用340 eV 的截断能和1×1×1 的k 点网格的Monkhorst-Pack 方案,相互作用势采用超软赝势进行描述,几何优化的计算采用BFGS算法,采取精细标准进行模拟计算收敛[29]。
1.4 接触角测试
将5.0 g 萤石(方解石)样品放入盛有500 mL、浓度为1×10-2mol/L 的Na2CO3(NaF)溶液中,经磁力搅拌器搅拌30 min 后抽滤、真空冷冻干燥机干燥后取出,使用压片机制样,然后用JC2000C1 型接触角测定仪测量纯净及处理后的萤石与方解石样品的接触角,各测3 次,取平均值。制样过程用磁力搅拌器模拟浮选槽内环境,药剂制度按照浮选试验流程进行,但不调节pH 值。
1.5 紫外分光光度计测试
在245 nm 波长下,使用UV-5500 可见分光光度计测量油酸钠溶液,取1.0 g 粒度为74 ~38 μm 的萤石及方解石单矿物粉末样品,经对应矿物浸泡处理后的萤石及方解石粉末样品,分别置于烧杯中并加入25 mL 超纯水,加入浓度为1×10-3mol/L 的硅酸钠使用磁力搅拌器搅拌5 min 后过滤,将过滤后的样品再次置于烧杯中并加入25 mL 超纯水,加入用量为1×10-4mol/L 的油酸钠再次搅拌5 min 后离心。上清液经0.22 μm 滤膜过滤后测试吸光度。
2 试验结果与讨论
2.1 阴离子对萤石与方解石浮选的影响
为探索萤石与方解石两种单矿物是否存在同质转化现象,通过向两种单矿物浮选矿浆中加入对应矿物的可溶性钠盐,探究CO23-与F-对萤石与方解石浮选行为的影响。经过前期浮选试验可知,当pH=9、油酸钠用量为1×10-4mol/L、硅酸钠用量为1×10-3mol/L 时,萤石与方解石的浮选分离效果最佳,后续试验均在此基础上进行。当pH=9、油酸钠用量为1×10-4mol/L 时,向萤石浮选矿浆中加入Na2CO3溶液,同时向方解石浮选矿浆中加入NaF 溶液,试验结果如图3 所示。

图3 Na2CO3/NaF 用量对萤石/方解石浮选回收率的影响Fig.3 Effects of Na2CO3/NaF dosage on the flotation recovery of fluorite/calcite
由图3 可知,随着NaF/Na2CO3用量的增加,方解石与萤石的回收率互相趋同,方解石回收率从未添加NaF 溶液时的96.43%增加至添加NaF 溶液的97.09%,而萤石回收率从未添加Na2CO3溶液时的99.1%下降至添加Na2CO3溶液的96.63%,表明在萤石浮选矿浆中参与了矿物界面反应,在方解石浮选矿浆中F-参与了矿物界面反应,即萤石与方解石可能存在同质转化现象。为了进一步验证该现象,同时更加直观观测到二者浮选回收率的差异,在各浮选体系中均添加浓度为1×10-3mol/L 的硅酸钠,试验结果如图4 所示。
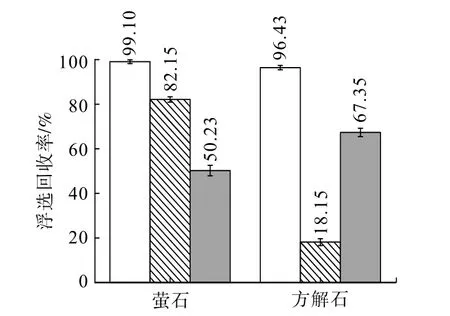
图4 Na2O(SiO2)2.4·xH2O+Na2CO3/NaF 对萤石/方解石浮选回收率的影响Fig.4 Effects of Na2O(SiO2)2.4·xH2O+Na2CO3/NaF on the flotation recovery of fluorite/calcite
由图4 可知,添加硅酸钠后,萤石浮选回收率从82.15%下降至50.23%,而方解石回收率从18.15%增加至67.35%,两种矿物的浮选回收率互相趋同,表明萤石及方解石浮选矿浆中添加对应矿物的可溶性钠盐会使两种矿物表面产生新的物相,萤石矿物表面会生成方解石,而方解石矿物表面会生成萤石,即萤石与方解石存在同质转化现象。
2.2 矿物饱和溶液对萤石与方解石浮选行为的影响
为进一步验证萤石与方解石的同质转化现象,通过将两种单矿物浮选试验所用的超纯水替换为对应矿物的溶解饱和溶液再次进行浮选试验。取5.0 g粒度为74 ~38 μm 的样品置于烧杯中,加入500 mL超纯水,用保鲜膜覆盖在烧杯口,将其置于磁力搅拌器中搅拌6 h 后静置24 h,而后用离心机离心。离心后的液体用10 mL 注射器抽取其上清液,经过滤头过滤后得到对应矿物溶解饱和溶液。控制浮选矿浆pH=9,硅酸钠用量为1×10-3mol/L、油酸钠用量为1×10-4mol/L,试验结果如图5 所示。
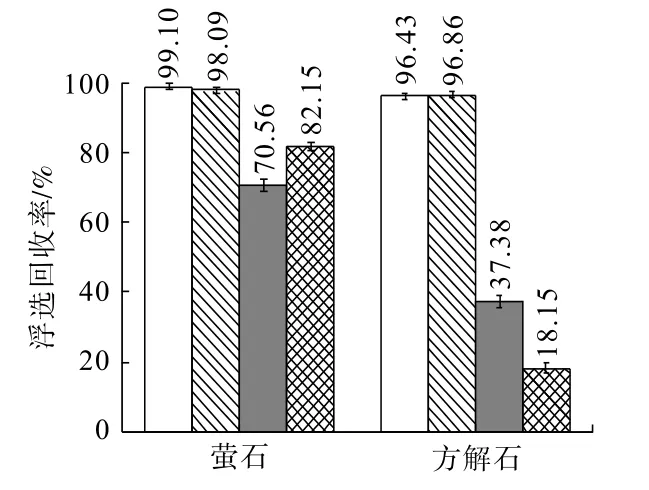
图5 添加硅酸钠及Na2CO3/NaF 溶液对萤石/方解石浮选回收率的影响Fig.5 Effects of sodium silicate and Na2CO3/NaF solutions on the flotation recovery of fluorite/calcite
由图5 可知,用方解石饱和溶液替换超纯水浮选时,萤石浮选回收率从99.10%小幅下降至98.09%,添加硅酸钠后,萤石浮选回收率为70.56%,低于在超纯水中的回收率(82.15%),表明方解石饱和溶液中的离子对萤石浮选行为具有抑制作用;同时,用萤石饱和溶液替换超纯水进行浮选时,方解石的浮选回收率从96.43%小幅提高至96.86%,再添加硅酸钠之后,方解石的浮选回收率下降至37.38%,高于在超纯水环境中的浮选回收率(18.15%),表明萤石饱和溶液中的离子对方解石的浮选行为具有促进作用,进一步证明萤石与方解石存在同质转化现象。
3 机理分析
3.1 溶液化学计算
由于萤石及方解石是半可溶性矿物,在二者共存的溶液体系中,会有部分矿物溶解并与溶液中其他离子发生反应,从而改变矿物在溶液中的溶解平衡,致使两种矿物表面产生新的物相,使两种矿物难以有效分离[30]。方解石及萤石溶解反应如式(1) ~(10)所示:
根据上述公式,使用水化学平衡软件Visual MINTEQ 3.1 计算萤石及方解石溶液组分随pH 值变化,结果如图6、图7 所示:

图6 萤石溶液中各组分与pH 值的关系Fig.6 Fluorite solution components vs.pH value

图7 方解石溶液组分与pH 值的关系Fig.7 Calcite solution components vs.pH value
由图6、图7 可知,pH=9 时,萤石饱和溶液中Ca2+浓度为10-3.3mol/L,F-浓度为10-3.62mol/L,略小于理论Ksp值(Ksp= 10-10.54);方解石饱和溶液中Ca2+浓度为10-4.7mol/L,CO23-浓度为10-3.61mol/L,略大于其理论Ksp值(Ksp=10-8.31)。可以认为计算数据具有可信度。
由图6 可知,随着pH 值逐步提高,萤石水解出的Ca2+浓度先上升后稳定不变,此时溶液体系中的钙元素主要以离子形式存在,碱性条件下,Ca2+先与OH-结合产生Ca(OH)2胶体,而Ca(OH)2胶体会吸附在萤石表面,降低其可浮性。但是,由于全pH 值范围内溶液中的优势离子仍为Ca2+与F-,因此,萤石可浮性受pH 值影响较小。
由图7 可知,方解石溶液体系内的优势离子会受到pH 值的较大影响。当pH≤8 时,溶液中的优势离子为Ca2+,此时方解石溶液与萤石溶液的离子体系相似,在两者共存的矿浆体系中,由于Ca2+为体系的优势离子,更容易达到萤石的溶度积,进而导致萤石从矿浆中沉淀,然后附着在方解石表面,因此,此时的方解石表现出与萤石相似的表面化学性质,验证了酸性及弱碱性条件下萤石及方解石难以分选的原因[31]。当pH≥8 时,方解石优势离子转变为HCO-3和CO23-,在此情况下油酸钠作为捕收剂对方解石的捕收性能呈现下降趋势。
此外,抑制剂水玻璃(主要成分是Na2SiO3)在溶液体系中发生水解时,产物根据溶液pH 值的不同而改变。当溶液pH=9 时,其溶解有效组分与Ca2+反应如式(11)所示[32]。
根据式(11)可知,Na2SiO3与Ca2+反应产生CaSiO3沉淀,且Ksp值小于萤石及方解石的Ksp值,表明萤石及方解石饱和溶液中的Ca2+浓度均大于CaSiO3沉淀浓度。因此,添加水玻璃会消耗溶液中的Ca2+,当Ca2+浓度较低时,Na2SiO3会与矿物表面的Ca2+活性位点结合,增加矿物亲水性,抑制油酸钠在萤石、方解石表面的吸附,降低矿物的可浮性。因此,在Ca2+浓度相对较低的方解石溶液中,低浓度的Na2SiO3表现出高抑制性;而对于Ca2+浓度相对较高的萤石溶液,需要更高的Na2SiO3浓度才能实现对萤石的抑制。
3.2 萤石与方解石表面扩散性计算
为了研究萤石与方解石在溶液体系中矿物表面组分的溶解过程,基于密度泛函理论的第一性原理和分子动力学对两种矿物表面离子的扩散性进行计算。在MS 8.0 系统中,经过对萤石及方解石晶胞几何优化后,在常压条件下改变温度参数,通过在100 ps 内萤石及方解石表面溶解扩散的分子动力学模拟,量化其动力学参数,对两种矿物溶解组分在溶液中扩散性分子动力学研究结果如图8 所示。
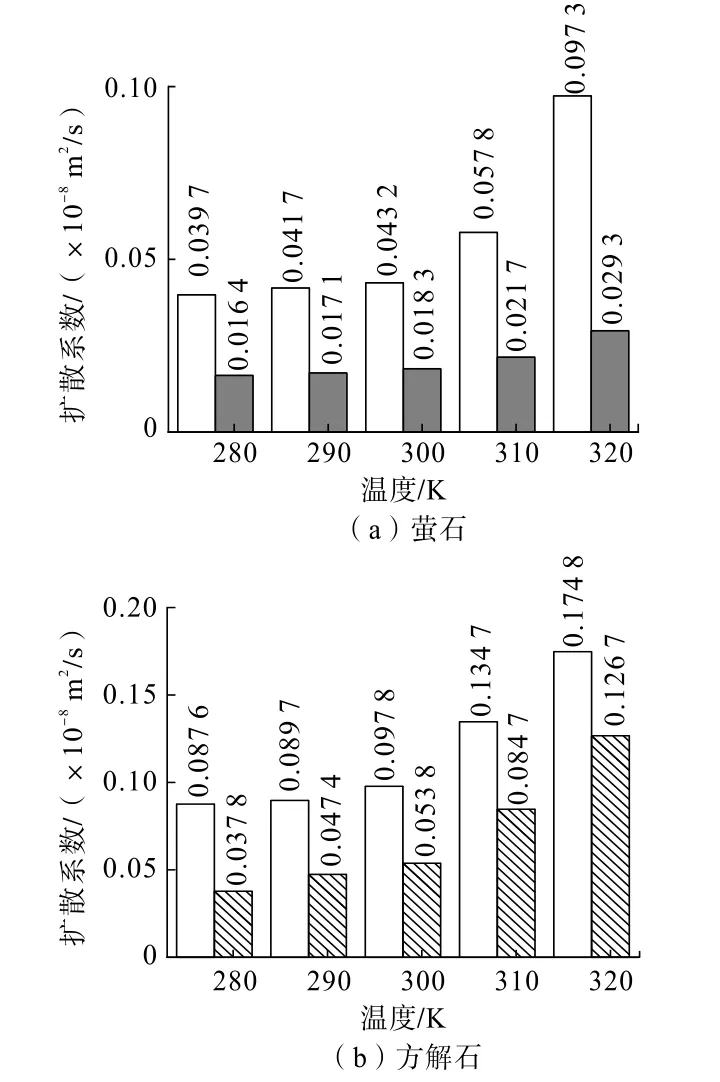
图8 萤石与方解石在不同温度下溶解组分的扩散系数Fig.8 Diffusion coefficients of dissolved constituent fluorite and calcite at different temperatures
由图8 可知,随着温度升高,萤石及方解石表面离子的扩散系数也逐步变大,且萤石表面Ca2+扩散系数增加速率最大,由0.039 7×10-8m2/s 增大至0.097 3×10-8m2/s。通过对两种矿物阴阳离子扩散系数的对比,发现萤石及方解石表面的阳离子(Ca2+)扩散系数均大于对应的阴离子(F-、CO23-),因为Ca2+和F-、CO23-的溶解与扩散系数不同,表明溶解反应过程是一个非均相溶解过程,容易造成表面阴、阳离子缺陷,为矿物同质转化提供了前提条件。
方解石表面离子扩散系数大于萤石,在该试验的所有温度条件下,方解石表面阳离子的扩散系数约为萤石表面阳离子扩散系数的2 倍,而方解石表面阴离子的扩散系数大于萤石表面阴离子扩散系数的2 倍,且随着温度上升,差异可以达到4 倍左右,表明方解石的表面组分会更快地进入溶液中。由于方解石的扩散系数大于萤石,证明在相同条件下,方解石表面离子的溶解动力学更快,更易形成表面离子缺陷,为方解石表面的萤石物相生成提供了前提条件,即方解石表面生成萤石相比萤石表面生成方解石相更容易。
3.3 接触角分析
3.3.1 萤石及方解石单矿物接触角
将萤石及方解石样品压片后,测定其接触角,结果如图9 所示。
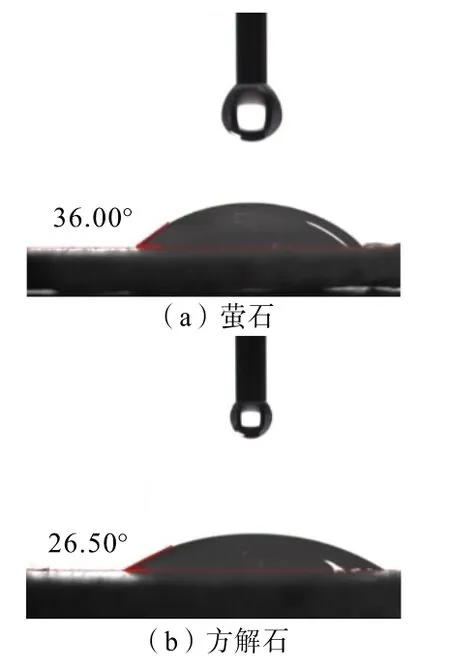
图9 萤石与方解石单矿物接触角对比Fig.9 Contact angles comparison of single fluorite and calcite
由图9 可知,萤石表面接触角为36.00°,大于方解石的接触角(26.50°),证明萤石的天然可浮性优于方解石,验证了浮选试验结果。
3.3.2 F-处理对方解石接触角的影响
将方解石样品与经F-处理后的方解石样品进行接触角测试,结果如图10 所示。
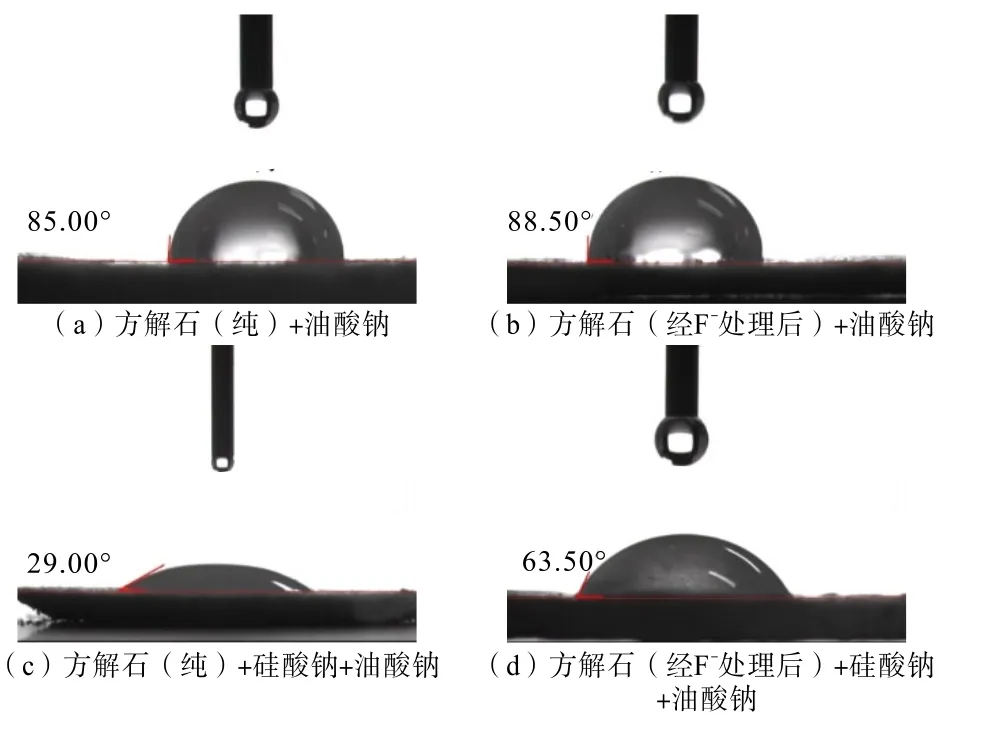
图10 方解石与F-处理后的方解石接触角对比Fig.10 Contact angles comparison of single calcite and F-treated calcite
由图10 可知,在只有油酸钠时,F-处理前后的方解石样品接触角仅增加了3.5°,表明F-处理提高了油酸钠对方解石的捕收性;在油酸钠和硅酸钠条件下,F-处理前后的方解石样品接触角增加了34.5°,结合浮选试验及分子动力学计算可知,经F-处理后的方解石表面生成了萤石,降低了硅酸钠对方解石的抑制作用。
3.3.3 CO23- 处理对萤石接触角的影响
将萤石样品与经CO23-处理后的萤石单矿物进行接触角测试,结果如图11 所示。

图11 萤石与处理后的萤石接触角对比Fig.11 Contact angles comparison of single fluorite and treated fluorite
由图11 可知,在只有油酸钠时,CO23-处理前后的萤石样品接触角减少了6°,说明CO23-处理降低了油酸钠对萤石的捕收性;而在油酸钠和硅酸钠条件下,CO23-处理后萤石接触角降低了19.5°,结合浮选试验及分子动力学计算可知,经CO23-处理后的萤石表面生成了方解石,增强了硅酸钠对萤石的抑制作用。
3.4 紫外可见光谱分析
为了研究同质转化对油酸钠在萤石及方解石表面吸附的影响,基于紫外可见光谱测定了萤石及方解石经对应矿物饱和溶液浸泡处理后矿浆中残余油酸钠的量,结果如表2 所示。

表2 饱和溶液浸泡对萤石及方解石表面油酸钠吸附的影响Table 2 Influence of saturated solution on the adsorption of sodium oleate on fluorite and calcite surfaces %
油酸钠在波长245 nm 时存在特征峰[33]。由表2可知,不同处理条件下吸光度均小于油酸钠原液,表明4 种矿样的表面上都有油酸钠吸附,且萤石表面吸附量最多,而方解石表面吸附量最少。此外,萤石单矿物经方解石的饱和溶液浸泡处理后,其表面油酸钠吸附量显著减少,且接近于方解石单矿物表面的油酸钠吸附量;而方解石单矿物经萤石的饱和溶液浸泡处理后,其表面对油酸钠的吸附能力显著增强,且接近于萤石单矿物表面的油酸钠吸附量,与CO23-、F-对萤石及方解石浮选行为的影响结果相符,进一步证明了方解石溶液中的阴离子CO23-对萤石浮选行为具有抑制作用,而萤石溶液中的阴离子F-对方解石的浮选具有促进作用,这可能是经过对应矿物饱和溶液处理后的萤石及方解石表面均有对应物相的生成。
4 结 论
以萤石与方解石为研究对象,基于浮选试验、分子动力学模拟及药剂吸附量试验方法和测试手段,研究了浮选过程中萤石与方解石表面变化的差异性,揭示了两者在浮选体系的同质转化现象及机理,为实现含钙矿物尤其是碳酸盐性伴生萤石矿的高效浮选分离提供了科学依据。
(1)矿浆体系中的CO23-与F-浓度会直接影响萤石及方解石的浮选行为。萤石浮选回收率随CO23-浓度的提高逐渐下降,并接近方解石单矿物的浮选回收率,而方解石浮选回收率随F-浓度的提升逐渐接近萤石的浮选回收率。
(2)方解石表面生成萤石较萤石表面生成方解石更容易。不同温度条件下,方解石比萤石更容易溶解进入溶液中,由于方解石溶解度大于萤石,当两种矿物共存于矿浆中时,更容易先达到萤石溶度积,进而从矿浆中优先沉淀萤石。
(3)经同质转化处理后,方解石表面比萤石表面更容易吸附油酸钠。矿浆体系中的CO23-及F-会在萤石及方解石表面生成对应物相,由于萤石比方解石更易与油酸钠结合,当两种矿物共存于矿浆中时,同质转化后的方解石表面将会吸收更多的油酸钠,这也是萤石与方解石浮选分离较为困难的主要原因。
——饱和溶液与不饱和溶液

