红色LED光照下上海青采后硫代葡萄糖苷代谢的变化
孙莹,郭峰,韩颖,胡花丽,罗淑芬,李鹏霞*
(1.沈阳农业大学食品学院,辽宁沈阳 110866)(2.江苏省农业科学院农业设施与装备研究所,江苏南京 210014)(3.江苏省农业科学院,农业农村部农产品冷链物流技术重点实验室,江苏南京 210014)
上海青(Brassica rapaL subsp.chinensis)属于十字花科芸苔芸薹属,是普通白菜的一个变种,常见于中国南方地区,新鲜上海青口感甘甜营养丰富[1]。内含维生素、矿物质和多酚等营养活性成分,其中硫代葡萄糖苷(硫苷),会被植物本身存在的黑芥子酶和人类的胃肠道微生物菌群转化为异硫氰酸酯(Isothiocyanate,ITC)[2]。大量研究表明异硫氰酸酯为广谱抗癌天然产物[3]。上海青在采收后,叶片极易产生黄化、萎蔫和腐烂等品质劣变现象,严重影响其商品品质,缩短其货架期,上海青在常温23~25 ℃下货架期仅为1~2 d[4]。因此,寻求安全有效的上海青营养品质提升技术显得尤其重要。
有研究表明,微孔包装可以延缓上海青叶绿素降解,延缓其叶片黄化,并保持较高的多酚含量和抗氧化能力[5]。外源胆固醇处理可以维持上海青中叶绿素和抗坏血酸含量[6]。亚硒酸钠溶液浸泡结合气调包装处理能够保持上海青的感官品质并维持抗坏血酸、可溶性固形物及类黄酮等的含量[7]。针对上海青的硫苷代谢,有研究证实,上海青叶柄中的硫苷含量是其叶片的1.54倍[8]。采前向叶片喷洒油菜素内酯和多胺可增加上海青脂肪族硫苷和总硫苷的含量,减少其吲哚族硫苷的含量[9];但乙烯利处理会提高上海青的吲哚族硫苷含量[10];在采后,用1-MCP处理上海青,其组织中硫苷含量得到了显著提升[11]。已有研究证实白色LED光照处理可以促进上海青硫苷物质的生成[12]。但,有关上海青叶柄采后硫苷代谢的研究报道仍较少。
LED光照保鲜技术作为一种新型、高效、安全的物理保鲜手段。具有单色光排放高、寿命长、灵活和机械坚固性等优点。因此,LED可用来减少农作物的热损伤和退化,并适用于冷藏应用,还可以提农产品的产量和营养成分[13]。闫志成[14]证实白色LED光照对上海青进行处理,可以维持其叶绿素含量。Zhou等[15]发现白色LED光照处理提高了上海青中可溶性蛋白含量,降低了其游离氨基酸含量,延缓了其采后衰老。而其他学者得出白色LED光照还可维持上海青较高的叶绿素及抗坏血酸含量,减缓其丙二醛的累积[16]。Fan等[17]采用转录组学手段分析出红蓝色LED光照可以减少上海青中亚硝酸盐的累积。红色LED光照可以抑制上海青叶绿素降解及相关基因的表达并促进抗坏血酸合成基因的表达[18];在此基础上,结合气调包装可以减轻丙二醛的积累并维持叶绿素、维生素等物质的含量[19]。但红色LED光照对上海青硫苷代谢的影响机制目前尚不明确。
本实验以上海青为实验材料,研究了红色LED光照处理后的上海青中硫苷代谢合成途径及降解途径中关键物质、关键酶和关键基因表达的变化,为上海青采后保鲜及营养物质的提升提供理论和技术支持。
1 材料与方法
1.1 材料与试剂
1.1.1 材料
本实验用上海青于2022年2月18日移栽于江苏归来兮生态农业开发有限公司蔬菜种植基地大棚,3月21日清晨进行采收,7~8成熟,当天上午运输至江苏省农业科学院装备与设施研究所实验室内。立即挑选出大小、色泽基本一致且无病害及黄化现象的上海青作为实验材料。
1.1.2 试剂
丙酮、甲醇、无水乙醇、乙酸、活性炭、邻苯二硫醇、正己烷、葡萄糖、甲酸铵、二氯甲烷、硼酸、邻苯二硫醇(均为分析纯),上海阿拉丁生化科技股份有限公司;萝卜硫苷(Glucoraphanin,GRA)、2-羟基-3-丁烯基硫苷(Progoitrin,PRO)、3-丁烯基硫苷(Gluconapin,GNA)、黑芥子苷(Sinigrin,SIN)、4-甲硫基-丁基硫苷(Glucoerucin,GER)、4-戊烯基硫苷(Glucobrassicanapin,GBN)、萝卜硫素分析标准品购自美国Sigma-Aldrich公司;3-丁烯基异硫氰酸酯购自北京坛墨质检科技有限公司;葡萄糖试剂盒购自南京建成生物科技有限公司;RNA提取试剂盒购自成都福际生物技术有限公司;cDNA合成试剂盒购自美国Thermo Scientific公司;SYBR Premix Ex TaqTM Ⅱ试剂盒购自日本TaKaRa公司;引物序列由苏州金唯智生物科技有限公司合成。
1.2 仪器
PL202-L电子天平,梅特勒-托利多仪器(上海)有限公司;UV-1102型紫外可见分光光度计,上海天美科学仪器有限公司;雪花制冰机FM40,北京长流科学技术公司;A11 Basic型液氮研磨器,艾卡(广州)仪器设备有限公司;3K15高速冷冻离心机,德国Sigma公司;HH-S系列数显恒温水浴锅,常州万达升实验仪器有限公司;Seven Multi pH计,梅特勒-托利多仪器(上海)有限公司;Waters 2695高效液相色谱仪,美国Waters公司;QTRAP 6500高效液相色谱串联质谱分析仪,上海爱博才思分析仪器贸易有限公司;TSQ 8000 EVO气相色谱串联质谱分析仪,美国Agilent Technologies公司;培清JS-680D全自动凝胶成像分析仪,上海培清科技有限公司。
1.3 实验设计与处理
1.3.1 试验Ⅰ:上海青适宜光照条件筛选
实验分为9组,具体处理方式如表1所示。挑选18~20颗大小基本一致,无黄化,无病害的上海青放置在LED光照货架上,并设置3组平行,模拟超市低温货架温度(15 ℃)下进行光照(黑暗12 h,光照12 h),将对照组进行遮光处理。贮藏至第8天时,通过观察上海青表型和测定叶片总叶绿素含量,筛选出适宜上海青贮藏的光照条件。
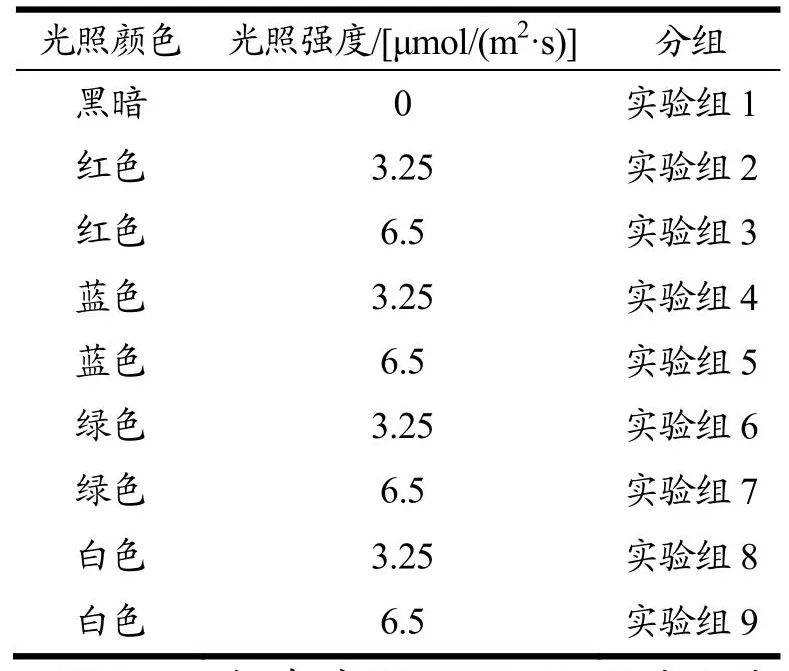
表1 上海青贮藏实验条件Table 1 Experimental conditions of pakchoi
1.3.2 试验Ⅱ:红色光照LED处理对上海青采后硫苷代谢的影响
以实验Ⅰ筛选的光照条件作为处理组(黑暗12 h,光照12 h),对照组为黑暗处理,置于15 ℃下贮藏。每个处理平行处理15组,每组18~20颗上海青。取样方式为:各组每2 d随机选取3个平行进行取样。取样部位为:外层5~6层叶片部分,避开主叶脉,叶柄部分去掉根部,并用液氮速冻,速存放于-80 ℃用于指标的测定。
1.4 测定指标与方法
1.4.1 总叶绿素含量的测定
参考Hu等[20]的方法并稍作修改。取0.2 g上海青粉末,加入10 mL体积分数为80%丙酮,避光常温浸提6 h,过滤后取上清液,以体积分数80%丙酮为空白校零,测定在642和665 nm处提取液的吸光值,重复测定3次,计算叶绿素含量(mg/g)。
1.4.2 总硫苷含量的测定
根据韩颖等[21]的方法,并稍做修改。称取2份上海青粉末样品各1 g,1份加1.5 mL水,另1份加1.5 mL体积分数40%酸化甲醇(pH值4.0,HCl调制),在37 ℃下水浴浸提1 h后,80 ℃水浴浸提5 min,最后均用2 mL 100%甲醇终止反应。于4 ℃、10 000 r/min离心15 min,取上清液用葡萄糖试剂盒测定葡萄糖含量,硫苷分解生成的葡萄糖的物质的量与硫苷的物质的量相等,以此计算硫苷物质的量。
1.4.3 总异硫氰酸酯含量的测定
根据Zhang等[22]的方法,并稍做修改。取0.4 g上海青粉末加入0.8 mL蒸馏水混匀,于4 ℃、10 000 r/min下离心15 min,取0.25 mL上清液,加入0.25 mL 100 mmol/L硼酸缓冲溶液(pH值8.5)和0.5 mL 10 mmol/L邻苯二硫醇溶液,于65 ℃水浴2 h后于365 nm处测定吸光度值。用萝卜硫素做标曲,根据标曲计算总异硫氰酸酯的含量。
1.4.4 黑芥子酶活性的测定
根据赵欢欢等[23]的方法,并稍做修改。取1 g上海青粉末加入2 mL 0.1 mol/L磷酸盐缓冲液(pH值6.5),于4 ℃、10 000 r/min下离心15 min,上清液即为粗酶液。取0.6 mL粗酶液,加入0.2 mL 2 mmol/L的黑芥子苷溶液,混匀,37 ℃水浴15 min,然后置于沸水浴中反应5 min以停止反应。采用葡萄糖试剂盒检测葡萄糖含量,以每分钟生成1 nmol葡萄糖为1个酶活,比活度以鲜重U/g表示。
1.4.5 硫苷物质含量的测定
样品制备:参照Luo等[24]的方法略有修改,称取1 g上海青粉末加入2 mL体积分数75%甲醇,80 ℃水浴20 min,冷却至4 ℃后于10 000 r/min下离心15 min,取上清液,过0.22 μm有机相滤膜,经LC-20液相色谱串联TripleTOF® 5600+飞行时间液质联用仪鉴定。根据在全扫描模式下确定的m/z值和在MS2模式下观察到的碎片信息,与相应的标准品质谱信息或参考文献质谱信息比对进行硫苷鉴定。鉴定后其中GRA、GNA、GBN、GBR采用标准曲线法进行定量,其中4-羧基-吲哚-3-亚甲基硫苷(4-Hydroxy Glucobrassicin,4HGBS)、4-甲氧基-吲哚-3-亚甲基硫苷(4-Methoxy Glucobrassicin,4MGBS)和1-甲氧基-吲哚-3-亚甲基硫苷(Neoglucobrassicin,NGBS)以其结构相似的物质GBR的标准曲线进行计算,其他以黑芥子苷为内标,采取内标法校正因子计算。
1.4.6 硫苷水解产物鉴定和测定
样品提取:参照Klopsch等[25]的方法,略作修改。取1 g上海青粉末加入2.5 mL去离子水,于37 ℃水浴条件下水解3 h,加入2 mL二氯甲烷萃取2次,4 ℃、10 000 r/min下离心15 min离心后,取下清液,氮吹至300 μL,过0.22 μm有机滤膜,采用GC-MS定性及定量。
1.4.7 上海青叶柄总RNA的提取及cDNA的合成
RNA提取:上海青叶柄总RNA的提取按照Plant Total RNA Isolation Kit Plus(成都福际生物技术有限公司提供)要求完成。cDNA的合成:上海青叶柄cDNA的合成按照First Strand cDNA Synthesis Kit(由Thermo Scientific Revert Aid提供)操作。总体系20 μL,总RNA 500 ng,GoldenstarTMRandomer 1 μL,5×GoldenstarTM Buffer 4 μL,dNTP Mix 1 μL,DTT 1 μL,GoldenstarTM RT6 1 μL,RNase-free water补足至20 μL。之后于25 ℃反应10 min,55 ℃反应15 min,85 ℃反应5 min后置于-80 ℃冰箱备用。
1.4.8 实时荧光定量聚合酶链式反应(Quantitative Real-Time Polymerase Chain Reaction,RT-q PCR)分析
RT-qPCR分析:内参基因为Actin,目的基因为:MYB28、CYP83A1、UGT74C1、FMOGS-OX5、GGP1、SUR1、AOP2等。引物序列运用Primer 5.0软件进行设计,最终由苏州金唯智生物科技有限公司合成,引物序列详细信息见表2,每个样品设置3个重复。根据TaKaRa SYBR Premix Ex TaqTM Ⅱ(TliRNaseH Plus)要求完成。总反应体系20 μL,包括2×SYBR Premix ExTaqTMⅡ(TliRNaseH Plus)10 μL,PCR Forward Primer 0.60 μL,PCR Reverse Primer 0.60 μL,DNA模板1 μL,ddH2O(灭菌蒸馏水)7.8 μL。反应条件:预变性:95 ℃,30 s,1个循环;PCR反应:95 ℃,5 s,60 ℃,30 s,40个循环。

表2 RT-qPCR引物序列Table 2 Primer sequences for real time-qPCR
1.4.9 数据分析
所有数据均为对同一处理组3个平行中的样品分别测定后,所得数据取平均值±标准差表示,所有数据用SPSS 20.0软件进行分析,显著性采用ANOVA进行邓肯氏多重差异分析,P<0.05表示差异显著。用Origin 2021软件作图。
2 结果与讨论
2.1 不同颜色和光密度LED光照处理下对上海青表型及总叶绿素含量的影响
如图1所示,在贮藏8 d时,对照组中上海青叶片已出现明显黄化;经过不同颜色和光密度的LED光照处理的上海青中,除红光处理组外的其他处理组(蓝光、绿光和白光)上海青叶片均已经出现了明显的黄化现象,红光处理组仅出现轻微黄化,其中光密度为3.25 μmol/(m2·s)的红光处理组较6.5 μmol/(m2·s)的红光处理而言,其叶片黄化更明显。

图1 不同光照条件处理对上海青表型的影响Fig.1 Effects of different condition of light emitting diode (LED)irradiation on phenotype of pakchoi
由图2可知,不同颜色和光密度LED光照处理后的上海青叶片总叶绿素含量的变化不一致,可以看出红光处理的上海青叶片总叶绿素含量显著高于其他处理组,其中6.5 μmol/(m2·s)的红光处理组显著高于3.25 μmol/(m2·s)的红光处理(P<0.05)。与本实验结果类似,Song等[18]也发现红色LED光照可以有效保持上海青的采后品质,并且延缓上海青的叶片中叶绿素的降解。因此,结合表型分析,本实验后续选取光密度6.5 μmol/(m2·s)的红光对上海青进行处理。
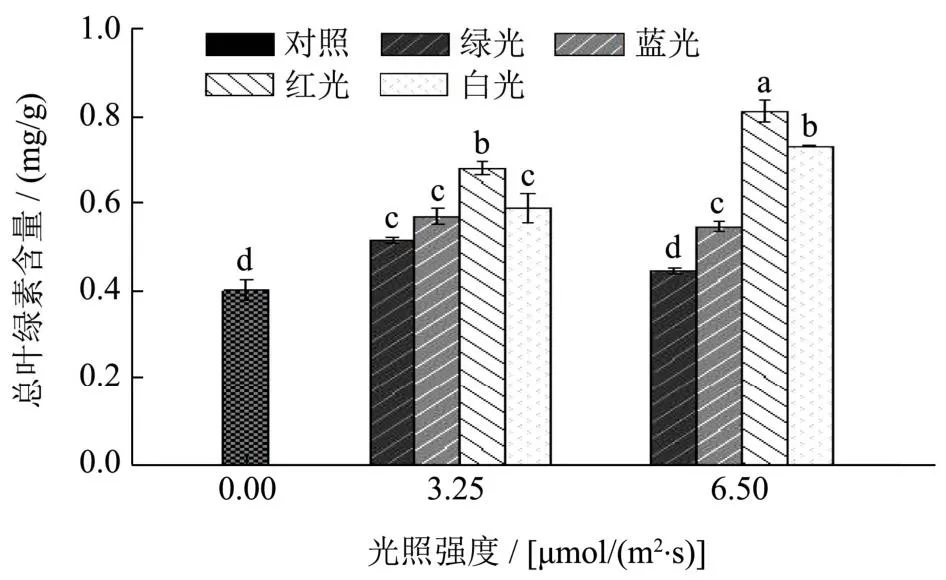
图2 不同颜色和密度LED光照处理对上海青叶片总叶绿素含量的影响Fig.2 Effects of different condition of LED irradiation on total chlorophyll content in pakchoi leaves
2.2 红色LED光照对上海青表型的影响
如表3所示,对照组在贮藏第4天叶片已经出现轻微黄化现象,在第6天叶片出现了明显黄化,在贮藏第8天叶片已严重黄化,失去商品价值。而红光处理组上海青在贮藏第6天仍保持较好的色泽,在第8天时叶片仅出现轻微黄化现象。由此可见,红色LED光照处理可以延缓上海青的黄化进程,保持其品质。

表3 红色LED光照处理对上海青表型的影响Table 3 Effect of red LED irradiation treatment on the phenotype of pakchoi
2.3 红色LED光照处理对上海青总硫苷、总异硫氰酸酯含量以及黑芥子酶活性的影响
上海青中含有与抗癌相关的营养物质硫苷,在正常情况下,硫苷物质较为稳定,但随着贮藏时间的延长,植物组织逐渐衰老,细胞受到破坏,硫苷与黑芥子酶接触,从而造成了硫苷水解,生成活性物质异硫氰酸脂等物质。在本实验中,如图3a所示,在贮藏期间上海青叶柄中红光处理组总硫苷含量在第2天下降,在第4天显著上升,随后逐渐下降,对照组上海青叶柄总硫苷含量在第2天上升,随后持续下降。由此,对照组总硫苷含量虽然在第2天显著高于红光处理组(P<0.05),但在贮藏4~8 d期间,显著低于红光处理组(P<0.05),此时,红光处理组总硫苷含量为对照组的1.62~1.99倍。如图3b所示,上海青叶片中总硫苷的含量整体呈下降趋势。并在整个贮藏期间,红光处理组显著高于对照组(P<0.05),是对照组的1.69~4.65倍。可见,红色LED光照可以延缓上海青贮藏期间总硫苷含量的流失,类似地,Mao等[26]得出紫外线处理也可以有效延缓上海青中总硫苷的损失。
Wang等[27]发现红色LED光照可以显著提升西兰花幼苗中总异硫氰酸酯的含量。本实验中,图3c结果显示,在贮藏期间,对照组上海青叶柄中总异硫氰酸酯含量总体波动不大,但红光处理组在贮藏2~4 d内出现了明显上升,且在整个贮藏期间显著高于对照组(P<0.05)。图3d显示,上海青叶片中总异硫氰酸酯波动不大,在贮藏前期对照组总异硫氰酸酯含量高于处理组,但在贮藏4~8 d内是红光处理组的77.43%~91.98%。由此可见,红色LED光照处理可以显著提高上海青中总异硫氰酸酯的含量。
如图3e所示,随着贮藏时间的延长,上海青叶柄中黑芥子酶活性总体呈下降趋势,但对照组波动变化较大。在贮藏的第2、6、8天,对照组上海青中黑芥子酶活性分别为红光处理组的51.11%、43.42%和23.54%。如图3f所示,上海青叶片中黑芥子酶的活性呈下降趋势,对照组黑芥子酶活性虽在贮藏第2天显著高于红光处理组(P<0.05),但红光处理组在贮藏4~8 d下降速度小于对照组,且在此期间显著高于对照组(P<0.05),尤其在第6天时,高于对照组459.65%。可见,红色LED光照总体上可以维持上海青中相对较高的黑芥子酶活性,这可能是造成红色LED光照处理的上海青在中异硫氰酸酯含量较高的主要原因[18]。
综上,上海青叶柄中硫苷及异硫氰酸酯含量分别为叶片的2.72倍和1.32倍,与本实验结果类似,Zhu等[8]也发现上海青叶柄中硫苷含量较叶片中更高。因此,本文后期主要关注上海青叶柄中硫苷代谢的变化。
2.4 上海青叶柄中的硫苷单体的鉴定
表4显示,上海青中主要含有11种硫苷,分别为脂肪族6种:GRA、GIB、PRO、GNA、GBN、GAL。芳香族1种:GNS。吲哚族4种:4MGBS、4HGBS、NGBS、GBR;其中,含量最高为GNA,占上海青叶柄的72.45%,其次为GBN占上海青叶柄的11.22%。类似地,Wiesner等[28]也得出上海青中的主要硫苷物质为GNA,但其含量占总硫苷的66.69%,这可能是品种差异造成。本研究后期主要关注上海青叶柄中含量大于0.01 μmol/g的硫苷单体含量变化情况,如GNA、GBN、4MGBS、4HGBS、PRO、NGBS等。
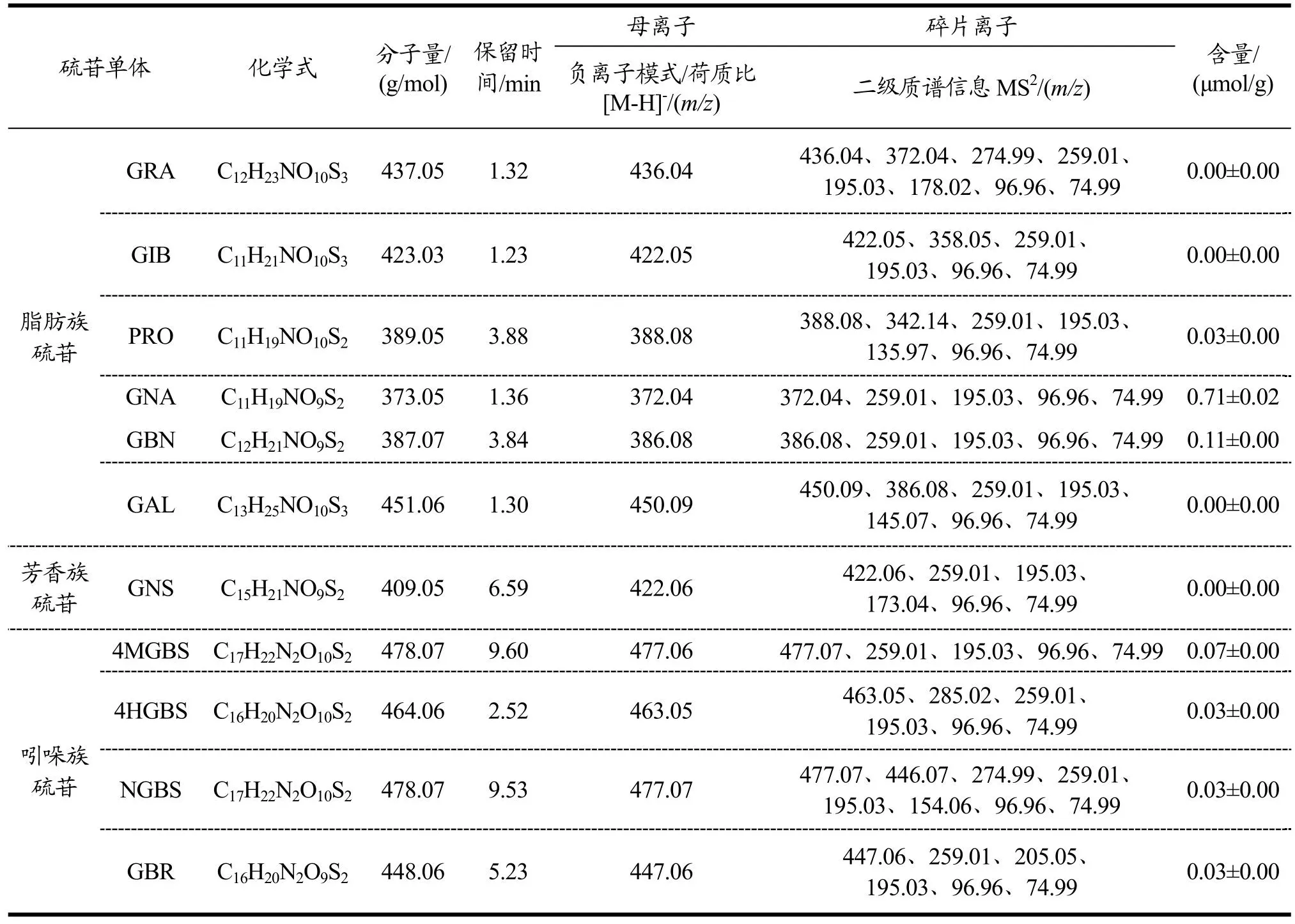
表4 上海青叶柄中硫苷物质鉴定信息Table 4 Identification of glucosinolate profiles in pakchoi petiole
2.5 红色LED光照处理对上海青叶柄硫苷单体含量的影响
上海青中主要的硫苷组分为脂肪族硫苷,而吲哚族硫苷与芳香族硫苷含量都较少,大部分上海青中脂肪族硫苷占硫苷总含量80%以上[29]。与本实验中硫苷单体鉴定结果一致,上海青中脂肪族硫苷含量占总硫苷含量的86.73%。如表5所示,在贮藏期间上海青中各种硫苷均呈下降趋势。上海青叶柄中的主要硫苷GNA和GBN经红色LED光照处理后呈先降低后升高然后缓慢降低的趋势,且在贮藏的第4、6、8天红光处理组显著高于对照组(P<0.05)。对照组中另一个含量较高的单体PRO含量波动不大,红光处理组呈先快速升高后缓慢下降的趋势,且在贮藏的第2~6天显著高于对照组(P<0.05)。但红色LED光照处理对NGBS、4MGBS、4HGBS和GBR含量的影响并不显著。有相似研究[27]指出,光照处理可显著提升果蔬中硫苷物质的含量,如红色LED光照处理可以提高西兰花中萝卜硫苷等主要硫苷物质的含量;Demir等[30]发现红色LED光照能促进萝卜中萝卜硫苷等主要硫苷物质的积累。本实验中,红色LED光照能有效维持上海青叶柄中主要硫苷物质的含量。
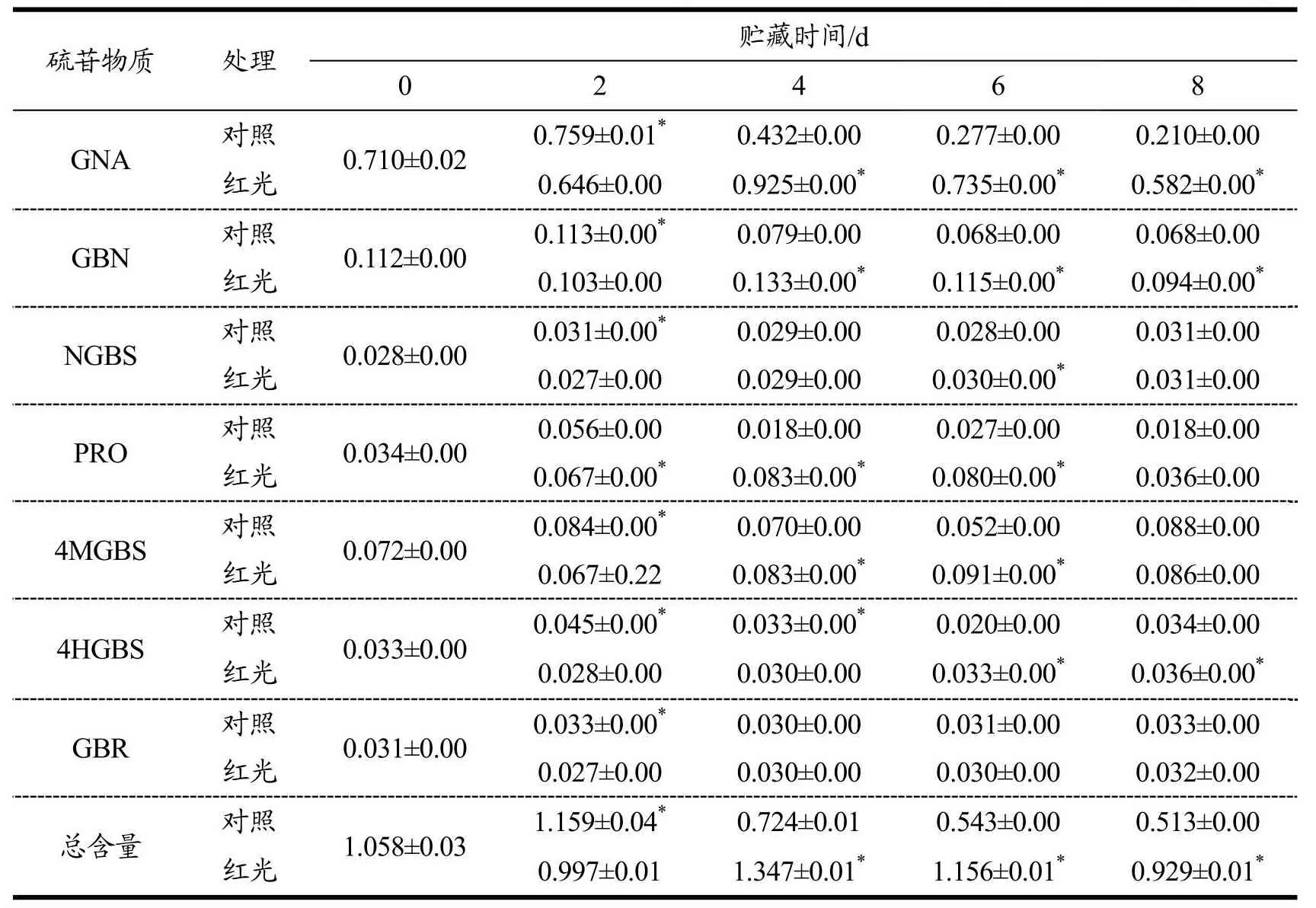
表5 红色光照LED处理对上海青叶柄中硫苷物质含量的影响(μmol/g)Table 5 Effect of red LED irradiation on the content of glucosinolate substances in pakchoi petiole (μmol/g)
2.6 红色LED光照处理对上海青叶柄硫苷水解产物含量的影响
Zeng等[31]已发现,上海青中的异硫氰酸酯主要为3-丁烯基异硫氰酸酯(GNA的水解产物)。与其结果一致,本文得出上海青叶柄和叶片中主要的硫苷水解产物为3-丁烯基异硫氰酸酯,其母离子为113.00,子离子为113.02、85.94、72.01、62.98、45.11、30.11,含量约为0.12 μmol/g。经红光处理后(图4),上海青叶柄中该物质含量呈先升高后下降的趋势,且总体维持在较高水平,但对照组3-丁烯基异硫氰酸酯含量在贮藏期间呈逐渐下降趋势。其原因可能是红色LED光照处理维持了上海青中较高的黑芥子酶活性,从而促进了硫苷物质的水解,由此造成了3-丁烯基异硫氰酸酯的积累。
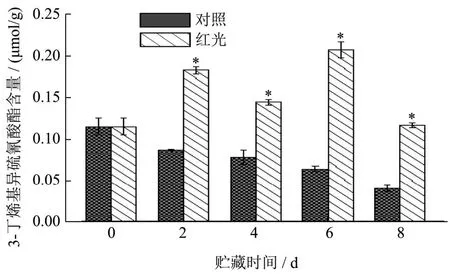
图4 红色LED光照处理对上海青叶柄中3-丁烯基异硫氰酸酯含量的影响Fig.4 Effect of red LED irradiation on content of 3-butenyl isothiocyanate in pakchoi petiole
2.7 红色LED光照处理对上海青叶柄硫苷合成相关基因表达的影响
硫苷在合成过程中一系列反应都由转录因子调控,MYB家族是植物转录因子最大家族之一,MYB28作为脂肪族硫苷合成的关键转录因子[9]。CYP家族可以将细胞色素P450催化为乙醛肟,为硫苷合成的第一步,其中基因CYP83A1可以催化脂肪族的乙醛肟[32]。图5为上海青在贮藏期间脂肪族硫苷合成相关基因表达水平的变化,结果得出,MYB28的表达水平在贮藏时间呈总体下降趋势,且红光处理组在贮藏期间显著高于对照组(P<0.05),尤其在贮藏的第4天和第6天,红光处理组MYB28的表达水平分别是对照组的28.97和11.71倍。基因CYP83A1(图5b)和GSTF11(图5c)的表达水平在经过红光处理后呈先上升后下降的趋势,而对照组中其表达量整体下降,由此在整个贮藏期间,对照组CYP83A1和GSTF11的表达水平皆显著低于红光处理组(P<0.05)。基因UGT74C1(图5d)的表达水平在贮藏期间呈逐渐下降趋势,但红光处理组下降幅度小于对照组,且在整个贮藏期间显著高于对照组UGT74C1的表达水平(P<0.05)。作为硫苷合成的最后一步,不同的基因位点参与硫苷合成的侧链修饰,决定了硫苷结构的多样性[33]。而FMO家族在脂肪族硫苷合成中起关键作用,参与了脂肪族硫苷的合成,本研究中FMOGS-OX5(图5e)的表达水平呈先下降后逐渐上升的趋势,且红光处理显著上调了上海青中FMOGS-OX5的表达量(P<0.05)。有相似研究表明,蓝色LED光照处理通过上调上海青中基因CYP83A1、UGT74C1、GSTF11的表达量来维持上海青中GNA和GBN的含量[34]。因此我们推测,在本实验中,红色LED光照处理可能主要通过上调CYP83A1、UGT74C1、GSTF11和FMOGS-OX5等基因的表达水平来促进上海青中脂肪族硫苷物质合成,进而维持上海青叶柄中总硫苷物质的含量。
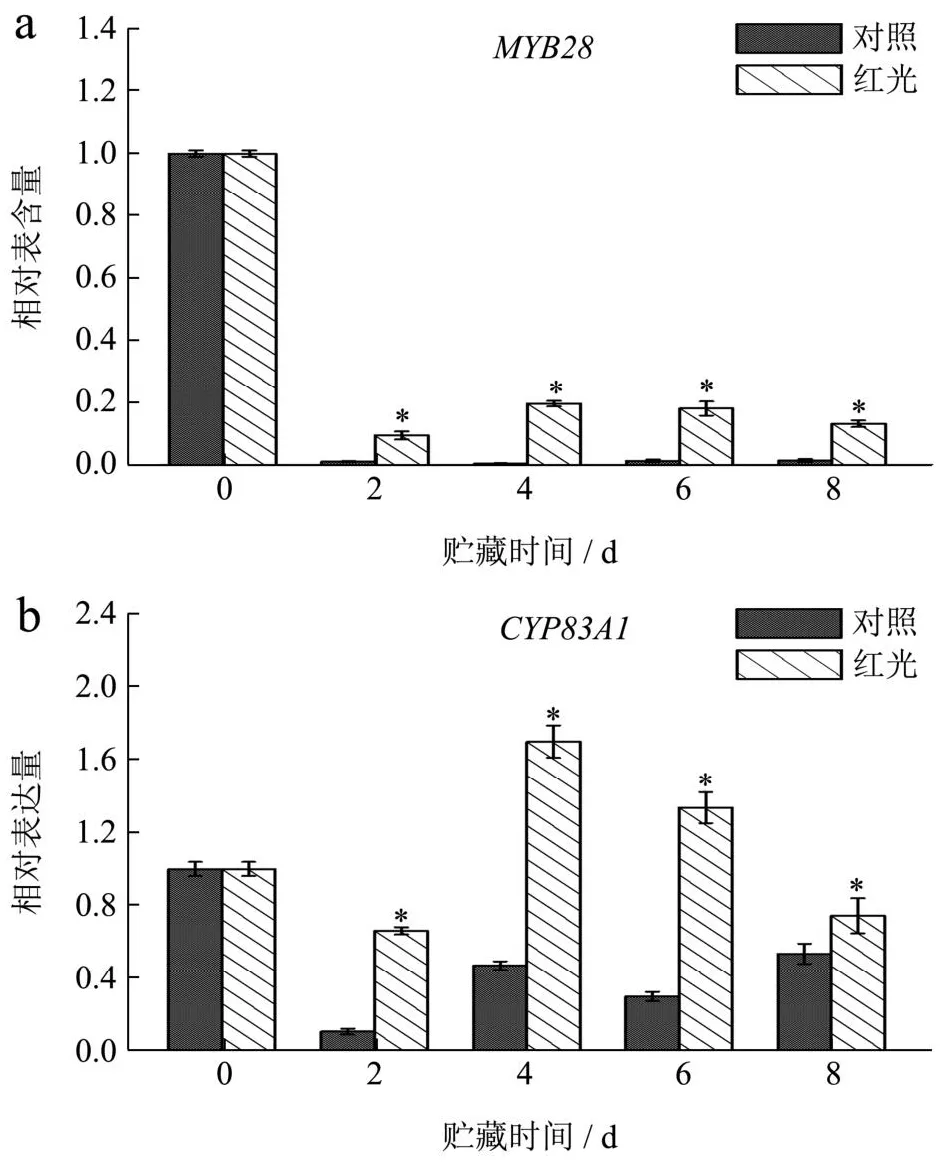
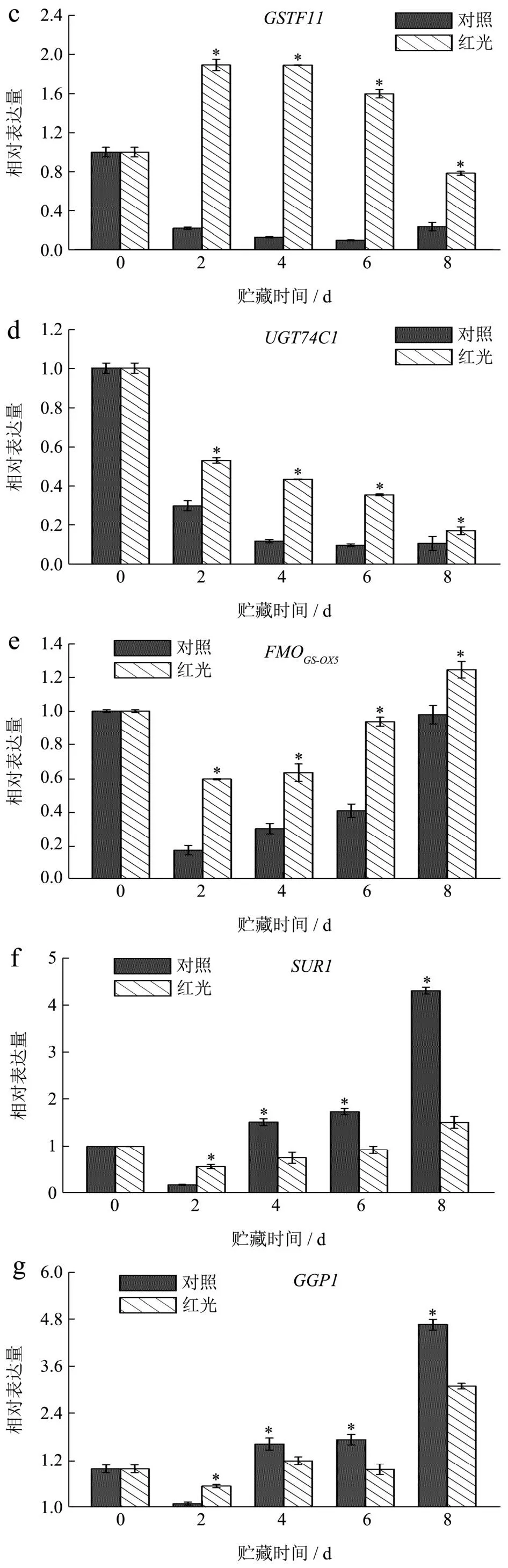
图5 红色LED光照处理对上海青叶柄中硫苷合成相关基因表达水平的影响Fig.5 Effect of red LED light treatment on the expression level of aliphatic glucosinolate synthesis genes in pakchoi petiole
图5f和图5g结果显示,除贮藏第2天外,红光处理显著下调了上海青脂肪族合成通路中的关键基因GGP1和SUR1的表达水平(P<0.05)。其原因可能是,基因CYP83A1的过量表达限制了基因SUR1的表达[35],而基因GGP1不仅参与硫苷代谢还参与降解谷胱甘肽[36],因此,我们推测GGP1的表达主要受上海青中谷胱甘肽降解的影响。同样地,GNA和PRO合成关键基因AOP2(图5h)的表达量虽在贮藏前6天被红光处理显著上调(P<0.05),但在第8天,对照组高出红光处理组143.40%。可能是由于上海青组织中生成的异硫氰酸酯抑制了AOP2的表达[37]。
因此,红色LED光照处理可能主要通过上调上海青硫苷合成密切相关的转录因子MYB28的表达水平来诱导其脂肪族合成关键基因CYP83A1、UGT74C1、GSTF11和FMOGS-OX5等的上调来促进GNA、GBN和PRO的合成,但对AOP2的表达水平的影响不稳定。
3 结论
综上,红色LED光照处理提高了硫苷合成相关基因MYB28、CYP83A1、GSTF11、UGT74C1等的表达水平,促进了其主要硫苷物质GNA、PRO和GBN等的合成,由此维持了上海青中总硫苷的含量;此外,红色LED光照处理还维持了上海青中较高的黑芥子酶活性,促进了硫苷的水解,由此保持了上海青中主要异硫氰酸酯3-丁烯基异硫氰酸酯的含量。因此,红色LED光照处理可通过调控上海青中硫苷合成关键基因和黑芥子酶活性来保持其较高的硫苷和异硫氰酸酯含量,使其在采后仍能保持较高的营养和商业价值,并为上海青的采后保鲜提供理论及技术支持。

