安罗替尼联合抗程序性死亡受体-1抑制剂抑制肺腺癌的可能机制探讨
周泽军, 谢海燕, 张 宇, 石 文, 夏 宁
(南京脑科医院胸科院区/原南京市胸科医院 呼吸一科, 江苏 南京, 210029)
抗程序性死亡-配体1(PD-L1)的免疫治疗在非小细胞肺癌中取得了一系列突破性进展,已有多种药物获批临床适应证[1-4]。然而,并不是所有患者都能从抗PD-L1的免疫治疗中获益。研究[5-6]表明,血管内皮生长因子(VEGF)及血管内皮生长因子受体(VEGFR)介导的肿瘤血管新生在肿瘤免疫逃避中发挥重要作用,而抗VEGF或VEGFR的药物联合抗PD-L1的药物也取得了更好的抗肿瘤效果[7]。作为一个多靶点的激酶抑制剂,安罗替尼的靶点包括VEGFR、血小板衍生生长因子(PDGFR)、成纤维细胞生长因子受体(FGFR)和原癌基因(c-Kit)等,具有抗肿瘤血管生成和抑制肿瘤生长的双重作用[8-9]。本研究探讨安罗替尼是否能够提高程序性死亡受体-1(PD-1)单抗的疗效,现将结果报告如下。
1 资料与方法
1.1 一般材料
LLC细胞系购自上海中科院细胞库,采用RPMI1640培养基+10%胎牛血清培养; 靶向c-Kit的siRNA购自美国Santa Cruz公司,货号sc-29852; siRNA转染相关试剂购自美国Santa Cruz公司; 6周龄雌性C57小鼠购自北京维通利华实验动物技术有限公司,体质量18~22 g, 无特定病原体(SPF)级,动物合格证号为SCXK(京)2006-0009; 安罗替尼,规格为10 mg/粒,国药准字H20180003, 正大天晴药业集团股份有限公司; 抗PD-1单抗购自美国BioXcell公司; 凝胶电泳仪、垂直电泳槽及凝胶成像系统均购自美国Bio-rad公司; 微量紫外可见光分光光度计购自瑞士梅特勒托利多; 细胞裂解液P0013购自碧云天生物; 抗c-Kit、Wnt1 β-catenin、γ干扰素(IFN-γ)、肿瘤坏死因子-α(TNF-α)、PD-L1、c-Myc、c-Jun、GAPDH一抗抗体均购自Cell Signaling Technology; 抗兔、鼠二抗购自美国Affinity公司; Lipofectamine®2000购自美国Invitrogen公司。
1.2 肺癌荷瘤小鼠模型制备及给药
将LLC细胞重悬于磷酸盐缓冲液(PBS), 浓度调整为5×105个/L, 皮下种瘤,接种体积100 μL/只,接种7 d, 肉眼可见接种处有明显的鼓包,提示肺癌荷瘤小鼠制备成功。将制备成功的肺癌小鼠模型随机分为4组,即阴性对照组、安罗替尼组、抗PD-1单抗组、安罗替尼联合抗PD-1单抗组,每组8只。阴性对照组给予灌胃生理盐水,安罗替尼组给予灌胃安罗替尼(剂量为每100 g 16 μg, 1次/d), 抗PD-1单抗组腹腔内注射抗PD-1单抗(剂量为每次按100 g 1 mg, 每3 d注射1次),安罗替尼联合抗PD-1单抗组给予灌胃安罗替尼(剂量为每次100 g 16 μg, 1次/d)和腹腔内注射抗PD-1单抗(剂量为每次按100 g 1 mg, 每3 d注射1次)。所有组别连续治疗25 d。
1.3 指标检测
采用游标卡尺测量各组小鼠接种处的肿瘤直径,并计算肿瘤体积,测量时点为给药0、5、10、15、20、25 d。
1.4 生物信息学分析
基因富集分析(GSEA)在Java 环境下的GSEA 桌面应用中进行(GSEA v4.0.1, http://software.broadinstitute.org/gsea/index.jsp)。22种免疫细胞浸润分析在CIBERSORTx官网的在线工具(https://cibersortx.stanford.edu/)中进行。相关性分析的数据来自肿瘤与癌症基因组图谱(TCGA)数据库中肺腺癌(LUAD)队列。
1.5 Western Blot实验
在转染前1 d, 将对数生长期的LLC细胞从培养皿中消化、重悬,细胞计数后按每孔 1×106个细胞接种于6孔板中,在培养基中培养过夜,待6孔板细胞密度达到约70%时,根据Lipofectamine 2000说明书转染。转染48 h后分组,其中对照组为正常LLC细胞, si-c-Kit组为siRNA敲低c-Kit表达,安罗替尼处理组为安罗替尼处理LLC细胞。提取各组细胞总蛋白,采用细胞裂解液裂解,待细胞完全裂解后置于离心机中离心,收集上清液于EP管中,采用BCA蛋白检测试剂盒测定细胞总蛋白浓度。蛋白变性处理,进行SDS-PAGE电泳。蛋白电泳分离后转胶至PVDF膜上,脱脂牛奶封闭。加入一抗c-Kit、Wnt1、β-catenin、IFN-γ、TNF-α、PD-L1、c-Myc、c-Jun、GAPDH单克隆抗体,工作浓度均为1∶1 000, 4 ℃孵育过夜,将HRP标记的二抗加入到溶液中,继续孵育2 h, 曝光成像。GAPDH为内参。
1.6 统计学分析
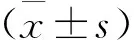
2 结 果
2.1 安罗替尼联合PD-1单抗对肺癌小鼠肿瘤体积的影响
与阴性对照组比较,安罗替尼组、PD-1单抗组、安罗替尼联合PD-1单抗组均可抑制肿瘤的生长,差异有统计学意义(P<0.05); 与安罗替尼组、PD-1单抗组比较,安罗替尼联合PD-1单抗可抑制肿瘤的生长,差异有统计学意义(P<0.05)。见图1。

A: 各组肺癌小鼠肿瘤体积比较; B: 各组肺癌小鼠肿瘤体积的变化图。 图1 各组肺癌小鼠肿瘤体积的变化
2.2 c-Kit和VEGFR的GSEA
GSEA结果表明, c-Kit低表达样本IFN-γ通路富集,差异有统计学意义(P<0.05)(图2A), c-Kit高表达样本Wnt/β-catenin通路富集,差异有统计学意义(P<0.05)(图2B),提示安罗替尼抑制c-Kit可能通过调节IFN-γ通路和Wnt/β-catenin通路提高了PD-1单抗抑制肺癌小鼠肿瘤体积的疗效。VEGFR高表达的样本肿瘤血管生成通路和IL-6/JAK/STAT3通路富集,差异有统计学意义(P<0.05)(图2C、2D), 提示安罗替尼抑制VEGFR可能通过抑制血管生成和IL-6/JAK/STAT3通路提高了PD-1单抗抑制肺癌小鼠肿瘤体积的疗效。

A: c-Kit低表达样本IFN-γ通路富集; B: c-Kit高表达样本Wnt/β-catenin通路富集; C: VEGFR高表达的样本肿瘤血管生成通路富集; D: VEGFR高表达的样本IL-6/JAK/STAT3通路富集。图2 c-Kit和VEGFR的GSEA
2.3 c-Kit和VEGFR对肿瘤淋巴细胞浸润的影响
本研究分析了c-Kit和VEGFR对肿瘤组织中淋巴细胞浸润的影响。通过CIBERSORTx, 计算TCGA数据库中LUAD队列的不同c-Kit和VEGFR表达的样本中22种淋巴细胞的浸润比例,结果显示(图3), 相较于c-Kit高表达(高于或等于表达中位数), c-Kit低表达(低于表达中位数)样本中有更多的M1型巨噬细胞、M0型巨噬细胞、活化的NK细胞及更少的剩余记忆性CD4 T细胞、浆细胞和Naïve B细胞,差异均有统计学意义(P<0.05)。相较于VEGFR高表达(高于或等于表达中位数),VEGFR低表达(低于表达中位数)样本中有更多的活化的NK细胞、滤泡辅助性T细胞、活化的记忆性CD4 T细胞、CD8 T细胞及更少的M2型巨噬细胞、剩余未活化的NK细胞、记忆性B细胞,差异均有统计学意义(P<0.05)。c-Kit和VEGFR低表达均伴随着更多的抗肿瘤免疫细胞, c-Kit和VEGFR高表达则伴随着更多的免疫抑制细胞。

图3 c-Kit和VEGFR对肿瘤淋巴细胞浸润的影响
在TCGA数据库的LUAD队列中, c-Kit与颗粒酶A(GZMA)、颗粒酶 B(GZMB)、IFN-γ等促免疫分子呈负相关(r<0,P<0.05)(图4A、4B、4C), 与CD274(PD-L1)、转化生长因子β(TGF-β)、T细胞免疫球蛋白结构域和粘蛋白结构域-3(TIM3)等免疫抑制分子呈正相关(r>0,P<0.05)(图4D、4E、4F)。

A: c-Kit与GZMA的相关性; B: c-Kit与GZMB的相关性; C: c-Kit与IFN-γ的相关性; D: c-Kit与CD274的相关性; E: c-Kit与TGF-β的相关性; F: c-Kit与TIM3的相关性。图4 c-Kit与免疫分子的相关性
VEGFR与GZMA、TNF-α、GZMB、IFN-γ等免疫促进分子均呈负相关(r<0,P<0.05) (图5A、5B、5C、5D), 与CD274(即PD-L1)、TIM3、PD-1、低氧诱导因子-1A(HIF1A)、淋巴细胞激活基因-3 (LAG3)、TGF-β、细胞毒T淋巴细胞相关抗原4 (CTLA4)等免疫抑制分子均呈正相关(r>0,P<0.05)(图5E、5F、5G、5H、5K)。上述结果表明,安罗替尼抑制c-Kit和VEGFR, 有可能抑制相关免疫抑制分子,促进免疫促进分子的表达。

A: VEGFR与GZMA的相关性; B: VEGFR与TNF-α的相关性; C: VEGFR与GZMB的相关性; D: VEGFR与IFN-γ的相关性; E: VEGFR与CD274的相关性; F: VEGFR与TIM3的相关性; G: VEGFR与PD-1的相关性; H: VEGFR与HIF1A的相关性; I: VEGFR与LAG3的相关性; J: VEGFR与TGF-β的相关性; K: VEGFR与CTLA4的相关性。图5 VEGFR与免疫分子的相关性
2.4 安罗替尼通过抑制Wnt/β-catenin通路促进肿瘤免疫
c-Kit对于免疫微环境的调控作用尚不明确,在LLC细胞系中用siRNA敲低c-Kit表达,并与安罗替尼处理后的细胞进行对比。基于图2中的GSEA结果,分析c-Kit对Wnt/β-catenin通路及相关免疫分子表达的影响。Western Blot实验证实,采用siRNA抑制c-Kit可降低Wnt1和β-catenin的表达, Wnt/β-catenin通路的下游分子c-Myc、c-Jun的表达也受到抑制, IFN-γ和TNF-α等抗肿瘤免疫的表达则升高, PD-L1的表达降低,差异均有统计学意义(P<0.05)。采用安罗替尼处理细胞的结果与采用siRNA 敲低c-Kit表达的结果类似,但安罗替尼不改变c-Kit表达,差异无统计学意义(P>0.05)。见图6。

图6 安罗替尼通过抑制Wnt/β-catenin通路促进肿瘤免疫
3 讨 论
虽然抗PD-L1的免疫检查点抑制剂在非小细胞肺癌中取得了突破性进展[1, 4, 10], 但仍有相当一部分患者不能从中获益或者获益较少。研究[7]表明,抗PD-L1的免疫检查点抑制剂阿替利珠单抗联合含铂双药后,再联合抗血管生成的药物贝伐珠单抗,可以进一步提高非鳞非小细胞肺癌患者的疗效,延长了无进展生存期,为抗PD-L1的免疫检查点抑制剂联合其他靶向药物提供了新的实例。
作为一个靶向VEGFR、PDGFR、FGFR和c-Kit等多靶点的抑制剂,安罗替尼具有抗肿瘤血管生成和抑制肿瘤的双重作用[8-9]。本研究通过LLC细胞荷瘤小鼠实验证实,与安罗替尼组、PD-1单抗组相比,安罗替尼联合PD-1单抗连续给药25 d可显著抑制肿瘤的生长,差异有统计学意义(P<0.05)。基于TCGA数据库中LUAD队列的生物信息学分析表明, c-Kit和VEGFR与免疫抑制通路、免疫抑制细胞的浸润及免疫相关分子的表达均存在线性关系。Western Blot实验亦表明,安罗替尼或敲低c-Kit表达均可以抑制LLC细胞的Wnt/β-catenin通路,并促进IFN-γ、TNF-α的表达,抑制PD-L1的表达,该结果印证了LUAD队列的生物信息学分析结果,即安罗替尼通过靶向c-Kit抑制Wnt/β-catenin通路调节免疫微环境,促进抗肿瘤免疫细胞浸润,提高了抗PD-1单抗抑制肿瘤生长的疗效。
本研究不足之处: 本研究仅进行了生物信息学预测与Western Blot实验,未能从机制方面说明安罗替尼通过抑制VEGFR/c-Kit调控Wnt/β-catenin通路在肺腺癌中的调控及安罗替尼通过抑制Wnt/β-catenin通路促进肿瘤免疫,因此有后续研究有必要增加靶向细胞转染相关的研究进行验证。
综上所述,安罗替尼联合抗PD-1药物可以更好地抑制肿瘤生长,其可能机制是安罗替尼通过靶向c-Kit抑制Wnt/β-catenin通路调节免疫微环境,促进抗肿瘤免疫细胞浸润,有助于提高抗PD-1单抗抑制肿瘤生长的疗效。

