基于HSP27-TLR4/NF-κB通路的芪参颗粒对大鼠心肌梗死后炎症反应的影响
于藜爽 ,郭淑贞 ,黄梦莹 ,王晓平 ,张亚雯 ,洪艺勤 ,王勇 ,卢令慧
1.北京中医药大学中医学院,北京 102488; 2.北京中医药大学生命科学学院,北京 102488
心肌梗死是一种严重的心血管疾病,是心源性死亡的主要原因[1]。及时的血运重建和随后的治疗策略可显著降低急性心肌梗死的病死率,但缺血性心脏病仍是心力衰竭的主要病因,远期预后堪忧[2]。心肌梗死后心力衰竭的发生发展与炎症反应等因素密切相关[2]。心肌梗死早期的炎症反应是必要的、有益的,但炎症反应失控则会加重心室不良重塑,导致重大不良临床事件发生[3]。近年来,针对炎症途径和介质的抗炎治疗策略在多项临床试验中取得了一定进展,同时指出,研究工作应着眼于多途径抑制,以及靶向引发炎症过程的上游介质[4]。
热休克蛋白27(HSP27)是小型的HSP家族成员,在心脏中高表达,参与心脏相关的大量生理病理过程。多种刺激如氧化应激、细胞因子、炎症因子等都可诱导HSP27表达从而增强耐受性[5]。临床数据显示,血液中HSP27表达在心力衰竭患者中显著升高,是患者死亡或非计划再入院的独立预测因子[6]。细胞外HSP27可激活Toll样受体(TLR)依赖的机制,进一步激活核因子-κB(NF-κB)通路,从而引发冠状动脉内皮细胞炎症反应,加速心肌缺血再灌注后心功能不全[7]。其中TLR4介导TLR4/NF-κB炎症反应信号通路,通过调节心肌细胞氧化应激和凋亡[8]、心肌纤维化[9]等参与心肌梗死后心力衰竭相关病理进程。芪参颗粒是北京中医药大学王伟教授针对心力衰竭“虚”“毒”“瘀”的病机要点,以真武汤和四妙勇安汤为基础化裁,全方具有益气温阳、活血解毒之功。课题组前期研究发现,芪参颗粒可以改善缺血心肌的氧化应激水平,减少促炎因子生成,抑制心室重构,改善心脏功能等[10-12]。本研究进一步探讨其作用是否与调控血液HSP27含量、促进TLR4/NF-κB介导的炎症反应有关。
1 材料与方法
1.1 动物
SPF级健康雄性SD大鼠48只,体质量(200±10)g,斯贝福(北京)生物技术有限公司提供,动物许可证号SCXK(京)2019-0010。饲养于(22±2)℃、湿度40%~60%环境,12 h明暗交替,自由进食饮水。本实验经北京中医药大学伦理委员会审查批准(BUCM-4-2021110901-4044)。
1.2 药物及制备
芪参颗粒(炙黄芪30 g,丹参15 g,玄参10 g,金银花10 g,黑顺片9 g,炙甘草6 g),饮片购自北京同仁堂股份有限公司。由中日友好医院经水提、醇沉、干燥等工艺加工成冻干粉,出膏率为25.2%,低温冷藏室密封保存。
1.3 主要试剂与仪器
HSP27检测试剂盒(货号SEA693Ra,武汉云克隆),NF-κB p65抗体(货号ab16502,英国Abcam),TLR4抗体(货号bs-20594R,北京博奥森),β-actin单克隆抗体(货号HRP-66009,美国Proteintech),HRP标记二抗(货号sc-2357,美国Santa Cruz),ECL PLUS超敏发光液(货号P1050-100,北京普利莱)。ALC-V8S小动物呼吸机、Vevo2100小动物超声影像系统,加拿大Visual Sonics;BSA224S电子分析天平,德国Sartorious;Pannoramic Scan扫描仪,匈牙利3DHISTECH;A009超分辨显微组织成像系统,德国Leica;SpectraMax Paradigm多功能微孔读板机,美国Molecular Devices;小型垂直电泳转印系统,美国Bio-Rad;C600多功能激光荧光分子成像系统,美国Azure Biosystems。
1.4 分组、造模及给药
48只大鼠适应性饲养1周后,进行左冠状动脉前降支结扎术或假手术。手术方法参照前期操作[13],1%戊巴比妥钠麻醉,用16G静脉留置针经口行气管插管,连接呼吸机,潮气量4.5~6 mL,心率80次/min,呼吸比1∶2。左前胸备皮,消毒,从3~4肋间隙逐层开胸,暴露心脏,于左心耳下1 mm处结扎左冠状动脉前降支,结扎表面滴利多卡因预防室颤。逐层关胸,脱机,腹腔注射0.2 mL呋塞米,置保温毯上苏醒。假手术行相同开胸术,仅套线不结扎。术后24 h将存活假手术大鼠随机分为对照组和芪参颗粒对照组,造模大鼠分为模型组和芪参颗粒组,芪参颗粒对照组和芪参颗粒组灌胃相当于人临床等效剂量的芪参颗粒水溶液(2.352 g/kg),对照组和模型组予等体积蒸馏水,每日1次,连续1周。
1.5 指标检测
1.5.1 超声心动图
给药结束后,1%戊巴比妥钠麻醉大鼠,备皮,行超声心动分析。使用MS250探头探查大鼠心脏短轴乳头肌层面,分别采集大鼠B型及M型超声心动图动态影像。用Vevo2100软件测量左室舒张末期前壁厚度(LVAWd)、左室收缩末期前壁厚度(LVAWs)、左室舒张末期内径(LVIDd)、左室收缩末期内径(LVIDs)、左室舒张末期后壁厚度(LVPWd)、左室收缩末期后壁厚度(LVPWs),每只大鼠测量3个心动周期,结果取平均值。系统自动计算射血分数(EF)、短轴缩短率(FS)、左室舒张末期容积(LVEDV)、左室收缩末期容积(LVESV)。超声操作与数据分析均以盲法进行。
1.5.2 心、肺脏器系数检测
取材前称量大鼠体质量(BM),麻醉后经腹主动脉采血,迅速摘取完整的心脏和肺脏,预冷PBS漂洗,排出心腔内残留血液。心脏、肺脏置于冰盘上剔除多余组织,滤纸吸干表面水分,电子分析天平分别称量心脏质量(HM)、肺脏质量(LM)。分离大鼠右下肢胫骨,剥离皮毛后用游标卡尺测量胫骨长度(TL),计算HM/BM、HM/TL、LM/BM、LM/TL,用于辅助评估心力衰竭和肺水肿程度。
1.5.3 心肌组织病理学检测
心脏于结扎线下5 mm处横向切开,取心底部置于4%多聚甲醛固定,石蜡包埋,5 μm切片,进行麦胚凝集素(WGA)荧光染色、HE和Masson染色。用超分辨显微组织成像系统扫描切片,用Caseviewer软件观察心肌结构、炎症及纤维化改变。
1.5.4 ELISA检测
使用EDTA抗凝管采集腹主动脉血,常温静置2 h,4 ℃、3 000 r/min离心10 min,取上清液,按试剂盒说明书检测HSP27含量。
1.5.5 Western blot检测
取30 mg心肌组织,加RIPA裂解液(100 mg/mL)和研磨珠充分裂解,离心,取上清液,BCA法进行蛋白定量,加入loading buffer制备样品,经10%聚丙烯酰胺凝胶电泳(恒压80 V),300 mA转膜60 min;用5%脱脂奶粉室温封闭1 h,将膜分别放入TLR4一抗(1∶1 000)、NF-κB p65一抗(1∶1 000)、β-actin一抗(1∶10 000),4 ℃过夜,TBST洗3次,每次5 min;加二抗(1∶7 500),室温摇床孵育60 min,TBST洗3次,每次10 min,ECL发光液曝光显影,Image J 6.0软件测量灰度值,以β-actin为内参,计算目的蛋白相对表达量。
1.6 统计学方法
2 结果
2.1 芪参颗粒对模型大鼠心功能的影响
与对照组比较,模型组大鼠LVAWd、LVAWs、LVPWd、LVPWs、EF和FS显著降低(P<0.01),LVIDd、LVIDs、LVEDV、LVESV显著升高(P<0.05,P<0.01);与模型组比较,芪参颗粒组大鼠LVAWs、LVPWd、EF和FS显著升高,LVIDs、LVESV显著降低(P<0.05,P<0.01)。芪参颗粒对照组与对照组比较,各指标差异无统计学意义(P>0.05)。见表1。
表1 心功能指标各组大鼠比较(,每组7~10只)

表1 心功能指标各组大鼠比较(,每组7~10只)
注:与对照组比较,*P<0.05,**P<0.01;与模型组比较,#P<0.05,##P<0.01
指标LVAWd/mm LVAWs/mm LVIDd/mm LVIDs/mm LVPWd/mm LVPWs/mm LVEDV/μL LVESV/μL EF/%FS/%芪参颗粒组1.78±0.62 2.50±0.91#6.86±1.09 4.42±1.22#2.28±0.32##2.97±0.39 251.26±93.48 97.13±53.59#62.15±17.11#35.99±13.68#对照组2.21±0.31 3.71±0.60 5.79±0.38 2.04±0.99 2.21±0.24 3.67±0.48 166.60±24.10 18.12±13.11 89.78±7.03 65.44±15.98芪参颗粒对照组2.01±0.37 3.87±0.40 6.17±0.92 1.97±0.93 2.03±0.23 3.41±0.25 196.83±65.24 16.64±14.94 92.81±5.36 69.31±11.61模型组1.39±0.53**1.57±0.63**7.68±1.06*5.89±1.05**1.80±0.16**2.87±0.43**320.97±102.05**178.81±77.21**45.59±5.64**23.61±3.25**
2.2 芪参颗粒对模型大鼠心、肺脏器系数的影响
各组大鼠HM/BM、HM/TL、LM/BM、LM/TL差异无统计学意义(P>0.05),见表2。
表2 各组大鼠脏器系数比较()

表2 各组大鼠脏器系数比较()
组别对照组芪参颗粒对照组模型组芪参颗粒组只数8 10 7 8 HM/BM(mg/g)3.38±0.35 3.21±0.28 3.33±0.27 3.43±0.24 HM/TL(mg/mm)17.84±1.04 18.03±2.81 17.71±1.97 17.79±0.68 LM/BM(mg/g)4.28±0.34 4.22±0.29 4.24±0.44 3.15±2.16 LM/TL(mg/mm)22.69±2.58 23.42±3.67 22.55±2.82 22.59±1.75
2.3 芪参颗粒对模型大鼠心肌组织病理变化的影响
WGA免疫荧光染色可标记细胞轮廓。结果显示,与对照组比较,模型组大鼠心肌梗死边缘区细胞横截面积显著增加,可能存在代偿性肥大,芪参颗粒组梗死边缘区细胞横截面积较模型组显著减少,见图1。
HE染色结果显示,对照组和芪参颗粒对照组大鼠心肌组织小动脉周围心肌纤维排列整齐,形态正常;模型组大鼠心肌组织小动脉周围有大量炎性细胞浸润,心肌细胞死亡后被结缔组织填充,残存心肌细胞代偿性肥大;与模型组比较,芪参颗粒组大鼠心肌组织炎性细胞浸润和心肌细胞存活情况显著改善。见图2。
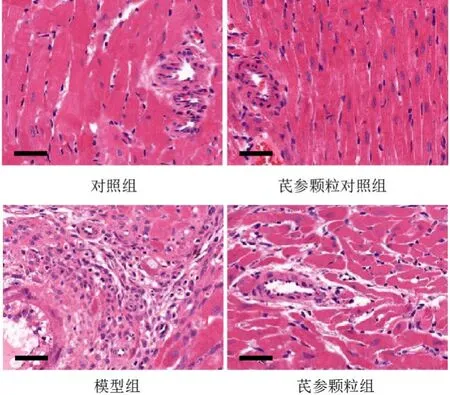
图2 各组大鼠心肌组织形态(HE染色,标尺=40 μm)
Masson染色结果显示,对照组和芪参颗粒对照组大鼠心肌间质仅有极少量蓝染的胶原纤维,而模型组大鼠心肌梗死边缘区心肌间质内可见大量蓝色胶原纤维;与模型组比较,芪参颗粒组大鼠心肌梗死边缘区心肌间质纤维化情况显著改善。见图3。

图3 各组大鼠心肌组织形态(Masson染色,标尺=200 μm)
2.4 芪参颗粒对模型大鼠血浆热休克蛋白27含量的影响
与对照组比较,芪参颗粒对照组大鼠血浆HSP27含量差异无统计学意义(P>0.05),模型组大鼠血浆HSP27含量显著增加(P<0.01);与模型组比较,芪参颗粒组大鼠血浆HSP27含量显著减少(P<0.01)。见表3。
表3 各组大鼠血浆HSP27含量比较(,ng/mL)

表3 各组大鼠血浆HSP27含量比较(,ng/mL)
注:与对照组比较,**P<0.01;与模型组比较,##P<0.01
HSP27 45.57±1.37 44.53±1.21 48.20±1.26**45.27±0.78##组别对照组芪参颗粒对照组模型组芪参颗粒组只数6 6 6 6
2.5 芪参颗粒对模型大鼠心肌组织Toll样受体4、核因子-κB p65蛋白表达的影响
与对照组比较,模型组大鼠心肌组织TLR4、NF-κB p65蛋白表达显著升高(P<0.05);与模型组比较,芪参颗粒组大鼠心肌组织TLR4、NF-κB p65蛋白表达显著降低(P<0.05)。见图4、表4。

图4 各组大鼠心肌组织TLR4、NF-κB p65蛋白免疫印迹
表4 各组大鼠心肌组织TLR4、NF-κB p65蛋白表达比较()

表4 各组大鼠心肌组织TLR4、NF-κB p65蛋白表达比较()
注:与对照组比较,*P<0.05;与模型组比较,#P<0.05
NF-κB p65 1.00±0.19 0.87±0.32*1.47±0.15#0.93±0.27*组别对照组芪参颗粒对照组模型组芪参颗粒组只数3 3 3 3 TLR4 1.00±0.29 0.76±0.07*1.84±0.54#0.99±0.25*
3 讨论
心肌梗死属中医学“胸痹”“真心痛”范畴。中医学认为,在心肌梗死发展至心力衰竭的过程中,气虚血瘀是基本病机,阴阳失调是疾病发展的基础,痰饮水停是疾病发展的病理产物[14]。芪参颗粒由炙黄芪、黑附片、丹参、玄参、金银花、炙甘草组成,具有益气温阳、活血解毒功效。临床研究显示,芪参颗粒治疗慢性心力衰竭安全有效,可降低N-末端脑钠肽前体,改善患者心功能分级,减轻心力衰竭症状等[15]。基础研究发现,芪参颗粒可降低炎症因子水平,从而改善心脏功能[16]。本研究通过超声评价大鼠心功能、病理染色观察心脏结构,发现芪参颗粒可以改善心肌梗死大鼠早期收缩功能下降和梗死边缘区心肌细胞代偿性肥大,减轻小动脉及肌纤维间质炎性细胞浸润和纤维化程度。
HSP27在心肌细胞中高表达,尽管细胞内的HSP27被认为是增强应激耐受从而发挥保护作用的重要分子,但心肌损伤时HSP27会从心肌细胞释放入血,目前尚不明确其释放机制是主动分泌还是被动渗漏。血液HSP27水平升高与心肌梗死后心力衰竭关系密切,研究发现,HSP27水平与左心室收缩、舒张功能呈负相关,与LVIDd、纽约心脏病协会分级、N-末端脑钠肽前体水平呈正相关[17-18]。除与心肌损伤程度相关外,血浆HSP27水平还与心血管疾病预后密切相关,且已经成为慢性心力衰竭患者预后、死亡或非计划再入院的独立预测因子[6]。
有研究表明,人和小鼠心肌细胞响应缺血应激后释放HSP27,而细胞外HSP27作为一种炎症介质主要通过激活TLR4/NF-κB通路诱导心脏和血管炎症反应,从而加速心肌损伤[7]。TLR4/NF-κB信号通路是一种与炎症免疫密切相关的转导通路,在组织炎症的发生发展中起重要作用。TLR4是模式识别受体家族的成员,可识别病原体相关分子,激活NF-κB等转录因子,启动多种促炎细胞因子表达,如白细胞介素-1、白细胞介素-6和肿瘤坏死因子-α等,持续加重心肌炎症反应[19]。靶向TLR4抗炎成为延缓心力衰竭进展的新策略,如临床常用抗心力衰竭药物卡维地洛可抑制TLR4介导的心肌炎症[20]。TLR4/NF-κB通路还可调节上游炎症,从而成为炎症调节的枢纽和关键因素。炎症持续增强会扩大梗死面积、降低心肌收缩力、减少心输出量,加速心室重构及心力衰竭进展[21]。本研究通过ELISA检测发现,模型组大鼠血浆HSP27含量增加,心肌组织TLR4、NF-κB p65蛋白表达升高,提示该炎症通路被激活,可能介导持续的炎症反应,加重心肌损伤;芪参颗粒可明显降低模型大鼠血浆HSP27水平,下调心肌组织TLR4、NF-κB p65蛋白表达,提示芪参颗粒可有效减少心肌HSP27释放,阻断由其介导的TLR4/NF-κB炎性信号通路的激活,这可能是芪参颗粒发挥心肌保护作用的机制之一。另外芪参颗粒对照组结果显示,芪参颗粒亦可显著降低正常大鼠心肌组织TLR4、NF-κB p65蛋白表达,不排除芪参颗粒直接下调该通路发挥抗炎作用,显示了中药复方多靶点协同增效的特性。
综上,芪参颗粒可下调心肌梗死大鼠血浆HSP27含量,进而抑制TLR4/NF-κB通路介导的心肌梗死早期炎症反应,减轻梗死边缘炎性细胞浸润、心肌细胞代偿性肥大和心肌间质纤维化等病理改变,进而改善心脏结构和收缩功能。

