麻黄细辛附子汤对尘螨变应原Der p1诱导的鼻黏膜上皮细胞屏障损伤的影响
倪钰莹,范淑月,崔颖,高婧,罗再奕,刘敏
北京中医药大学,北京 100029
变应性鼻炎(allergic rhinitis,AR)是由IgE介导、Th2细胞驱动、针对吸入性变应原反应引起的鼻黏膜炎症性疾病[1]。诱发AR的因素主要有尘螨、花粉、霉菌等[2]。鼻黏膜上皮细胞是抵御病原体入侵和过敏原渗透的第一道生理屏障。紧密连接位于上皮细胞顶端,参与细胞旁运输的调节,对维持上皮屏障功能具有关键作用[3]。上皮屏障受损可以促进上皮细胞的旁转运,增加变应原渗入,诱导IgE产生,触发肥大细胞脱颗粒,从而导致AR发生发展[4]。RhoA/ROCK信号通路参与调节多种细胞功能,如细胞收缩、黏附、迁移等[5]。RhoA/ROCK通路激活可以诱导细胞周围F-肌动蛋白(F-actin)细胞骨架的动态重组和收缩,改变紧密连接的结构和功能,增加细胞旁通透性[6]。因此,保护上皮细胞屏障功能以减少变应原渗入可能是防治AR的重要策略。
AR属中医学“鼻鼽”“鼽嚏”等范畴,病机多为肺经感寒、肾阳虚衰。麻黄细辛附子汤出自《伤寒论》,由麻黄、细辛、附子组成,有散寒通窍、温阳固表之效,对防治AR效果显著[7-8]。麻黄轻扬发散,善宣肺气、开腠理、透毛窍,是治疗AR常用药。课题组前期研究发现,麻黄细辛附子汤在AR适应性免疫方面,可以调控T细胞细胞因子和转录因子表达,逆转Th2偏移,恢复Th1/Th2动态平衡[9-10];在固有免疫方面,可以下调树突状细胞抗原提呈能力[11-12],抑制2型固有淋巴细胞功能发挥[13]。此外,在麻黄细辛附子汤及其拆方干预T细胞研究中发现,麻黄单用也具有显著免疫调节作用[9]。本实验通过尘螨变应原Der p1诱导鼻黏膜上皮细胞屏障损伤,进一步探讨麻黄细辛附子汤及麻黄的屏障保护作用及其潜在机制,为临床治疗AR提供实验依据。
1 实验材料
1.1 细胞
人鼻黏膜上皮细胞(HNEpC)由北纳生物提供,货号356247。
1.2 药物及制备
麻黄细辛附子汤由麻黄、细辛、附子按6∶3∶9比例组成,饮片购于北京仟草中药饮片有限公司。常规方法煎煮,浓缩,制成1 g/mL水煎液,4 ℃、12 000×g离心30 min,收集上清液,0.22 μm滤器过滤后置于-20 ℃冰箱保存备用。称取适量麻黄,同法制成1 g/mL麻黄水煎液,离心,过滤后于-20 ℃冰箱保存备用。
1.3 试剂与仪器
MEM培养基(上海逍鹏生物公司,货号C3050),胎牛血清(美国HyClone公司,货号SH30406.05),不含酚红MEM培养基(武汉普诺赛公司,货号PM150418),尘螨变应原Der p1(美国Greer Lab,货号XPB91D3A2.5),ROCK抑制剂Y-27632(美国Selleck公司,货号S1049),FITC-Dextran(上海源叶生物,货号S28503),CCK-8试剂盒(北京兰博利德公司,货号CK001),BCA蛋白定量试剂盒(江苏凯基生物,货号KGP902),咬合蛋白(Occludin)、闭合蛋白1(Claudin-1)抗体(北京博奥森生物公司,货号bs-10011R、bsm-52037M),RhoA、ROCK1抗体(武汉三鹰生物,货号10749-1-AP、21850-1-AP),抗荧光衰减封片剂(北京索莱宝,货号S2110)。二氧化碳恒温培养箱(美国Thermo公司,型号3111),Millicell电阻测量仪(美国Millipore公司,型号ESR-2),酶标仪(美国Thermo公司,型号Varioskan LUX),荧光显微镜(美国Echo公司,型号Revolve),化学发光成像系统(上海天能公司,型号5200)。
2 实验方法
2.1 造模浓度及时间筛选
HNEpC以MEM完全培养基(含10%胎牛血清、1%双抗),置于37 ℃、5%CO2培养箱内培养,0.25%胰蛋白酶消化传代。取对数生长期细胞,接种于Transwell板,将细胞分为对照组和Der p1组,待细胞融合至单层后,PBS清洗2遍,换不含血清培养基饥饿培养12 h,对照组正常培养,Der p1组加入终浓度为1、5、10 μg/mL Der p1(基础培养基配制)培养1、6、12、24 h,检测细胞标准化跨膜电阻(TER)及FITCDextran通透性,确定造模浓度及造模时间。
2.2 CCK-8法筛选最佳干预浓度
将HNEpC以5×104个/孔接种于96孔板中,置培养箱中培养24 h。空白组只加培养基不含细胞,对照组加入培养基正常培养,麻黄细辛附子汤组和麻黄组分别加入0.5、1、2、5、10 mg/mL麻黄细辛附子汤或麻黄水煎液(基础培养基配制)培养24 h。每孔加入CCK-8溶液10 μL,培养箱内避光孵育30 min,酶标仪波长450 nm处测定各孔吸光度(A),计算细胞存活率。存活率(%)=(A给药组-A空白组)÷(A对照组-A空白组)×100%。
2.3 细胞分组及处理
将细胞分为对照组、模型组、麻黄组、抑制剂组和麻黄细辛附子汤低、中、高剂量组,每组3个复孔。对照组正常培养,其余各组加入10 μg/mL Der p1造模,麻黄组同时加入0.5 mg/mL麻黄水煎液,抑制剂组造模前加入10 μmol/L Y-27632预处理4 h,麻黄细辛附子汤低、中、高剂量组造模同时加入0.5、1、2 mg/mL麻黄细辛附子汤水煎液,分别置于培养箱中培养24 h,显微镜下观察细胞形态变化。
2.4 细胞跨膜电阻测定
HNEpC以1.5×105个/孔接种于12孔Transwell上室,每孔500 μL,下室加入1 mL完全培养基,待细胞融合成单层后,饥饿培养12 h,再按“2.3”项下方法处理,另设2个空白孔(只含培养基、不含细胞)。干预结束后,细胞电阻仪检测电阻值,计算TER。TER=(测定电阻值-空白电阻值)×有效滤膜面积(1.12 cm2)。实验结果以标准化TER(实验组TER÷对照组TER×100%)表示。
2.5 FITC-Dextran通透性测定
HNEpC以5×104个/孔接种于24孔Transwell上室,每孔200 μL,下室加入500 μL完全培养基,待细胞融合成单层后,饥饿培养12 h,再按“2.3”项下方法处理,上室加入200 μL 0.5 mg/mL FITC-Dextran(不含酚红MEM培养基配制),下室加入500 μL不含酚红MEM培养基,培养箱内孵育2 h。分别从每孔上、下室取100 μL液体加入黑色96孔板内,酶标仪激发波长495 nm、发射波长520 nm检测荧光值,计算FITCDextran通透性[14](实验组荧光值÷对照组荧光值×100%)。
2.6 Western blot检测
HNEpC以1×106个/孔接种于6孔板,待细胞融合成单层后,饥饿培养12 h,再按“2.3”项下方法处理。PBS清洗2次,每孔加入150 μL裂解液,冰上裂解5 min,14 000×g离心10 min,收集上清液,BCA法测定蛋白浓度。上样,电泳,转膜,封闭,加Occludin(1∶2 000)、Claudin-1(1∶1 000)、RhoA(1∶1 000)、ROCK1(1∶2 000)、β-actin(1∶5 000)一抗,4 ℃孵育过夜,加二抗(1∶5 000),室温孵育1 h,洗膜,ECL显影液显影,Image J软件分析目的蛋白灰度值。
2.7 免疫荧光检测F-actin表达
HNEpC以2×105个/孔接种于24孔板,待细胞融合成单层后,饥饿培养12 h,再按“2.3”项下方法处理。PBS清洗2次,4%多聚甲醛固定10 min,0.5%Triton X-100通透10 min,每孔加入300 μL罗丹明标记鬼笔环肽,室温避光孵育30 min,滴加抗荧光衰减封片剂,荧光显微镜下观察并拍照,Image J软件分析F-actin荧光强度。
3 统计学方法
4 结果
4.1 造模条件确定
与对照组比较,5、10 μg/mL Der p1处理HNEpC 6、12、24 h后标准化TER显著降低,以10 μg/mL Der p1处理24 h标准化TER降低最显著(P<0.01)。见表1。与对照组比较,5、10 μg/mL Der p1处理HNEpC 24 h后FITC-Dextran通透性显著增加,以10 μg/mL Der p1增加最显著(P<0.01),见表2。综合TER及FITC-Dextran通透性结果,后续选用10 μg/mL Der p1处理24 h作为造模条件。
表1 不同浓度Der p1处理不同时点的HNEpC标准化TER比较(,%,n=3)
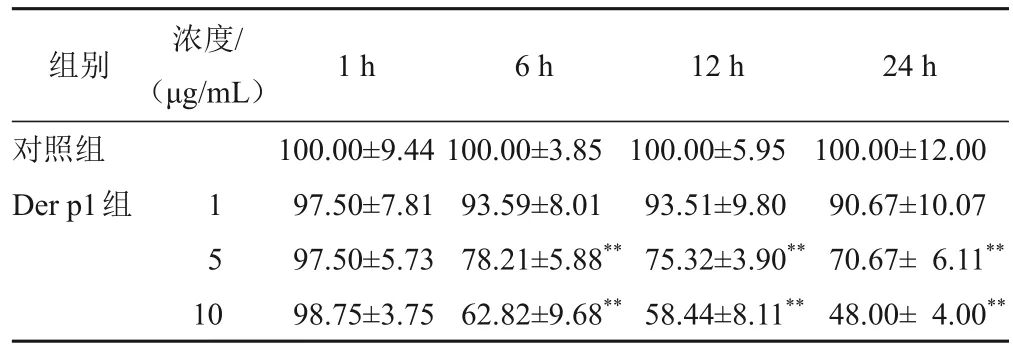
表1 不同浓度Der p1处理不同时点的HNEpC标准化TER比较(,%,n=3)
注:与对照组比较,**P<0.01
组别对照组Der p1组24 h 100.00±12.00 90.67±10.07 70.67± 6.11**48.00± 4.00**浓度/(μg/mL)1 5 1 0 1 h 100.00±9.44 97.50±7.81 97.50±5.73 98.75±3.75 6 h 100.00±3.85 93.59±8.01 78.21±5.88**62.82±9.68**12 h 100.00±5.95 93.51±9.80 75.32±3.90**58.44±8.11**
表2 不同浓度Der p1对HNEpC FITC-Dextran通透性的影响(,%)

表2 不同浓度Der p1对HNEpC FITC-Dextran通透性的影响(,%)
注:与对照组比较,**P<0.01
FITC-Dextran通透性100.00±2.19 106.82±5.43 123.18±7.75**136.04±5.43**组别对照组Der p1组浓度/(μg/mL)1 5 1 0 n3 3 3 3
4.2 麻黄细辛附子汤及麻黄最佳干预浓度筛选
CCK-8结果表明,与对照组比较,麻黄细辛附子汤浓度在0~2 mg/mL时对细胞存活率无影响,浓度为5、10 mg/mL时细胞存活率显著降低(P<0.05,P<0.01)。因此后续采用0.5、1、2 mg/mL作为麻黄细辛附子汤低、中、高剂量进行干预。与对照组比较,1 mg/mL麻黄组细胞存活率有降低趋势,但差异无统计学意义(P>0.05),2 mg/mL麻黄组细胞存活率显著降低(P<0.01),因此后续采用0.5 mg/mL麻黄进行干预。见表3。
表3 不同浓度麻黄细辛附子汤及麻黄对HNEpC存活率的影响(,%)
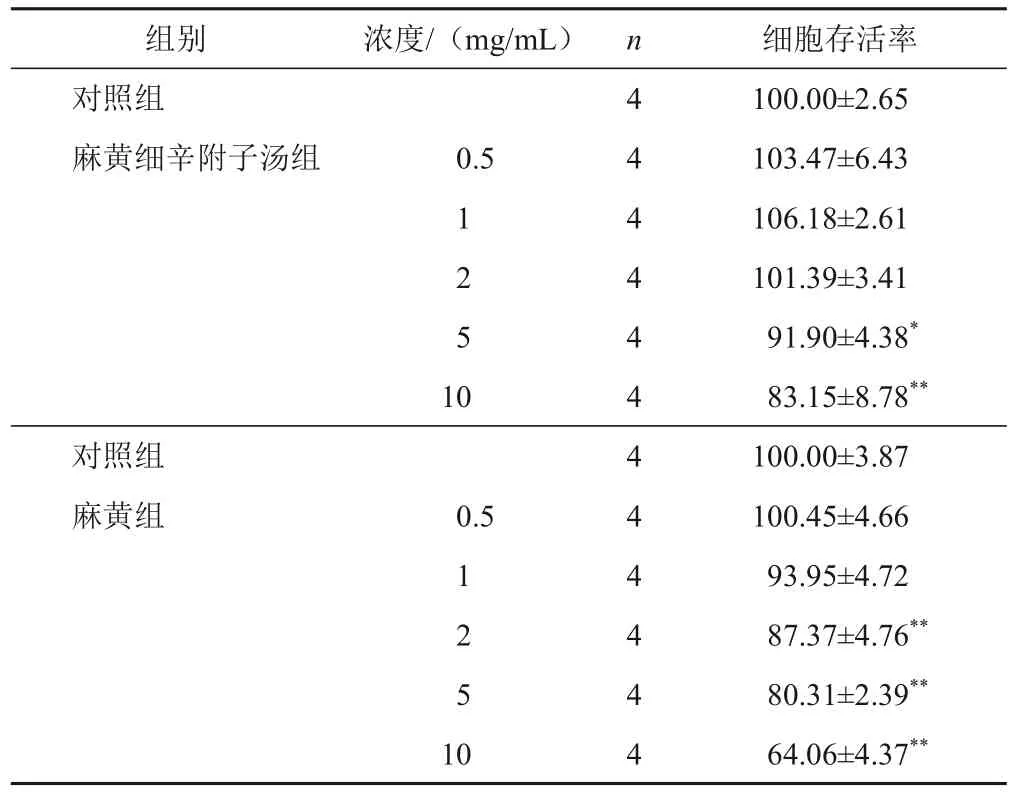
表3 不同浓度麻黄细辛附子汤及麻黄对HNEpC存活率的影响(,%)
注:与对照组比较,*P<0.05,**P<0.01
细胞存活率100.00±2.65 103.47±6.43 106.18±2.61 101.39±3.41 91.90±4.38*83.15±8.78**100.00±3.87 100.45±4.66 93.95±4.72 87.37±4.76**80.31±2.39**64.06±4.37**组别对照组麻黄细辛附子汤组浓度/(mg/mL)0.5 1 2 5 1 0对照组麻黄组0.5 1 2 5 1 0 n4 4 4 4 4 44 4 4 4 4 4
4.3 麻黄细辛附子汤对人鼻黏膜上皮细胞形态的影响
对照组HNEpC排列紧密,模型组HNEpC排列疏松,间隙增大,上皮完整性破坏,出现环形损伤;麻黄组、抑制剂组和麻黄细辛附子汤低、中、高剂量组HNEpC排列较紧密,上皮损伤明显修复。见图1。

图1 各组HNEpC形态(标尺=100 μm)
4.4 麻黄细辛附子汤对人鼻黏膜上皮细胞跨膜电阻的影响
与对照组比较,模型组HNEpC标准化TER显著降低(P<0.01);与模型组比较,麻黄组、抑制剂组和麻黄细辛附子汤低、中、高剂量组HNEpC标准化TER显著升高(P<0.01)。见表4。
表4 各组HNEpC标准化TER比较(,%)

表4 各组HNEpC标准化TER比较(,%)
注:与对照组比较,**P<0.01;与模型组比较,△△P<0.01
标准化TER组别n 100.00± 9.45 50.00± 7.14**79.76± 8.99△△86.90± 7.43△△91.67±10.91△△83.33± 5.46△△88.10± 5.46△△对照组模型组麻黄细辛附子汤低剂量组麻黄细辛附子汤中剂量组麻黄细辛附子汤高剂量组麻黄组抑制剂组3 3 3 3 3 3 3
4.5 麻黄细辛附子汤对人鼻黏膜上皮细胞通透性的影响
与对照组比较,模型组HNEpC FITC-Dextran通透性显著增加(P<0.01);与模型组比较,麻黄组、抑制剂组和麻黄细辛附子汤低、中、高剂量组HNEpC FITCDextran通透性显著降低(P<0.01),以麻黄细辛附子汤高剂量组效果最显著(P<0.05,P<0.01)。见表5。
表5 各组HNEpC FITC-Dextran通透性比较(,%)
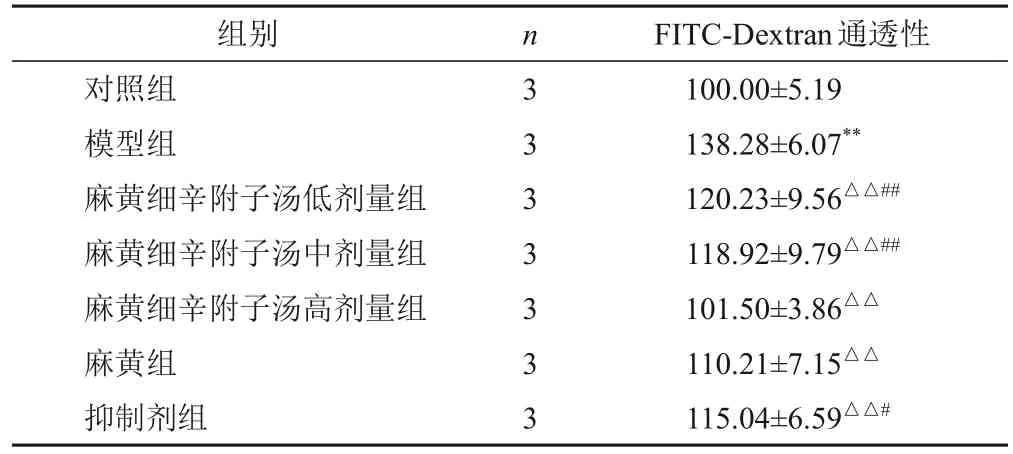
表5 各组HNEpC FITC-Dextran通透性比较(,%)
注:与对照组比较,**P<0.01;与模型组比较,△△P<0.01;与麻黄细辛附子汤高剂量组比较,#P<0.05,##P<0.01
FITC-Dextran通透性100.00±5.19 138.28±6.07**120.23±9.56△△##118.92±9.79△△##101.50±3.86△△110.21±7.15△△115.04±6.59△△#组别对照组模型组麻黄细辛附子汤低剂量组麻黄细辛附子汤中剂量组麻黄细辛附子汤高剂量组麻黄组抑制剂组n3 3 3 3 3 3 3
4.6 麻黄细辛附子汤对人鼻黏膜上皮细胞咬合蛋白、闭合蛋白-1、RhoA、ROCK1蛋白表达的影响
与对照组比较,模型组细胞Occludin、Claudin-1蛋白表达显著降低,RhoA、ROCK1蛋白表达显著升高(P<0.01);与模型组比较,麻黄组、抑制剂组和麻黄细辛附子汤低、中、高剂量组细胞Occludin、Claudin-1蛋白表达显著升高,RhoA、ROCK1蛋白表达显著降低(P<0.01),以麻黄细辛附子汤高剂量组效果最显著(P<0.05,P<0.01)。见图2、表6。

图2 各组HNEpC Occludin、Claudin-1、RhoA、ROCK1蛋白免疫印迹
表6 各组HNEpC Occludin、Claudin-1、RhoA、ROCK1蛋白表达比较()

表6 各组HNEpC Occludin、Claudin-1、RhoA、ROCK1蛋白表达比较()
注:与对照组比较,**P<0.01;与模型组比较,△△P<0.01;与麻黄细辛附子汤高剂量组比较,#P<0.05,##P<0.01
ROCK1 1.00±0.01 1.28±0.06**1.13±0.03△△##0.96±0.03△△##0.76±0.02△△0.80±0.02△△0.82±0.03△△#组别对照组模型组麻黄细辛附子汤低剂量组麻黄细辛附子汤中剂量组麻黄细辛附子汤高剂量组麻黄组抑制剂组n3 3 3 3 3 3 3 Occludin 1.00±0.09 0.38±0.03**0.98±0.03△△##0.98±0.09△△##1.39±0.04△△1.21±0.06△△##0.69±0.08△△##Claudin-1 1.00±0.10 0.31±0.02**0.80±0.08△△##0.90±0.04△△##1.95±0.11△△1.66±0.05△△##0.95±0.12△△##RhoA 1.00±0.02 1.95±0.04**1.68±0.09△△##1.14±0.07△△1.05±0.06△△0.98±0.08△△1.05±0.12△△
4.7 麻黄细辛附子汤对人鼻黏膜上皮细胞F-肌动蛋白表达的影响
与对照组比较,模型组细胞F-actin表达显著升高(P<0.01);与模型组比较,麻黄细辛附子汤低、中、高剂量组和抑制剂组细胞F-actin表达显著降低(P<0.05,P<0.01)。见图3、表7。

图3 各组HNEpC F-actin阳性表达(免疫荧光染色,标尺=130 μm)
表7 各组HNEpC F-actin表达比较()

表7 各组HNEpC F-actin表达比较()
注:与对照组比较,**P<0.01;与模型组比较,△P<0.05,△△P<0.01;与麻黄细辛附子汤高剂量组比较,##P<0.01
平均荧光强度15.56±0.75 19.64±0.52**17.78±0.68△17.44±0.99△17.25±1.52△△19.68±0.18##17.29±1.22△△组别对照组模型组麻黄细辛附子汤低剂量组麻黄细辛附子汤中剂量组麻黄细辛附子汤高剂量组麻黄组抑制剂组n3 3 3 3 3 3 3
5 讨论
AR是发生在鼻黏膜的2型炎症反应。鼻黏膜上皮细胞作为鼻腔的免疫屏障,参与先天免疫及适应性免疫,发挥重要的防御作用[15]。接触变应原后,上皮屏障损伤,通透性增加,促进上皮源性细胞因子及趋化因子释放,启动适应性免疫,激活多种效应细胞,释放炎症介质,进一步造成屏障损伤[16]。屏障损伤与2型炎症反应相互促进,在AR过程中形成恶性循环[17-18]。麻黄细辛附子汤中麻黄散寒邪而发表,附子温肾阳而补虚,细辛通彻表里,为麻附之臂助。三药合用,补散兼施,对于AR标本兼治,疗效持久。鼻黏膜上皮细胞处于机体浅表位置,是整个变态反应的始动环节,麻黄气味俱薄,轻清而浮,能行周身肌表,是否对屏障功能有干预作用需通过实验确证。
细胞间连接完整性是维持黏膜屏障的关键因素,紧密连接位于细胞间连接顶部,介导细胞黏附,封闭细胞间隙,严格调控离子、水和各种分子的细胞旁运输[3]。Occludin、Claudin-1是紧密连接的关键蛋白。Occludin调节紧密连接渗漏途径,允许较大分子通过,Claudin-1调节紧密连接孔道途径,负责小分子和离子的通透性[19]。研究表明,AR患者鼻黏膜上皮部分紧密连接蛋白表达水平降低,黏膜通透性增加[20]。TER可反映跨上皮细胞离子流量大小,TER增加表明离子渗透性降低[21]。不同右旋糖酐(Dextran)可用于检测溶质和大分子的通透性[22]。TER及FITC-Dextran通透性常用于评价上皮屏障功能。F-actin是细胞骨架的关键组分,参与调节多种细胞的高通透性[23-24]。F-actin细胞骨架与Occludin、Claudin-1等蛋白相连,共同维持屏障稳定性[25]。RhoA/ROCK信号通路在调控肌动蛋白动力学及其他生物过程中发挥核心作用[26]。RhoA-GTP能激活ROCK,促进F-actin表达及重新排布,增加细胞张力,导致细胞收缩及细胞旁间隙的形成[27-28]。此外,F-actin重排可使紧密连接复合物稳定性破坏,细胞间连接受损,屏障结构及功能异常[29]。RhoA/ROCK除调控F-actin引起屏障损伤外,还可直接磷酸化紧密连接蛋白,并在连接结构基本保持不变的情况下增加溶质渗透性[30]。Y-27632是一种选择性Rho激酶抑制剂,通过与ATP竞争Rho激酶催化结构域的ATP结合位点抑制Rho激酶活化[31]。
本实验选用常见过敏原Der p1构建HNEpC屏障损伤模型,经麻黄细辛附子汤、麻黄、抑制剂干预后,TER升高,FITC-Dextran通透性降低,细胞排列紧密,环形损伤修复,紧密连接蛋白Occludin、Claudin-1表达升高,表明麻黄细辛附子汤、麻黄、抑制剂对Der p1引起的屏障损伤均具有修复作用,以高剂量麻黄细辛附子汤效果最为显著。为探索麻黄细辛附子汤及麻黄发挥屏障保护作用的机制,进一步以RhoA/ROCK信号通路为切入点,检测通路关键蛋白RhoA、ROCK1及下游蛋白F-actin表达。结果显示,麻黄细辛附子汤能降低RhoA、ROCK1、F-actin表达,而麻黄可降低RhoA、ROCK1表达,结合全方对紧密连接蛋白的优势调节作用,一定程度上可以反映方药配伍的科学性。但该结果也可能与实验中所设麻黄药物浓度有关,今后可设置不同浓度的麻黄组,进一步对比全方与麻黄单味药的作用差异。
综上所述,麻黄细辛附子汤及麻黄能有效修复Der p1诱导的鼻黏膜上皮细胞屏障损伤,其作用可能是通过抑制RhoA/ROCK信号通路,减少F-actin聚集、收缩、重排,上调紧密连接蛋白表达,降低上皮通透性实现的。本实验中麻黄细辛附子汤及麻黄屏障保护作用显著,可深入探索其配伍机制及药效物质基础。此外,鼻黏膜上皮细胞与其他免疫细胞的关系也具有潜在研究价值。

