三疣梭子蟹(Portunus trituberculatus)CTL 基因SNP 位点E4-205 C/T 与抗溶藻弧菌相关性分析*
郝贵杰 林 锋 母昌考 雷 宁 黄爱霞 崔雁娜沈亚芳 张海琪① 文 菁
(1.岭南师范学院生命科学与技术学院 广东湛江 524048; 2.农业农村部淡水渔业健康养殖重点实验室 浙江省鱼类健康与营养重点实验室 湖州市水产品品质提升与加工技术重点实验室 浙江省淡水水产研究所 浙江湖州 313001; 3.宁波大学应用海洋生物学教育部重点实验室 浙江宁波 315211)
三疣梭子蟹(Portunus trituberculatus)隶属甲壳纲(Crustacea), 十足目(Decapoda), 梭子蟹科(Portunidae),梭子蟹属(Portunus), 广泛分布于中国、日本等海域,因生长速度快、味道鲜美而深受消费者青睐。早在20 世纪80 年代被列为我国海洋水产养殖对象, 是我国重要的一种海洋渔业资源。随着育苗和养殖技术的日臻成熟, 梭子蟹养殖面积与产量逐年增加, 目前已成为沿海各省海水养殖的主导产品。随着养殖规模的扩大及集约化发展, 对三疣梭子蟹的生存环境产生较大的影响, 与此同时养殖环境的污染等因素也对其免疫防御系统产生了一定程度的损害, 导致其自身的抗病力下降, 对病害的易感性增加, 病害频发,例如弧菌引起的“乳化病”。由溶藻弧菌(Vibrio alginolyticus)引起的“乳化病”给三疣梭子蟹养殖业带来了重大的经济损失。因此, 研究三疣梭子蟹的免疫机制, 筛选与抗病相关的分子标记进行人工辅助育种, 选育优良抗病品系具有重要意义。
分子标记辅助选择(molecular maker assisted selection, MAS)育种是利用分子标记与决定目标性状的基因紧密连锁的特点, 通过检测所筛选的分子标记, 判定目的基因的存在, 从而进行目标性状的选择,与传统的选育费时费力相比, 具有时间短、准确性高、而且受环境干扰较小等优点(Dekkerset al, 2002;Collardet al, 2005; Masoudiet al, 2007)。而C-型凝集素(C-type lectin, CTL)是甲壳类动物体液免疫中重要的免疫因子之一(McGrealet al, 2004), 是重要的模式识别受体之一(Wanget al, 2013a), 其对外来病原菌以及复杂的碳水化合物具有选择性凝集作用, 同时具有调理素的作用, 介导血细胞对外来物质的吞噬,和机体其他免疫因子一起抵御外来病原的入侵(Wanget al, 2009a; Weiet al, 2012; Wanget al, 2013b)。课题组前期通过克隆CTL基因的DNA 全长, 并在其四个外显子和三个内含子上共筛选到4 个SNP 位点及一个三碱基的缺失, 通过制备三疣梭子蟹易感群体及抗性群体, 分析了各多态性位点的基因型与抗溶藻弧菌的相关性, 结果发现CTL第四外显子 SNP E4-205 C/T 具有三种基因型C/C、C/T 和T/T, 其T等位基因在抗病群体中出现的频率(53%)显著高于敏感群体(33.3%), T/T 基因型在易感群体中频率为6.1%,在抗性群体中频率为 21.2%, 具有显著性差异(P=0.022) (Haoet al, 2015)。为初步阐明SNP E4-205 C/T 位点T/T 基因型三疣梭子蟹抗溶藻弧菌的分子机理, 本文对该位点非同义突变(ACT-AT T)导致的一个氨基酸改变(Thr-Ile)的两种蛋白进行了体外重组表达与纯化, 并从体内外研究了CTL的T/T 基因型梭子蟹在抗溶藻弧菌感染中的作用。以期为三疣梭子蟹免疫防御机制研究及抗病品系的选育提供基础数据和理论依据。
1 材料与方法
1.1 实验材料
1.1.1 耗材与试剂 三疣梭子蟹(Portunus trituberculatus) (45~60 g)购自宁波鑫亿鲜活水产有限公司, 正常投喂冰鲜小杂鱼。基因分型后转至小池塘中的塑料筐内饲养备用。
溶藻弧菌由宁波大学海洋学院王国良教授惠赠;副溶血弧菌、哈维氏弧菌、鳗弧菌、嗜水气单胞菌、大肠杆菌、金黄色葡萄球菌、酿酒酵母、枯草芽孢杆菌由本实验室保存。
TIANamp Genomic DNA Kit、TIANamp Blood DNA Kit、RNAsimple Total RNA kit、FastQuant cDNA RT Kit (with gDNA)、SuperReal PreMix Plus (SYBR Green)购自天根生化科技(北京)有限公司; SsoFast EvaGreen supermix 购自Bio-rad 公司; T-vector pMD19(Simple)、TaKaRa LA Taq、质粒提取试剂盒、BamHI、XhoI、T4DNA 连接酶等购自TaKaRa 公司; 卡那霉素、Trans1-T1、pET-30a(+)、BL21(DE3)购自北京全式金公司; Agarose Gel DNA Purification Kit 购自Axygen 公司; Ni-Agarose His 标签蛋白纯化试剂盒购自康为世纪生物科技有限公司; Bradford 蛋白浓度测定试剂盒购自碧云天生物技术研究所; 其他试剂为国产分析纯。
1.1.2 仪器设备 Mx3005P 荧光定量 PCR 仪(Stratagene 公司); Rotor-Gene 6000 荧光定量PCR 仪(德国Qiagen 公司); Biometra TGradient PCR 仪购(华粤行仪器有限公司); JY920-IIN 超声波裂解器(宁波新芝); 全波长酶标仪SpectraMax 190 (美国MD 公司);Smart Spec 3000 核酸蛋白测定仪(美国Bio-Rad 公司);Q-Exactive 质谱仪(Thermo Scientific 公司)。
1.2 活体三疣梭子蟹SNP 基因分型
随机选取300 只健康三疣梭子蟹, 抽取少量血淋巴后继续喂养。血淋巴样品DNA 提取按照TIANamp Genomic DNA Kit 试剂盒说明书进行, 核酸浓度统一稀释至20~30 ng/µL 备用。采用小片段扩增法进行HRM 分型(Liewet al, 2004), 并以标准基因型样品为对照。根据实验室前期筛选到的 CTL 基因 SNP E4-205 C/T 位点序列, 设计并筛选1 对特异性、灵敏性 均 优 的 引 物, HRM-124 F: 5′-AAATGCCTACT GGAGGAGAGAAACA-3′和HRM-124 R: 5′-TTTCCT CGTTACTTC TCACAAATCG-3′, 片段大小为124 bp。PCR 反应体系: 10 μL SsoFast EvaGreen supermix、0.8 μL HRM-124F (10 μmol/L)、0.8 μL HRM-124R(10 μmol/L)、1 μL DNA 模板(20 ng/µL)、双蒸水补足20 μL。采用带有HRM 分析功能的Rotor-Gene 6000荧光定量PCR 仪进行PCR 扩增, 扩增条件为: 98 °C 2 min, 40 个循环(98 °C 5 s, 58 °C 20 s)。利用仪器自带的HRM 分析软件进行结果分析, 分析阈值设为90%, 比较已知基因型样品和待测样品的标准视图和差异视图, 对待测样品进行SNP 分型, 每个样品4 个平行。引物合成及PCR 扩增产物测序由南京金斯瑞生物科技有限公司完成。
1.3 T/T 和C/C 基因型CTL 编码蛋白的原核表达及纯化
根据实验室前期获得的CTL 基因序列(GenBank:JX195096.1), 设计PCR 扩增引物: CTL-BD-F: 5′-CC CATATGACTGGCTTCAGGCTGCTGT-3′(含Nde I 酶切位点), CTL-BD-R: 5′-CGGATTCCTCACAAATCG GACTTACA-3′ (含BamH I 酶切位点), 预计产物大小为438 bp, 引物由南京金斯瑞生物公司进行合成。以SNP E4-205 T/T 和C/C 基因型的梭子蟹cDNA 样品为模板进行扩增, 目的片段分别命名为CTL-ACT 及CTL-ATT, 代表密码子变异(ACT-ATT)导致所编码氨基酸改变(Thr-Ile)。PCR 扩增体系: 5 μL 10×Ex Taq buffer、0.5 μL Ex Taq 酶、4 μL dNTP Mixture、1 μL CTL-BD-F、1 μL CTL-BD-R、1 μL cDNA、ddH2O 补至50 μL。PCR 扩增条件: 94 °C 5 min; 94 °C 50 s,54 °C 50 s, 72 °C 1 min, 33 个循环; 72 °C 10 min, 4 °C 10 min, 1%琼脂糖凝胶电泳进行PCR 产物鉴定。
采用购自Axygen 公司的柱式DNA 胶回收试剂盒切胶回收PCR 产物。将目的片段克隆至T 载体, 进行 PCR、酶切及测序鉴定, 将构建原核表达质粒PET-CTL-ATT 及PET-CTL-ACT, 并转化BL21 感受态细胞, 挑取单克隆进行鉴定、保存。将含CTL-ATT及CTL-ACT 的重组表达菌转接到LB 培养基中过夜培养。次日, 按1︰100 比例接种到新鲜LB 液体培养基(含Kan 50 μg/mL), 37 °C, 250 r/min 恒温摇至OD600达到0.6~0.8 时, 加入终浓度为1 mmol/L 的IPTG 诱导, 同时设置未诱导组。低温离心收集菌体沉淀, 对菌体进行超声破碎后采用咪唑梯度洗脱法进行蛋白纯化, 经透析浓缩后再测定浓度, 蛋白进行 SDSPAGE 电泳检测, 纯化产物保存于–20 °C 备用。
1.4 重组蛋白CTL-ACT 及CTL-ATT 的质谱鉴定
将胶块剪成1~2 mm3大小, 纯水漂洗两次, 依次进行脱色(25 mmol/L NH4HCO3, 50%乙腈水溶液)、脱水(先50%乙腈溶液, 后100%乙腈溶液)、还原(含10 mmol/L DTT 和25 mmol/L NH4HCO3的水溶液)、烷基化(含50 mmol/L IAM 和25 mmol/L NH4HCO3的水溶液)处理; 加入25 mmol/L NH4HCO3清洗10 min,后依次用 50%乙腈溶液、100%乙腈溶液脱水处理30 min; 吸出多余液体, 加入10 μL 酶解工作液(含0.02 μg/μL 胰蛋白酶的酶解覆盖液)吸胀30 min, 再加入20 μL 酶解覆盖液, 37 °C 水浴酶解16 h, 将上清转至新离心管; 加入50 μL 肽段萃取液(含5%甲酸, 67%乙腈的水溶液)于剩下的胶中, 37 °C 水浴20 min 后低速离心, 合并上清, 挥干后脱盐。将挥干的多肽样品溶解Buffer A (含0.1%甲酸-水溶液)中, 后进行液相分离, 液相A 液为0.1%甲酸-水溶液, B 液为0.1%甲酸-乙腈溶液; 色谱柱Trap column 以100%的A 液平衡, 样品由自动进样器上样, 并吸附到Trap column柱上, 再经 Analysis column 色谱柱分离, 流速为300 nL/min; 样本间用空白溶剂30 min 流动相梯度清洗一次; 酶解产物经毛细管高效液相色谱分离后用Q-Exactive 质谱仪(Thermo Scientific)进行质谱分析。
1.5 不同基因型三疣梭子蟹的溶藻弧菌感染实验
将T/T、C/T 及C/C 三种基因型梭子蟹分为三个组, 各组均设有感染组和对照组, 溶藻弧菌7.8×106CFU/mL (预实验结果)注射量为0.2 mL/只。感染后不同时间(0、3、6、12、24、48、72、96 h)进行血淋巴及肝胰腺细菌分离, 冰上采取梭子蟹的肝胰腺和肌肉组织并迅速置于液氮罐中, 后转入–80 °C 保存待用。
1.6 溶藻弧菌在三疣梭子蟹组织中的复制
根据溶藻弧菌的胶原蛋白酶基因序列, 设计特异性扩增引物: JY142-F: 5′-TTTGGCAAGGTCTGT TTGGTTAC-3′, JY142-R: 5′-GTGGCTTACACGTT GGAATGATC-3′, 并构建含溶藻弧菌胶原蛋白酶基因片段的重组质粒pMD19-JY142。根据质粒提取试剂盒抽提pMD19-JY142 质粒DNA, 并测定其浓度和纯度, 根据公式: 质粒拷贝数(单位: copies/µL) =(6.02×1014×质粒浓度) / [(T 载体DNA 长度+目的基因片段长度)×660], 计算质粒拷贝数。利用双蒸水将标准质粒稀释成102~1098 个梯度备用, 提取感染后不同时间点的组织样品 DNA, 定量后作为待测样品模板, 与质粒标准品一起进行AQ-PCR (absolute quantitative PCR)反应, 每个样品测定 3 次。根据SuperReal Premix Plus (SYBR Green)说明书配制PCR反应体系, 荧光定量PCR 仪Mx3005P 进行扩增, 反应结束后系统自动生成标准曲线。
1.7 两种重组蛋白的凝集活性检测
1.7.1 小鼠红细胞凝集活性 健康小鼠进行心脏采血, 保存于4 °C 冰箱中, 临用前3 000 r/min 离心3 min, 取血细胞以0.85%生理盐水洗三次后, 配成2% (V/V)血细胞悬液备用。于96 孔微量血凝板中进行凝集实验, 每孔加入25 µL 的TBS-І, 取25 µL 两种重组蛋白各做连续2 倍稀释, 再加入25 µL 的2%血细胞, 室温静置1~2 h, 按文献观察并记录红细胞凝集情况(戴华生, 1983)。
1.7.2 细菌凝集活性 所用菌株为金黄色葡萄球菌、溶藻弧菌以及酵母菌为代表。具体步骤如下: 各菌经过夜培养后, 8 000 r/min 离心5 min; 弃去培养基后, 加入TBS 缓冲液, 重新悬起菌体再次离心, 按此重复清洗菌体三次, 彻底去除培养基成分。使用TBS-I 重悬菌体, 并通过测定菌液浓度将其稀释至1.5×109cell/mL; 取20 μL 重组蛋白至酶标板孔中,20 μL BSA (1 mg/mL)溶液作为对照组, 再取10 μL 菌悬液加入并混匀, 室温下孵育45 min 后, 取10 μL 至载玻片上, 在显微镜下观察。
1.8 两种重组蛋白对溶藻弧菌的抑菌活性
采用液体生长方法检测重组蛋白CTL-ACT 及CTL-ATT 对溶藻弧菌的抑制作用。将溶藻弧菌在TSB液体培养基中培养过夜, 将菌液用TSB 稀释浓度至OD550为0.001 左右, 在96 孔细胞培养板中分别加入50 µL 菌液和 50 µL 梯度稀释的重组目的蛋白(64 µg/mL 倍比稀释至 2 µg/mL); 阴性对照组为50 µL 菌液和50 µL BSA (64 µg/mL)的混合溶液; 阳性对照组为50 µL 菌液和50 µL Kana (64 µg/mL)的混合溶液。总体积为100 µL, 每个浓度设置3 个重复;将培养板置30 °C、100 r/min 的摇床培养, 分别在0、1、2、4、6、8、10、12、24 h, 将细胞板置酶标仪测定OD550值。
1.9 两种重组蛋白与溶藻弧菌的结合活性
本实验以筛选CTL SNP 的溶藻弧菌作为所用的包被菌, 将菌株培养到OD600为1.0 左右, 并用包被液重悬使其终浓度为5×108个/mL。按100 µL/孔将菌液加入96 孔酶标板, 4 °C 孵育过夜, PBST 洗涤3 次,3~5 min/次; 然后每孔加入200 µL 含3% BSA 的PBS,37 °C 封闭3 h, 同上洗涤; 各孔加入不同浓度的重组蛋白CTL-ACT 及CTL-ATT (16 µg/mL 倍比稀释至0.5 µg/mL) 100 µL, PBS 作为阴性对照, 30 °C 孵育2 h,同上洗涤; 每孔加入100 µL 一抗His-tag 抗体(1︰1 000,V/V), 37 °C 温育1 h, 同上洗涤; 再加入100 µL辣根过氧化物酶标记山羊抗小鼠IgG(H+L) (1︰250,V/V), 37 °C 温育1 h, 同上洗涤; 每孔加入200 µL TMB 显色液, 避光孵育10~30 min, 然后每孔加入50 µL 2 mol/L 硫酸溶液中止反应, 于450 nm 测定吸光度, 当样品OD450值/阴性对照OD450值≥2 时判定为阳性。
1.10 两种重组蛋白与细菌PAMP 的结合活性研究
参考Wang 等(2016)的方法略作修改, 目的是用ELISA 方法测定两种重组蛋白与病原相关分子模式PAMPs 结合活性的差异。所用的PAMPs 有脂多糖、菌肽聚糖、葡聚糖 G 及脂磷壁酸。用包被液将各PAMP 稀释至200 µg/mL, 按100 µL/孔将菌液加入96孔酶标板, 4 °C 孵育过夜; 配制含0.5 mL/L Tween20的PBS 即PBST 洗液, 满孔加液洗涤, 每次3~5 min,共洗涤3 次; 然后每孔加入200 µL 含3% BSA 的PBS,置于37 °C 水浴锅封闭3 h, 同上洗涤; 加入不同浓度的重组蛋白CTL-ACT 和CTL-ATT (64 µg/mL 倍比稀释至2 µg/mL) 100 µL, PBS 作为阴性对照, 30 °C 孵育2 h, 同上洗涤; 后续步骤同1.8。
2 结果与分析
2.1 溶藻弧菌感染后不同基因型三疣梭子蟹的死亡率
通过HRM 分析对300 只三疣梭子蟹进行了基因分型(表1), 结果显示C/T 基因型共140 只, 占46.7%;T/T 基因型共49 只, 占16.3%; C/C 基因型共111 只,占37%。不同基因型梭子蟹感染溶藻弧菌后的死亡情况(表1, 图1), C/T、T/T 和C/C 基因型梭子蟹的累积死亡率分别为81.4%、57.1%和82%, 结果表明T/T基因型三疣梭子蟹的累积死亡率极显著低于其他基因型(P=0.001)。

图1 CTL SNP E4-205 C/T 位点不同基因型梭子蟹感染溶藻弧菌的死亡率Fig.1 Cumulative mortality of swimming crabs expressing SNP genotypes at the CTL E4-205 locus upon V. alginolyticus infection

表1 三种基因型在E4-205 位点的分布及感染溶藻弧菌后的死亡率Tab.1 Distribution of the three genotypes at the E4-205 locus, and its mortality after infected with V. alginolyticus
2.2 溶藻弧菌在不同基因型三疣梭子蟹体内的拷贝情况
根据各模板的荧光值变化规律自动生成溶藻弧菌的标准曲线, 标准曲线为Y= –3.691×lg(X)+41.36,其中Y为CT 值,X为起始模板的拷贝数, 相关系数为0.999, 说明在质粒模板浓度范围内其线性关系较好,可以用于检测分析溶藻弧菌的拷贝。按照建立的溶藻弧菌AQ-PCR 方法, 测定不同基因型三疣梭子蟹感染溶藻弧菌后不同时间肝胰腺和肌肉中溶藻弧菌的拷贝情况(见图2)。发现肝胰腺中12 h 前T/T 组细菌拷贝数极显著低于C/C 和C/T 组(P<0.01), 之后的时间内细菌拷贝数差异不明显; 肌肉中3 h 时T/T 组细菌拷贝数极显著低于C/C 和C/T 组(P<0.01), 6 h 时T/T组显著低于C/C 和C/T 组(P<0.05), 12 h 时各组细菌拷贝数无显著差异, 而24 h 时T/T 组细菌拷贝数极显著低于C/C 和C/T 组(P<0.01), 且感染12 h 之后肌肉中的细菌拷贝数明显高于肝胰腺。结果表明三疣梭子蟹CTL 基因SNP 位点E4-205 C/T 的变异与其体内溶藻弧菌的复制存在相关性, 存在于T/T 基因型梭子蟹肌肉组织中或肝胰腺组织中的细菌拷贝数在一定时间内均显著低于其他基因型。

图2 三疣梭子蟹不同基因型肝胰腺、肌肉组织中的溶藻弧菌拷贝数Fig.2 Copies of V.alginolyticus in different genotype P.trituberculatus infected by V.alginolyticus
2.3 重组蛋白CTL-ACT 及CTL-ATT 的表达、纯化及鉴定
成功构建原核表达质粒 PET-30a/CTL-ACT、PET-30a/CTL-ATT 并进行重组表达。阳性重组菌经IPTG 诱导表达后, 利用SDS-PAGE 检测重组蛋白CTL-ACT 和CTL-ATT 的表达。结果表明, 两个蛋白在37 °C 诱导4 h 时后以包涵体形式存在, 蛋白分子量约为17.6 kDa (如图3)。以BSA 为标准的Bradford法测定纯化的目的蛋白得率约为CTL-ACT 0.8 mg/L,CTL-ATT 0.6 mg/L。
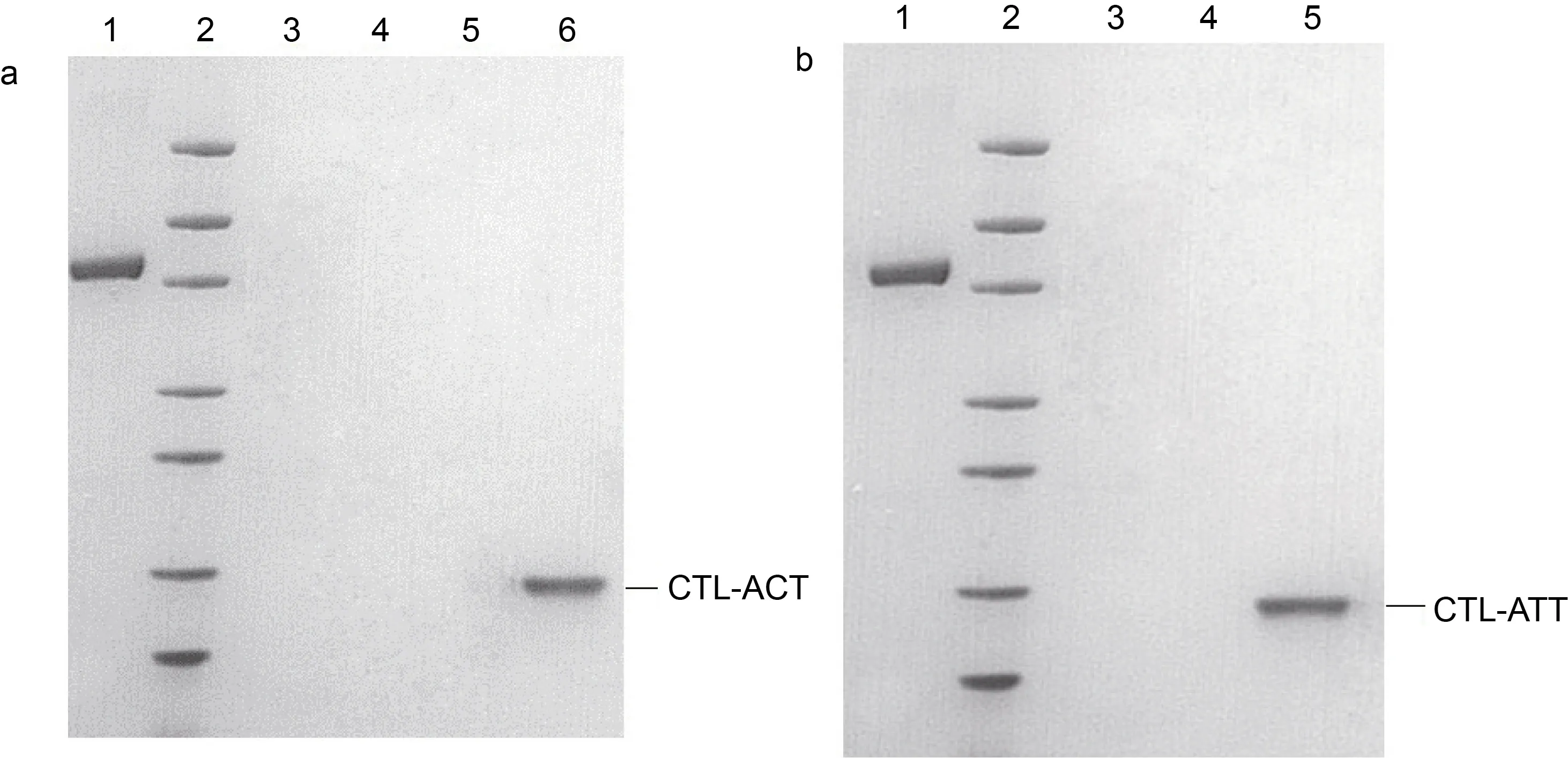
图3 SDS-PAGE 鉴定目的蛋白纯化Fig.3 Purification of the target fusion protein
对纯化蛋白谱带进行胶内酶解及MALDI- TOF/TOF 质谱分析鉴定(见图4), 结果表明所切下的两种重组蛋白有多个肽段与三疣梭子蟹C 型凝集素PtLP的氨基酸序列完全匹配(GenBank 登录号ACC86854.1),由此可以判定, 上述蛋白条带即为重组表达的目的蛋白, 两个差异蛋白成功获得了体外重组包涵体表达, 可用于后续实验研究。
2.4 重组蛋白的凝集活性分析
按照常规方法分别测定了两种重组蛋白对小鼠红细胞及相关细菌的凝集活性, 结果表明两者均有凝集小鼠红细胞的活性, 且CTL-ATT 比CTL-ACT 活性稍强, 但两者凝集效价均较低, 仅为21(见图5)。检测两种重组蛋对金黄色葡萄球菌、溶藻弧菌以及酵母菌的凝集作用, 结果表明即使在一定Ca2+存在的条件下, 两种重组蛋白均不能凝集任何一种细菌, 呈现的溶藻弧菌凝集见图6。

图5 两种重组蛋白小鼠红细胞凝集活性Fig.5 Hemagglutinating activity of two kinds of recombinant proteins

图6 两种重组蛋白对溶藻弧菌的凝集活性(400×)Fig.6 The agglutination activity of V. alginolyticus induced by two kinds of recombinant proteins
2.5 重组蛋白的抑菌活性结果
利用酶标仪测定经作用的溶藻弧菌最佳吸光度OD550的吸光值, 绘制两种重组蛋白以及 Kana 与BSA 对照均在64 µg/mL 浓度作用不同时间, 对溶藻弧菌生长抑制的作用曲线。结果如图7, Kana 具有强烈的抑菌作用, 细菌吸光度保持在0.2 以下; 两种重组蛋白和BSA 组在前4 h 内未见明显的细菌吸光度增加, 从6 h 开始, 随着细菌繁殖的增加吸光度逐渐增加;与BSA 对照组相比较, 两种重组蛋白对细菌生长均具有一定的抑制作用, 且CTL-ATT 蛋白比CTL-ACT 蛋白具有更强的抑菌活性。应用SPSS 19.0 单因素方差分析各组在培养24 h 时的吸光值, 结果表明各组吸光值差异极显著(P<0.01), 说明24 h 时CTL-ATT 蛋白的抗溶藻弧菌活性显著高于CTL-ACT 蛋白。

图7 两种重组蛋白不同时间的抑菌活性Fig.7 Antibacterial activity of two kinds of recombinant proteins in different hours
2.6 重组蛋白的溶藻弧菌结合活性
用ELISA 方法检测两种重组蛋白与溶藻弧菌的结合活性(图8), 发现随着重组蛋白浓度的增加, 各组吸光值也随之升高, 说明两种重组蛋白与溶藻弧菌的结合也是浓度依赖性模式; 而在同样浓度下,CTL-ATT 与溶藻弧菌的结合活性要高于CTL-ACT 与溶藻弧菌的结合活性。
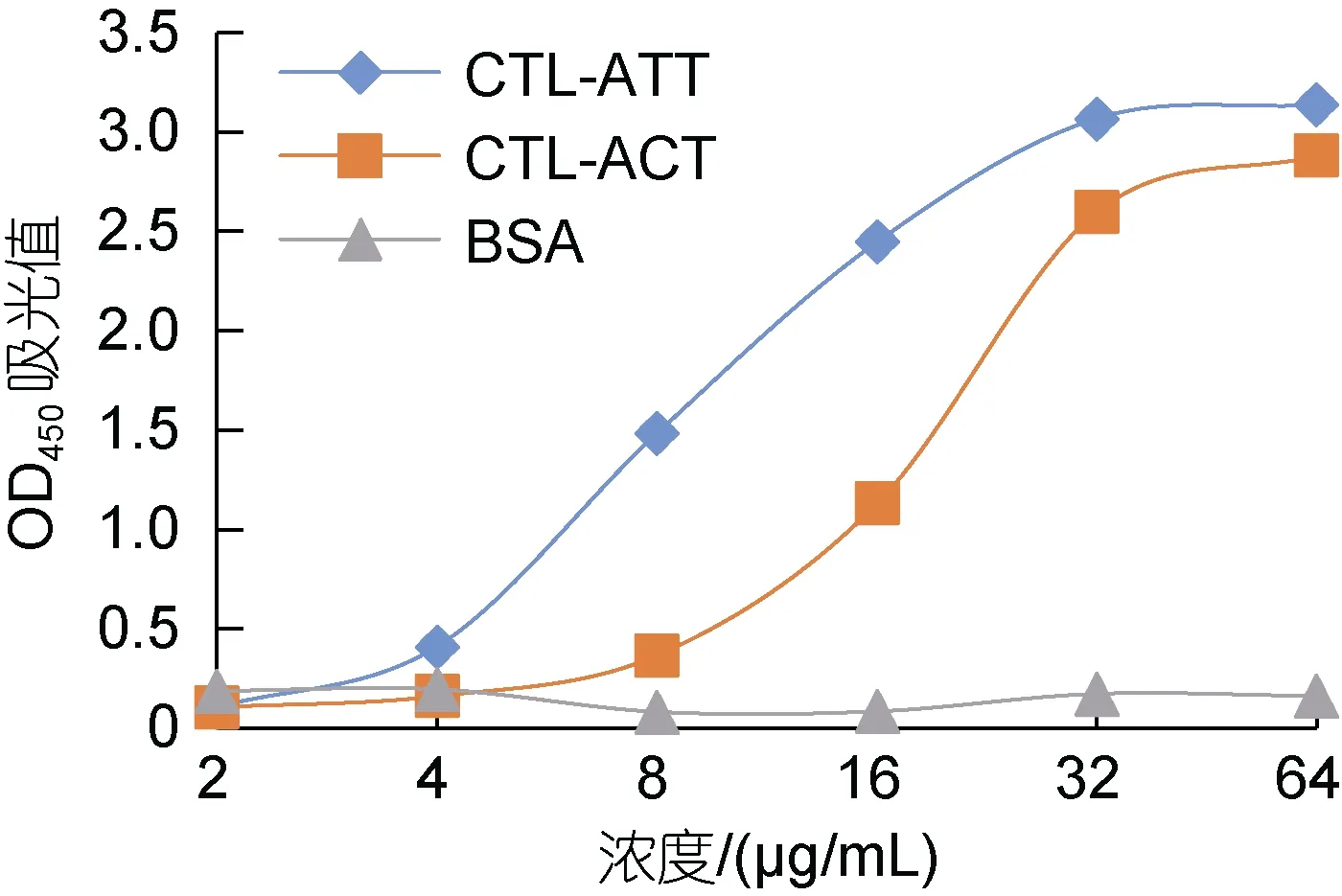
图8 两种重组蛋白与溶藻弧菌的结合活性Fig.8 ELISA analysis of the binding activity between two kinds of recombinant proteins and V. alginolyticus
2.7 重组蛋白的PAMPs 结合活性
为了检测两种重组蛋白与病原相关分子模式PAMPs 的相互作用, 我们利用不同浓度的重组蛋白与脂多糖、肽聚糖、葡聚糖及脂磷壁酸进行孵育, 后进行ELISA 检测。检测结果见图9, 发现CTL-ATT蛋白与四种PAMPs 的结合活性均高于CTL-ACT 蛋白, 两个重组蛋白与四种PAMPs 结合强弱依次为LPS>GLU>LTA>PGN; 两种重组蛋白与四种PAMPs的结合均具有浓度依赖性, 即随着蛋白浓度的升高与PAMPs 结合活性更强。应用SPSS 19.0 中单样本T检验分析两种重组蛋白分别与各PAMP 结合的差异性, 结果表明均为差异极显著(P<0.01), 说明CTL-ATT蛋白与四种PAMPs 的结合活性显著高于CTL-ACT蛋白。
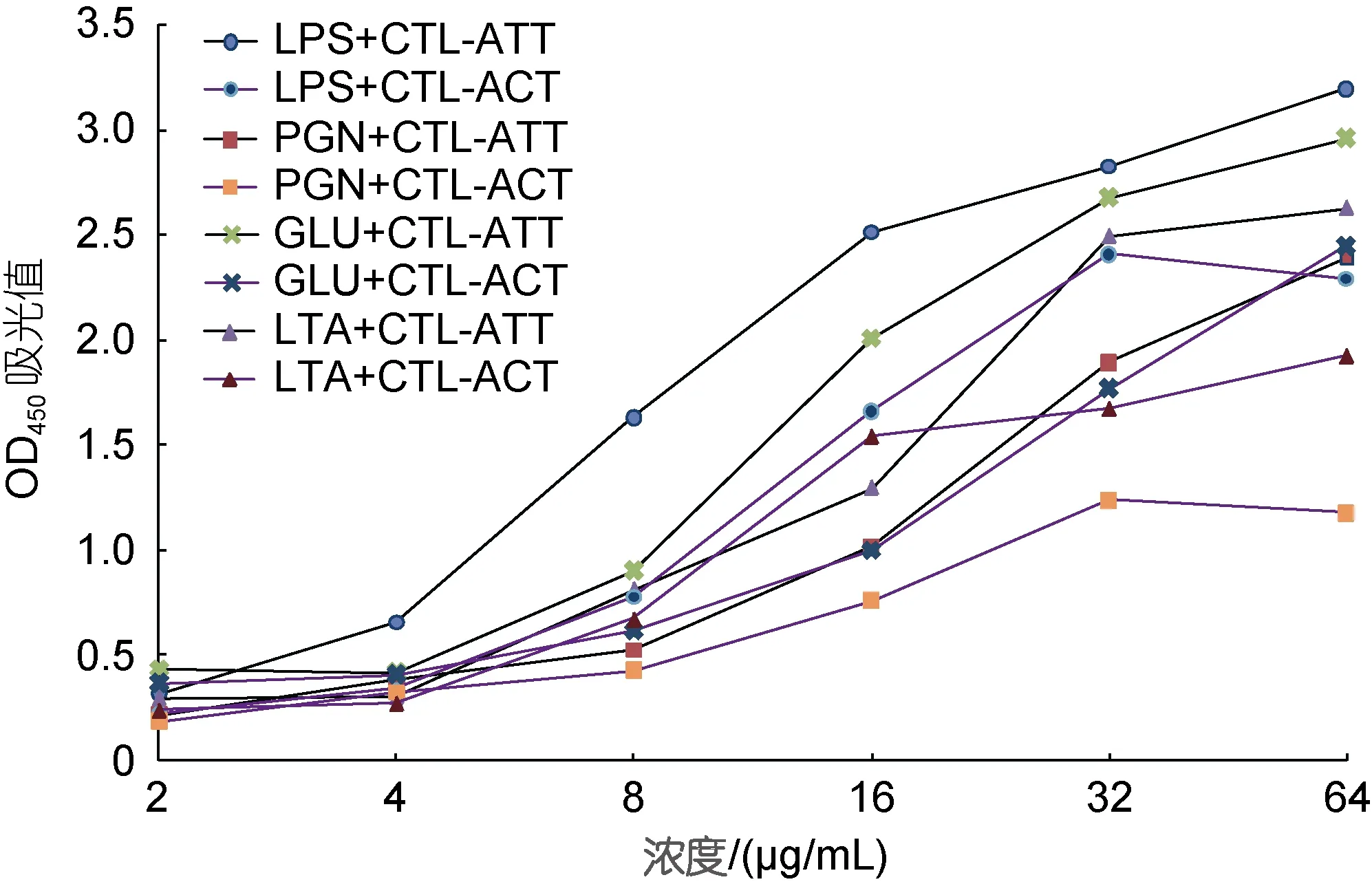
图9 两种重组蛋白与四种PAMPs 的结合活性Fig.9 ELISA analysis of the binding activity of two kinds of recombinant proteins and four kinds of PAMPs
3 讨论
分子标记辅助选择育种相较于与传统选育, 具有准确、快速、不受环境条件干扰的优点(Dekkerset al, 2002; Masoudiet al, 2007)。但目前众多的研究报道仍局限于分子标记的筛选, 而真正将其应用于标记辅助选择育种并取得成功的例子仍较少, 主要原因是尚未弄清楚分子标记的作用机制。根据实验室前期从三疣梭子蟹免疫基因 C-型凝集素中筛选到的SNP E4-205 C/T 位点, 本研究利用PCR-HRM 方法对三疣梭子蟹进行基因分型, 后以溶藻弧菌感染不同基因型的三疣梭子蟹, 探究不同基因型梭子蟹体内细菌复制的差异性, 以期初步阐明该抗病分子标记抗溶藻弧菌的作用机理。根据实验结果, 溶藻弧菌感染后T/T 基因型组的三疣梭子蟹死亡率显著低于C/T和C/C 基因型组; 可初步表明筛选的SNP E4-205 C/T位点与三疣梭子蟹抗病性存在一定关联。进一步的AQ-PCR 分析结果表明, 溶藻弧菌感染后12 h 前T/T组三疣梭子蟹肝胰腺、肌肉中的细菌拷贝数显著低于C/C 和C/T 组, 12 h 之后肌肉中的细菌拷贝数明显高于肝胰腺, 说明细菌已突破肝胰腺的免疫防线, 在肌肉中大量复制, 进而产生“肌肉乳化病”的症状(王国良等, 2006; 刘淇等, 2007)。同时也说明T/T 基因型梭子蟹抗溶藻弧菌的能力明显高于另外两个基因型,可与三疣梭子蟹死亡情况相佐证。以上研究表明从三疣梭子蟹CTL 基因中筛选出的SNP E4-205 C/T 位点与抗溶藻弧菌相关, 初步说明可应用于三疣梭子蟹分子标记辅助选择育种工作。
为了进一步阐明易感及抗性基因型梭子蟹抗溶藻弧菌的差异性, 对该位点非同义突变(ACT-ATT)导致的一个氨基酸改变(Thr-Ile)的两种蛋白进行了体外重组表达与纯化, 并对两种重组蛋白进行活性分析。凝集活性结果表明, 两者均有较弱的凝集小鼠红细胞的活性, 且CTL-ATT 比CTL-ACT 活性稍强, 但不能凝集所测定的任何一种细菌。这与已报道的一些C-型凝集素不同, 例如中华绒螯蟹重组C-型凝集素EsCTLDcp、EsCTL1、EsCTL2 能够凝集G+菌金黄色葡萄球菌S.aureus, G-菌嗜水气单胞菌A.hydrophila以及副溶血弧菌V.parahaemolyticus(Huanget al,2014a); 中国对虾的 FcLec2、FcLec4, 日本对虾的PjLec, 南美白对虾的LvLec 等均能够凝集一种或多种细菌(Wanget al, 2009b; Zhanget al, 2009)。这可能与该包涵体表达蛋白纯化复性时活性丢失, 或者该蛋白本身就不具有体外凝集细菌的活性有关。此外,两种重组蛋白对溶藻弧菌的生长均具有一定抑制作用, 其具有浓度依赖性, CTL-ATT 蛋白比CTL-ACT蛋白的抑菌活性更强。这一结果从体外证明了三疣梭子蟹CTL 抗感染能力及T/T 基因型可作为抗病品系筛选的分子标记。
C-型凝集素作为一类模式识别受体, 主要是通过对微生物表面糖类的识别即病原相关分子模式PAMP 而参与先天免疫, 有关的研究在虾蟹C-型凝集素已有许多报道(Guoet al, 2011; Zhanget al, 2013;Huanget al, 2014b)。本研究中, 我们分别使用不同浓度的两种重组蛋白与LPS、PGN、GLU 及LTA 进行孵育, 然后进行ELISA 检测, 结果表明, 两种重组蛋白均能够结合不同的 PAMPs, 结合强弱依次为LPS>GLU>LTA>PGN, 这种广谱的结合活性说明三疣梭子蟹CTL 在抵抗多种病原微生物中发挥重要的免疫作用。就浓度依赖性来看, 两种重组蛋白与四种PAMPs 的结合均具有浓度依赖性, 即它们与PAMPs的结合活性随着蛋白浓度的升高而更强。但同浓度的CTL-ATT 与四种 PAMPs 的结合活性均高于CTL-ACT 与相应PAMPs 的结合。进而ELISA 方法测定了两种重组蛋白与溶藻弧菌的结合活性, 结果表明两者的结合活性同样具有浓度依赖性, 且同浓度下CTL-ATT 的结合活性要高于CTL-ACT, 该结果表明SNP E4-205 C/T 位点非同义突变改变了编码蛋白的生物学功能, 增强了机体抗感染的能力, 因此更进一步证明了T/T 基因型与抗溶藻弧菌的相关性。上述研究结果将为SNP E4-205 C/T 标记的辅助选择应用, 加速三疣梭子蟹抗病品系育种进程提供有力的科学依据, 同时将对其他水产动物抗病分子标记的机制研究提供有用的借鉴手段。
4 结论
本研究对三疣梭子蟹C-型凝集素即CTL 基因SNP E4-205 C/T 位点非同义突变(ACT-ATT)导致的一个氨基酸改变(Thr-Ile)的两种蛋白进行了体外重组表达与纯化, 并从体内外研究了CTL 的T/T 基因型梭子蟹在抗溶藻弧菌感染中的作用, 结果表明T/T 基因型三疣梭子蟹抗感染能力明显优于C/C 基因型, 该结果为选择T/T 基因型作为抗溶藻弧菌的分子标记培育三疣梭子蟹抗病品系提供了科学依据。

