皮质醇对鱼类性别分化过程的影响及调控机制研究进展
高蕊,闫红伟*,刘鹰,刘奇
(1.大连海洋大学 海洋科技与环境学院,辽宁 大连 116023;2.设施渔业教育部重点实验室(大连海洋大学),辽宁 大连 116023;3.辽宁省河鲀良种繁育及健康养殖重点实验室,辽宁 大连 116023;4.浙江大学 生物系统工程与食品科学学院,浙江 杭州 310058)
性别决定(sex determination)是性别形成的生物学过程,是指未分化的具有双向潜能的性腺决定其向精巢或卵巢方向发育的过程[1]。性别分化(sex differentiation)以性别决定为前提,是未分化的性腺在性别确定后,发育为精巢或卵巢的过程[2]。鱼类是脊椎动物中种类最大的类群,在脊椎动物系统演化过程中具有承前启后的地位。与鸟类、哺乳动物等脊椎动物相比,鱼类的性别决定与分化过程更为复杂,其具有原始性、多样性和易变性的特点,既受到遗传因素的作用,又受某些外部环境因素如温度[3]、光照[4]、pH[5]和种群密度[6]等的影响。因此,揭示鱼类的性别决定与分化机制对理解脊椎动物性别形成过程具有重要的理论意义。更为重要的是,许多鱼类在生长、繁殖和形态上存在雌雄差异。在养殖生产上,如果对某些鱼类开展性别控制和单性养殖,可大幅提高经济效益,故阐明鱼类性别决定及分化机制在育种方面具有重要的应用价值。
性类固醇激素在鸟类、爬行动物、两栖类动物及鱼类等的性别分化中扮演着重要角色。1953年,Yamamoto等[7]首次用雌激素处理青鳉(Oryziaslatipes),获得了性反转的功能性雌性个体。自此,国内外研究人员逐步开展了激素诱导鱼类性别转变的研究。17β-雌二醇(17β-estradiol,E2)是硬骨鱼类卵巢发育和雌性性别维持所必需的雌激素,在性别决定期间,经E2处理能造成斑马鱼(Daniorerio)[8]、尼罗罗非鱼(Oreochromisniloticus)[9]等许多鱼类雌性化。11-酮基睾酮(11-ketotestosterone,11-KT)是鱼类最主要的雄激素,经11-KT处理会造成蜂巢石斑鱼(Epinephelusmerra)[10]、条纹锯鮨(Centropristisstriata)[11]等许多鱼类雄性化。皮质醇(cortisol)既是鱼类主要的糖皮质激素(glucocorticoid,GC),也是一种类固醇激素,其被认为是连接外部环境刺激与内部生理反应的关键因子[12]。当鱼体受到外界应激因子刺激后,下丘脑-垂体-肾间组织(hypothalamus-pituitary-interrenal,HPI)轴会迅速做出反应,由下丘脑释放促肾上腺皮质激素释放激素(corticotropin-release hormone,CRH)作用于垂体,刺激垂体前叶促肾上腺皮质激素细胞分泌促肾上腺皮质激素(adrenocorticotropic hormone,ACTH),ACTH刺激肾间细胞分泌皮质醇激素,并作用于全身各个靶器官[13]。近年来研究发现,皮质醇可能介导了环境因素影响鱼类性别分化的过程。在一些鱼类中,外源皮质醇处理会造成基因型为雌性的个体雄性化,而在皮质醇处理时,使用雌激素或皮质醇合成抑制剂在一定程度上能回救上述皮质醇所造成的雄性化[14-15]。研究还发现,高温、高密度养殖等环境因素会造成一些鱼类皮质醇水平增加,进而导致鱼类个体雄性化[16-17]。在雌雄同体的鱼类中,由于种群社会结构变化所造成的性转变往往伴随着皮质醇水平的改变。目前,皮质醇作用于鱼类性别分化与性转变的具体机制尚不明确,故探讨皮质醇对鱼类性别分化的影响并厘清其调控机制,有助于认知外部环境因素影响鱼类性别的作用途径及性别分化的内分泌机制。本研究中,综述了外源皮质醇处理对鱼类性别分化的作用规律,鱼类性别分化或性转变期环境因素对鱼类内源皮质醇水平的影响规律,以及皮质醇调控鱼类性别分化与性转变的分子机制,以期为研究鱼类性别形成的调控机制提供科学参考。
1 外源皮质醇处理对鱼类性别分化的影响
1985年,Van den Hurk等[18]分别用皮质醇、皮质醇代谢物可的松(cortisone)处理性别未分化的虹鳟(Oncorhynchusmykiss)均能获得性反转的雄性个体,表明糖皮质激素会影响鱼类的性别分化,这意味着鱼类的性别分化受HPI轴调控。上述发现引起了国内外学者的广泛关注。随后,研究人员陆续在雌雄异体鱼类如博纳里牙汉鱼(Odontesthesbonariensis)[19]、漠斑牙鲆(Paralichthyslethostigma)[20],以及雌雄同体鱼类如条纹锯鮨[21]、斜带石斑鱼(Epinepheluscoioides)[22]中发现了皮质醇类似的作用效果。
1.1 皮质醇处理对雌雄异体鱼类性别分化的影响
在雌雄异体鱼类中,皮质醇处理会造成斑马鱼[14]、尼罗罗非鱼[15]等模式鱼类,以及黄颡鱼(Tachysurusfulvidraco)[23]、褐牙鲆(Paralichthysolivaceus)[24]等经济鱼类的雄性化,且皮质醇诱导的雄性化具有剂量依赖性(表1)。如对孵化后7 d的博纳里牙汉鱼分别投喂皮质醇含量为400、800 mg/kg的饲料63 d,产生的雄性比例分别为95%和100%[19]。对孵化后60 d的漠斑牙鲆分别投喂皮质醇含量为100、300 mg/kg的饲料28 d,产生的伪雄鱼比例分别为71%和87%[20]。皮质醇处理的起始时期不同,影响的效果也不同。如在尼罗罗非鱼中,对孵化后5 d且基因型为雌性的幼鱼投喂皮质醇含量为1 000 mg/kg的饲料25 d,会造成幼鱼性腺中卵母细胞的缺失,而在孵化后40 d开始用皮质醇处理,处理50 d后幼鱼性腺中仍具卵母细胞[15]。此外,经皮质醇处理所产生的伪雄鱼可能具有生殖功能。如采用皮质醇含量为300 mg/kg的饲料投喂孵化后12 d的黄颡鱼24 d,所产生的伪雄鱼具有精小叶结构和生理性雄鱼特有的生殖突[23]。
上述经外源皮质醇处理造成鱼类的雄性化,在一定程度上可被雌激素或皮质醇合成抑制剂回救。如对孵化后30 d且基因型为雌性的褐牙鲆研究发现,对照组(正常饲料)、皮质醇组(100 mg/kg饲料)、联合使用皮质醇(100 mg/kg饲料)与E2(1 mg/kg饲料)饲喂组所产生的雄性比例分别为3.3%、50%和0%[24]。而分别用皮质醇(50 mg/kg饲料)、皮质醇合成抑制剂美替拉酮(500 mg/kg饲料)、联合使用皮质醇(50 mg/kg饲料)与美替拉酮(metyrapone)(500 mg/kg)饲料对15日龄的斑马鱼进行为期1个月的饲喂,所产生的雄性比例分别为100%、61.9%和48.6%[14]。
1.2 皮质醇处理对雌雄同体鱼类性别分化的影响
皮质醇处理会诱导一些雌雄同体鱼类的雄性化(表1)。分别用皮质醇(300 mg/kg饲料)、皮质醇受体拮抗剂米非司酮(mifepristone)(6.25 mg/kg饲料)饲喂性别未分化的雌雄同体雌性先熟的条纹锯鮨幼鱼,处理84 d后所产生具有精巢的个体比例分别为31.6%和50.9%,具有兼性性腺的个体比例分别为68.4%和32.0%[21],推测皮质醇通过与皮质醇受体结合的方式对鱼类性别进行调控。而在某些雌雄同体鱼类中,对成鱼进行皮质醇处理也会造成雌性转变为雄性。如对雌性三斑海猪鱼(Halichoerestrimaculatus)成鱼进行为期42 d的皮质醇饲喂(1 000 mg/kg饲料),可造成血浆E2水平下降,性腺中出现生精细胞[16]。通过腹腔注射让雌性斜带石斑鱼成鱼摄入皮质醇(50 mg/kg体质量),可使其性别转变为雄性[22]。然而在停止处理后,已经发生性转变的斜带石斑鱼精子停止性转变,发育中的精子也消失了,这表明皮质醇引起的性转变具有暂时性。
以上研究表明,皮质醇对鱼类的性别分化具有重要作用,可在一定程度上造成鱼类向雄性方向分化,并且进行外源皮质醇处理时,不同浓度、处理时间和处理方式对鱼类性别分化的影响效果不同。皮质醇可以通过皮质醇受体发挥调控作用,皮质醇合成抑制剂或雌激素在一定程度上可回救皮质醇诱导的雄性化。值得注意的是,在一些鱼类中,皮质醇诱导所产生的伪雄鱼具有生殖突,推测具有生殖功能。而在一些鱼类中,皮质醇处理造成的雄性化却是暂时的,停止处理后性别的改变将不可持续。目前,大多数研究未将皮质醇处理产生的伪雄鱼饲养至性成熟,尚不能确定皮质醇处理产生的伪雄鱼是否真正具有生殖功能,未来尚需深入研究。
2 环境因素对鱼类内源皮质醇水平的影响
鱼类的性别分化与性转变受到外部环境因素的影响,在多种环境因素介导的鱼类性别分化与性转变过程中,内源皮质醇水平往往发生了相应的变化(表2),故推断皮质醇可能是响应外部环境信号与鱼类性别分化及性转变的重要因子[20,25]。
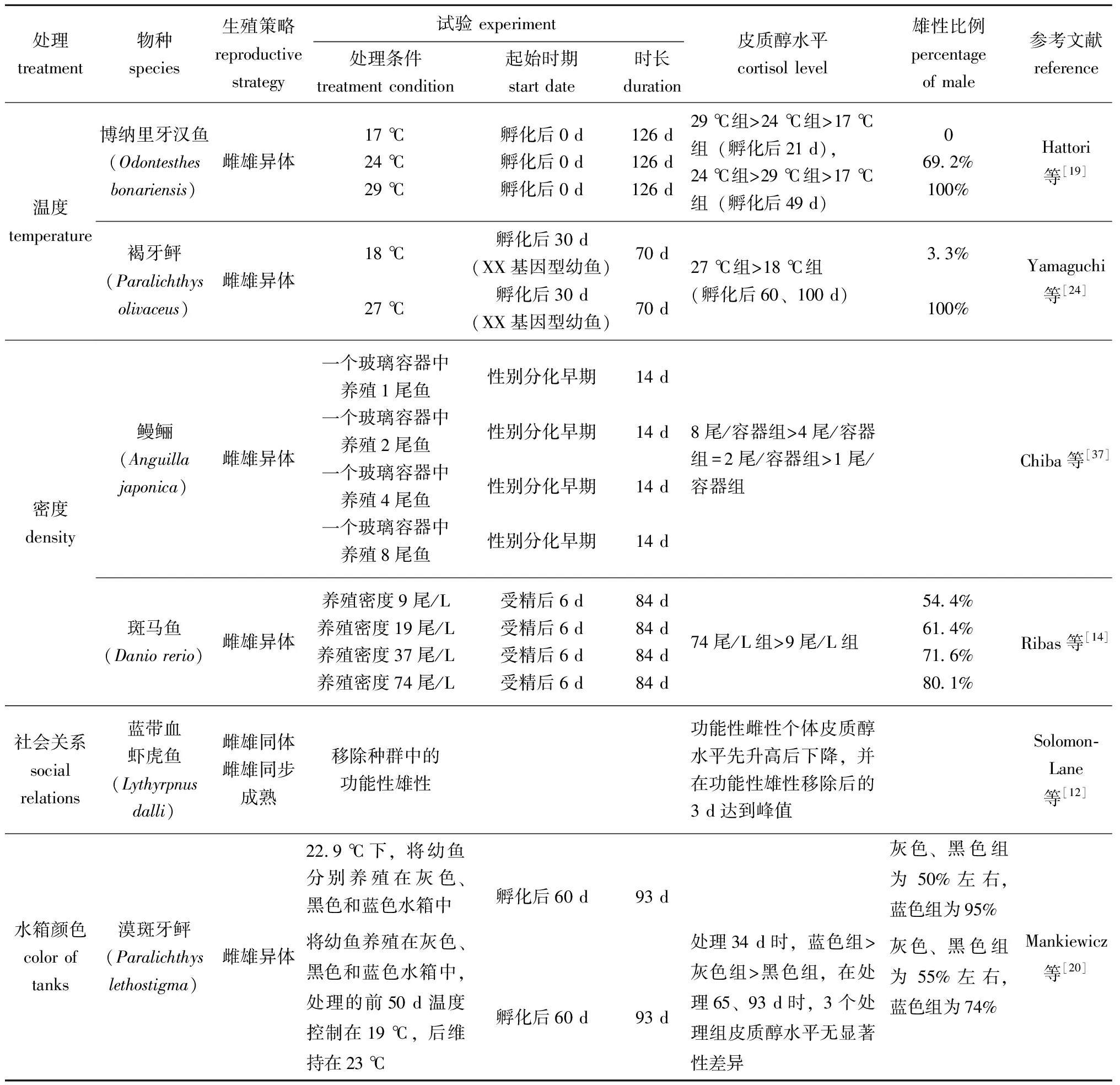
表2 环境因素诱导雄性化过程中鱼类皮质醇水平和性别比例的变化
2.1 温度
在许多鱼类、爬行动物和两栖类生命早期阶段,温度对性别分化过程具有决定作用。1981年,Conover等[26]首次证明,温度会影响大西洋银汉鱼(Menidiamenidia)的性别。此后,研究人员开展了一系列温度对鱼类性别分化的研究。如对孵化后9 d的奥利亚罗非鱼(Oreochromisaureus)进行为期25 d的温度试验,在27、37 ℃条件下产生的雄性后代比例分别为63.0%和97.8%,这表明高温会使奥利亚罗非鱼偏雄性化[27]。对孵化后15~25 d且基因型为雌性的斑马鱼进行高温(37 ℃)处理,可得到100%伪雄鱼[28]。此外,高温处理还会诱导金鱼(Carassiusauratus)[29]、半滑舌鳎(Cynoglossussemilaevis)[30]和褐牙鲆[3]产生雄性化。
以上温度诱导产生的雄性化可能是一种由皮质醇介导的热应激结果。孵化后几周的环境温度决定了博纳里牙汉鱼幼鱼的性别[31],在17 ℃时雄性比例为0%,在24 ℃时为69.2%,在29 ℃时可达100%,且在29 ℃时饲育的幼鱼体内皮质醇水平始终高于17 ℃[19]。24 ℃条件下对博纳里牙汉鱼幼鱼投喂皮质醇含量为800 mg/kg的饲料,可使雄性比例达到100%[32]。在褐牙鲆[24]和青鳉[25]中也存在类似现象,高温条件下饲喂的幼鱼皮质醇水平往往较高,而雄性比例也相对较高。同时研究还发现,在一些鱼类中,饲喂E2或美替拉酮可回救由高温诱导的幼鱼个体雄性化[24-25,33]。
2.2 种群密度
种群密度也会对鱼类性别分化产生一定影响。高密度会造成拥挤胁迫,使幼鱼向雄性化转变[34]。早期研究发现,欧洲鳗鲡(Anguillaanguilla)在800、1 600、3 200 g/m3养殖密度下,雄性比例分别为69%、78%和96%[35]。此外,种群密度还会影响欧洲舌齿鲈(Dicentrarchuslabrax)[36]、斑马鱼[14]和博纳里牙汉鱼[17]等鱼类性别分化。
研究发现,在鱼类早期发育阶段,高密度养殖造成的个体雄性化可能也与皮质醇水平有关。在日本鳗鲡(Anguillajaponica)性别分化期间,成群饲养个体的血清皮质醇水平显著高于单独饲养个体(P<0.05),推断这是造成鳗鲡高密度养殖个体雄性偏多的原因[37]。在斑马鱼的性别分化期也发现,养殖密度越高,体内皮质醇水平越高,雄性比例也就越高[14]。在对XX基因型博纳里牙汉鱼的研究中也得出类似结论,用四周均为镜面的水槽饲养博纳里牙汉鱼比无反射光水槽饲养时雄性比率更高[17]。推断由环境拥挤引起的鱼类个体雄性化过程中,负责处理视觉信息的大脑具有重要作用。
综上,在鱼类性别分化期,高密度养殖造成的拥挤胁迫能促使鱼类体内皮质醇水平升高,而高皮质醇水平是造成鱼类雄性化的一个重要原因。
2.3 种群社会关系
种群中的社会关系变化会造成雌雄同体鱼类,如黑双锯鱼(Amphiprionmelanopus)[38]、双带锦鱼(Thalassomabifasciatum)[39]和蓝带血虾虎鱼(Lythyrpnusdalli)[12]等的性转变,期间也往往伴随着皮质醇水平的变化。
目前,在皮质醇作用于雌雄同体鱼类性别转变的假设中,Perry等[39]认为,在雌雄同体雌性先熟的双带锦鱼中,功能性雄性通过攻击雌性来提高雌性体内的皮质醇水平,从而抑制雌性11-KT合成,进而阻止双带锦鱼雌鱼的雄性化。如果将功能性雄性从社会群体中移除,雌性的压力降低,体内皮质醇水平会下降,雌鱼便会出现雄性化。然而与Perry等[39]假设所矛盾的是,当去除同样为雌雄同体雌性先熟的圆拟鲈(Paraperciscylindrica)功能性雄性后,完成皮质醇植入的功能性雌性仍可性转变为雄性,这表明高皮质醇水平并不能阻止圆拟鲈的雄性化[40]。蓝带血虾虎鱼是一种具有一夫多妻制种群社会关系且雌雄同体雌雄同步成熟的鱼类,研究发现,通常蓝带血虾虎鱼雄性体内皮质醇水平较低,反而体型较大的雌性体内皮质醇水平较高,但在移除种群中功能性雄性后,体型较大的雌鱼皮质醇水平开始上升,并在移除雄性后的1~3 d时达到峰值,后逐渐降低[12]。这表明,在性别转变初期,高浓度的皮质醇对鱼类性转变为雄性起着促进作用,这与Perry等[39]的假设不同。而对于雌雄同体雄性先熟的黑双锯鱼,雄性和雌性皮质醇水平并无差异,但当功能性雌性去除后,种群内各个体的皮质醇水平不断升高,并逐渐有个体性转变为新的功能性雌性[38]。由此可见,皮质醇的升高不仅能促进雌雄同体鱼类性转变为雄性,还可能在雌雄同体鱼类性转变为雌性的过程中发挥作用。
综上所述,皮质醇水平的高低一定程度上反映了一些雌雄同体鱼类在种群中的社会地位。皮质醇参与了雌雄同体鱼类性转变的过程,而高水平皮质醇水平可能促进了一些雌雄同体鱼类的性转变。但目前相关研究还较少,尚需进一步探究皮质醇在雌雄同体鱼类性转变中的作用机制。
2.4 其他环境因素
光照、养殖水槽颜色也会对鱼类的性别分化造成影响。研究发现,这些环境因素可通过影响鱼体皮质醇水平对鱼类性别分化进行调控,如将刚孵化的基因型为雌性的青鳉在绿光环境下饲养60 d,可诱导产生伪雄鱼且伪雄鱼具有生殖功能,所产生的精子可与正常卵子结合孵育全雌子代,推测绿光造成青鳉雄性化是由皮质醇水平变化引起的[4]。在探究养殖水箱对漠斑牙鲆性别分化影响时发现,蓝色水箱中饲养的鱼皮质醇水平较高,相应的雄性比例也较高,推测背景颜色影响了漠斑牙鲆的性别,表明环境因素在性别决定期间充当压力源,并最终造成雄性偏向性[20]。
总之,外部环境因素影响着鱼类的性别分化与性转变,而皮质醇可能是连接外部环境因素与鱼类性别调控的重要纽带,在鱼类的性别分化与性转变中起到了重要作用。
3 皮质醇调控性别分化与性转变的分子机制
研究认为,皮质醇可能通过3种方式介导硬骨鱼类性别分化与性转变[41-42]:一是通过HPI轴与下丘脑-垂体-性腺(hypothalamus-pituitary-gonadal,HPG)轴相互作用,调控鱼类的性别变化;二是通过皮质醇和雄激素合成通路的交互作用,共同调控鱼类的性别变化;三是通过控制鱼类性别相关基因的转录来调控鱼类性别变化。
3.1 HPG轴与HPI轴的相互作用
HPG和HPI轴的相互作用共同调控鱼类的性别分化、发育和繁殖等重要生理过程[41](图1)。脑内一些神经递质通过影响体内皮质醇水平,间接调控着性别分化与性转变过程[43]。
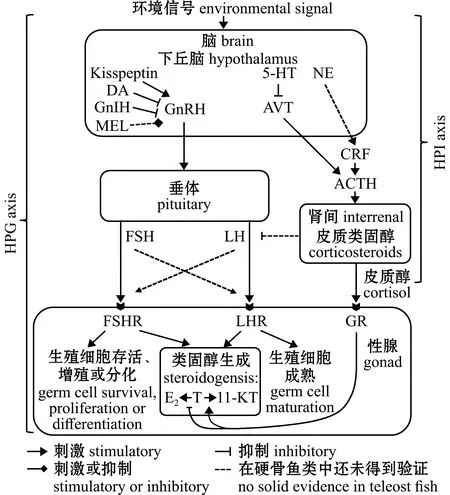
ACTH—促肾上腺皮质激素;AVT—精氨酸催产素;CRF—促肾上腺皮质激素的释放因子;DA—多巴胺;E2—17β-雌二醇;FSH—促卵泡激素;FSHR—促卵泡激素受体;GnIH—促性腺激素抑制激素;GnRH—促性腺激素释放激素;GR—皮质醇激素受体;Kisspeptin—亲吻素;LH—促黄体生成素;LHR—促黄体生成素受体;MEL—褪黑素;NE—去甲肾上腺素;T—睾酮;5-HT—血清素;11-KT—11-酮基睾酮。ACTH—adrenocorticotropic hormone;AVT—arginine vasotocin;CRF—corticotropin-releasing factor;DA—dopamine;E2—17β-estradiol;FSH—follicle-stimulating-hormone;FSHR—follicle-stimulating hormone receptor;GnIH—gonadotropin-inhibitory hormone;GnRH—gonadotropin-releasing hormone;GR—glucocorticoid receptor;LH—luteinizing hormones;LHR—luteinizing hormones receptor;MEL—melatonin;NE—norepinephrine;T—testosterone;5-HT—serotonin;11-KT—11-ketotestosterone.图1 下丘脑-垂体-性腺轴与下丘脑-垂体-肾间组织轴的关系[41]Fig.1 Diagram of the relationship between hypothalamus-pituitary-gonadal (HPG)axis and hypothalamus-pituitary-interrenal (HPI)axis[41]
参与HPG和HPI轴相互作用的神经递质主要包括去甲肾上腺素(norepinephrine,NE)、精氨酸催产素(arginine vasotocin,AVT)、多巴胺(dopamine,DA)、血清素(serotonin,5-HT)、亲吻素(kisspeptin)和褪黑素(melatonin,MEL)等。其中,NE能影响促性腺激素释放激素(gonadotropin-releasing hormone,GnRH)的释放和促性腺激素(gonadotropins,GtHs)的产生[44],且对促肾上腺皮质激素释放因子(corticotropin-releasing factor,CRF)具有调控作用[45]。AVT与哺乳动物精氨酸加压素(arginine vasopressin,AVP)同源,是研究鱼类行为及性转变所关注的主要激素[46]。对于群居性雌雄同体的鱼类,一个社会群体中功能性雄性死亡后,可能会使体型较大的雌鱼下丘脑中的AVT和NE水平上升,造成雌鱼性转变为雄性[47]。这些快速的神经化学变化反过来也影响了GnRH和促黄体生成素(luteinizing hormones,LH)的释放,促进鱼类卵巢细胞凋亡并提高皮质醇水平[43]。一般认为,脑中NE活动增加会导致血清皮质醇水平快速上升,而5-HT的减少会消除NE对AVT信号的抑制,使鱼类在性腺改变的第一阶段维持高皮质醇水平[43]。Kisspeptin是一种下丘脑神经肽,研究发现,在雌性大鼠中,位于下丘脑弓状核区的Kisspetin细胞和糖皮质激素受体(glucocorticoid receptor,GR)共表达[48],推测GR是HPI和HPG轴间联系的纽带,环境信号因子能通过HPI轴作用于GR来影响HPG轴[49]。MEL对鱼类的昼夜节律、血压和季节性繁殖具有调控作用。研究发现,MEL和NE能瞬时调节GnRH产生,以促进LH的生成,启动性转变[50]。随后皮质醇和促性腺激素抑制激素(gonadotropin-inhibitory hormone,GnIH)增加,进而抑制GnRH和GtHs信号传导。在这些因素的共同作用下,鱼体内皮质醇水平增加。皮质醇通过抑制E2合成所必需的cyp19a1a(cytochrome P450,family 19,subfamily A,polypeptide 1a)基因转录,来调控E2的合成和雌性相关基因的表达,导致卵巢退变为精巢[42-43]。
3.2 皮质醇和雄激素合成通路间的交互作用
与哺乳动物不同的是,硬骨鱼类最主要的雄激素不是睾酮(testosterone),而是11-KT。11-KT的合成与皮质醇的合成、代谢过程间存在交互关系,两过程均有11β-羟化酶(11β-hydroxylase,Cyp11b)和11β-羟基类固醇脱氢酶(11β-hydroxysteroid dehydrogenase,Hsd11b)参与催化(图2)。睾酮在Cyp11b催化下转化为11β-羟基睾酮(11β-OH-testosterone),11β-羟基睾酮在Hsd11b催化下转化为11-KT[42,51-52]。同样,11-脱氧皮质醇(11-deoxycortisol)在Cyp11b催化下转化为皮质醇,后皮质醇在Hsd11b催化下代谢为可的松[32,42]。

DHEA—dehydroepiandrosteron;OH—hydoxy.图2 硬骨鱼类类固醇激素合成[42,52]Fig.2 Schematic representation of steroidogenesis in teleost fishes[42,52]
皮质醇也可通过调节编码Hsd11b的hsd11b2(hydroxysteroid 11-beta dehydrogenase 2)基因表达,调控鱼类11-KT的生成,进而影响鱼类性别分化与性转变。有研究发现,在皮质醇诱导博纳里牙汉鱼雄性化的过程中,hsd11b2表达上调。有趣的是,睾酮和11-KT的升高要先于cyp19a1a基因表达量的下降[32]。对斜带石斑鱼的研究中也发现了类似的现象,腹腔注射皮质醇(50 mg/kg体质量)能够使hsd11b2表达迅速上调,11-KT水平随之升高,编码Cyp11b的cyp11b2(cytochrome P450 family 11 subfamily B member 2)基因表达上调和cyp19a1a基因表达下调均发生在11-KT升高之后[22]。由此推测,在一些鱼类性别分化与性别转变过程中,皮质醇可通过直接调控雄激素合成相关基因表达的方式来提高11-KT水平,进而激活雄性化通路。在雄性通路被激活后,雌激素合成相关的通路则被抑制。
3.3 皮质醇调控鱼类性别相关基因的转录
皮质醇可通过先与糖皮质激素受体结合,再与应答基因启动子区域内的糖皮质激素反应元件(glucocorticoid response elements,GRE)结合,直接控制性别相关靶基因转录进而调控鱼类性别转变。一些硬骨鱼类的cyp19a1a、fshr(follicle stimulating hormone receptor)和dmrt1(double-sex and mab-3-related transcription factor 1)基因启动子区域存在GRE[25,53-54],皮质醇-糖皮质激素受体复合物能通过与这些基因上的GRE作用,对鱼类性别开展调控。除此之外,皮质醇还能通过其他未知方式调控性别相关基因的转录。尽管在鱼类的抗苗勒氏管激素amh(anti-Müllerian hormone)基因上未发现GRE,但皮质醇却可以通过调控amh表达影响鱼类性别。
3.3.1 皮质醇抑制cyp19a1a的转录 在鱼类中,睾酮是E2合成的原料[55]。睾酮可以在性腺芳香化酶P450aromA(由cyp19a1a基因编码)和脑芳香化酶P450aromB(由cyp19a1b基因编码)的作用下,转化为E2。cyp19a1a的下调可启动鱼类雌性向雄性转变[41]。有研究发现,皮质醇-糖皮质激素受体复合物能通过与cyp19a1a的启动子区域GRE结合,抑制cyp19a1a的表达,进而阻碍E2产生,造成睾酮在未分化的性腺中积累[56]。对处于性别分化过程中的青鳉进行皮质醇处理发现,皮质醇通过抑制cyp19a1a的表达来阻碍E2合成,进而阻碍性腺向卵巢分化[57]。在对褐牙鲆体外试验中发现,皮质醇通过与cyp19a1a基因启动子区域的GRE结合,直接抑制该基因转录[3]。此外,在条纹锯鮨[21]、虾虎鱼(Gobiodonhistrio)[53]的cyp19a1a上也发现了GRE。
3.3.2 皮质醇调控fshr和dmrt1的转录 除cyp19a1a外,在青鳉fshr、dmrt1启动子区域也发现了GRE序列,皮质醇可能通过作用于这两个基因对性别分化产生影响。促卵泡激素(follicle-stimulating-hormone,FSH)是一种促性腺激素,通过与促卵泡激素受体(follicle-stimulating hormone receptor,FSHR)结合发挥作用。FSH与鱼类的性别分化相关,对性别分化期间的斜带石斑鱼进行FSH注射可加速性腺分化和发育,但长时间FSH注射会诱导性腺向雄性分化[58]。在对青鳉的研究中发现,高温(33 ℃)诱导青鳉雄性化可能是由皮质醇介导的,皮质醇-糖皮质激素受体复合物通过与负责编码FSHR的fshr基因启动子区域的GRE结合发挥作用[25],导致青鳉雌雄激素失衡,产生雄性化[56]。
Dmrt1在鱼类精巢分化中具有重要的作用。青鳉性别决定基因dmrt1bY是由位于常染色体的dmrt1经复制、转座到Y染色体形成的,是调控青鳉精巢发育的主导因子。最近,Adolfi等[54]对皮质醇诱导青鳉雄性化机制的研究发现,青鳉常染色体dmrt1启动子区域存在GRE,推测在青鳉幼鱼早期发育阶段,皮质醇激活了dmrt1基因,使dmrt1接管雄性决定基因dmrt1bY,造成雌鱼的雄性化。
3.3.3 皮质醇上调amh的表达 在哺乳动物胚胎形成时期,抗苗勒氏管激素通过与受体(anti-Müllerian hormone receptor type 2)结合,阻碍苗勒氏管发育为子宫和输卵管[59]。硬骨鱼(除鲟外)无抗苗勒氏管,但在性腺体细胞中仍能检测到抗苗勒氏管激素amh基因的表达[60]。在硬骨鱼(除青鳉外)中,amh参与雄性的性别分化和雌性的卵泡发育,且表达具有性别差异性,雄性生殖腺中amh的表达水平普遍较高[61]。amh主要作用于精巢分化的早期阶段,通过抑制性腺中生殖细胞增殖和类固醇生成以促使鱼体雄性化[41]。尽管未在硬骨鱼类的amh上发现GRE结合位点,但发现高皮质醇水平能造成一些鱼类性腺中amh转录水平上调,如博纳里牙汉鱼[19]、斜带石斑鱼[22]及新西兰背唇隆头鱼(Notolabruscelidotus)[62]等。
性腺中生殖细胞与体细胞的数量比例与鱼类的性别分化也相关,生殖细胞缺失能够造成雌鱼雄性化,性腺生殖细胞过量则会激活雌性相关通路[42]。在性别决定期间,环境压力造成了一些鱼类皮质醇水平上升,随后皮质醇通过上调amh表达来抑制雌性性腺中生殖细胞增殖,最后造成鱼类个体的雄性化转变[63]。Goos等[64]研究发现,哺乳动物精巢的生殖细胞上存在GR,这有助于揭示皮质醇作用于生殖细胞的可能途径,但在鱼类生殖细胞中还未发现GR。有学者认为,amh可能是cyp19a1a的抑制因子,在斑马鱼中高水平的amh往往伴随着低水平的cyp19a1a[65]。如高温(36 ℃)条件下,尼罗罗非鱼中amh表达水平迅速升高,cyp19a1a表达下降[66]。由此推测,高皮质醇水平可能通过上调amh抑制cyp19a1a表达或激活雄性特异性表达途径,促进一些鱼类的雄性化转变。
4 存在问题及展望
鱼类的性别决定与分化具有多样性和可塑性,是极为复杂的生物学过程,没有完全一致的规律。近年来,随着基因组学、表观基因组学、转录组学和蛋白质组学研究的不断深入,以及基因控制技术的进步,鱼类性别分化的研究已取得了一定进展。皮质醇是连接环境因素与鱼类性别分化及性转变的关键因素,对皮质醇功能和作用机制的研究,已成为了解鱼类环境性别调控机制不可或缺的部分,但目前在该方面的研究还不够深入,未来应围绕以下问题重点开展研究。
1)深入开展皮质醇诱导鱼类雄性化的作用机制研究。可结合多组学联合分析、离体或在体试验及基因敲除等手段,深入探究皮质醇调控鱼类性别的信号通路及作用机制。
2)阐明皮质醇与表观遗传因子间的相互关系。随着不断发现更多性别差异的非编码RNA,未来可基于DNA甲基化、组蛋白修饰和非编码RNA调控等表观遗传手段,详细探明皮质醇与鱼类的表观遗传互作模式。
3)充分解析皮质醇影响鱼类雌性化的作用机制。选择雌雄同体雄性先熟的鱼类开展相关研究,解析皮质醇对卵巢分化的影响规律,最终阐明皮质醇影响鱼类雌性化的作用机制,全面地揭示皮质醇在调控鱼类性别分化与性转变过程中的作用。

