复方中草药对中华鳖肠道微生物菌群及非特异性免疫功能的影响
包宇航,章新宇,尹尚军,张海琪,徐洁皓
1.浙江万里学院 生物与环境学院,浙江 宁波 315000
2.浙江省淡水研究所/农业农村部淡水渔业健康养殖重点实验室,浙江 湖州 313000
中华鳖 (Pelodiscussinensis) 是我国重要的淡水水产养殖经济品种之一,进行规模化养殖时,因养殖密度过大、管理不当或养殖水质不佳等因素,会导致各类病害频发。针对细菌性疾病,目前主要依赖抗生素等化学药物进行治疗,而抗生素滥用可能会导致耐药性危机和食品质量安全问题[1-2]。因此,世界卫生组织 (World Health Organization,WHO) 和联合国粮食及农业组织 (Food and Agriculture Organization of the United Nations,FAO) 提倡在水产养殖中预防性地使用天然免疫刺激剂以增强水产动物的免疫能力,进一步预防和控制水产动物疾病,同时避免对动物、人类健康及生态环境造成不良影响[3-4]。
中草药是一种天然免疫刺激剂,能作为饲料添加剂提高养殖动物的生长性能和免疫力,具有一定的疾病预防作用,有望成为抗生素类药物的替代品[5-7]。Yang 等[8]在基础饲粮中添加不同水平的黄芪多糖,发现其可显著提高中华鳖的体质量增长率、生长率和成活率。复方中草药制剂由2 种及2 种以上的草药按一定比例混合而成,可产生协同、相加或拮抗3 种不同的作用效果[9]。与单一草药相比,合理配比的复方中草药制剂可提高养殖动物的抗菌能力、饲料利用率和生产性能[10-11]。如饲料中添加金银花 (Lonicerajaponicathunb)、人参(Panaxginseng) 和山楂 (Crataeguspinnatifidabunge)可有效提高牙鲆 (Paralichthysolivaceus) 的生长率和饲料转化效率[12];添加黄芪 (Astragaliradix)、党参(Codonopsisradix)、菊花 (Floschrysanthemi Indici) 等可显著促进黄颡鱼 (Pelteobagrusfulvidraco)的生长[13]。Takaoba 等[14]采用神曲 (Massamedicata)、山楂、青蒿 (Artemisiacaruifoliabuch)、铁皮石斛 (Dendrobiumofficinalekimura) 及其复方剂饲喂真鲷 (Pagrusmajor) 幼鱼,发现可促进其生长,并提高其对鳗弧菌 (Vibrioanguillarum) 的抵抗力。
中华鳖作为卵生脊椎动物,具有较为完善的免疫系统,可通过非特异性或特异性免疫有效抵御病原体入侵[15-16]。溶菌酶 (LZM)、酸性磷酸酶 (ACP)是非特异性免疫相关的重要酶类,且溶菌酶能直接杀死细菌或消化病原体[17]。碱性磷酸酶 (AKP) 是水产动物免疫防御中重要的水解酶,研究显示其参与文昌鱼 (Branchiostomatsingtauense) 的抗菌免疫反应[18]。肠道不仅是消化器官,其黏膜免疫系统参与构成机体免疫的第一道防线[19]。本研究通过在基础饲料中添加2% (质量分数)的复方中草药制剂饲喂中华鳖,测定其血清中非特异性免疫酶活性,同时利用16S rDNA 高通量测序研究该复方制剂对中华鳖肠道菌群的影响,探究中草药有效成分是否通过优化中华鳖肠道菌群、提高益生菌丰度等影响机体免疫力,以为中华鳖的病害防治提供参考。
1 材料与方法
1.1 实验材料
实验用中华鳖购自浙江湖州某养殖场,3 月龄健康中华鳖100 只,平均体质量为 (44.59±9.23) g。根据本实验室前期的研究结果,采用处理成粉状的黄芪 10 g、鱼腥草 (Houttuyniacordatathunb) 10 g、五倍子 (Rhuschinensismill) 10 g、金银花 10 g、白头翁 (Pulsatillachinensisregel) 10 g、石榴皮 (PunicagranatumL) 10 g、黄连 (Coptidisrhizoma) 5 g、山楂 15 g、艾叶 (Artemisiaargyilevl) 10 g、羊栖菜多糖10 g 混合后置于阴凉干燥处保存备用,作为复方饲料添加剂。实验用基础饲料配方 (质量分数):优质白鱼粉20%、α-淀粉25%、啤酒酵母(Saccharomycescerevisiae) 2%、发酵豆粕30%、谷朊粉20%、酶制剂0.4%、氯化胆碱0.2%、磷酸二氢钙0.8%、维生素类1%、矿物元素类0.6%,其营养组成 (质量分数) 为粗蛋白48%、水分10%、粗脂肪3%、粗纤维1.5%、粗灰分17%、总磷3%、赖氨酸2%。
1.2 实验分组与处理
选取健康中华鳖100 只,随机分为10 组,1—5 组为对照组 ,6—10 组为实验组,每组10 只,为防止个体之间打架斗殴致死,每组体质量差异在10 g 以内。本次养殖采用恒温循环水养殖系统,实验用水为曝气后的自来水,pH 7.3,亚硝酸盐(NO2-N) 质量浓度为0.005 mg·L-1,氨氮(NH+4-N) 质量浓度为0.01 mg·L-1,水温维持在(28±2) ℃。其中,对照组投喂配合饲料粉,实验组使用复方中草药拌饲投喂,每1 kg 配合饲料粉添加复方中草药制剂20 g,定时定点投喂,每天2 次,连续投喂42 d 后进行肠道菌群和非特异免疫酶活性测定。
1.3 样品采集
1.3.1 肠道内容物采集
中华鳖喂养42 d,停饲24 h 后,从对照组和实验组随机各取10 只中华鳖,麻醉,颈动脉放血后将鳖体解剖并剥离出肠道,剪取小肠后段至直肠组织,取出内容物至无菌离心管中,对照组记为CG1—CG10,实验组记为CPG1—CPG10,样品送至杭州联川生物技术股份有限公司进行16S rDNA高通量测序。
1.3.2 血清采集
中华鳖喂养42 d,停饲24 h 后,在对照组和实验组随机各取24 只,以未处理中华鳖为0 h,其余鳖腹腔注射107CFU·mL-1嗜水气单胞菌(Aeromonashydrophila) 1 mL,在攻毒后的第12、第24 和第72 小时以颈动脉采血法取血,每个时间点取6 只。收集血液至2 mL离心管内,8 000 r·min-1离心1 min,分离血清和血细胞,取上层血清。嗜水气单胞菌攻毒后的对照组命名为CG0h、CG12h、CG24h、CG72h,实验组命名为CPG0h、CPG12h、CPG24h、CPG72h。
1.4 肠道微生物高通量测序分析
使用E.Z.N.A.®Stool DNA Kit 提取试剂盒(Omega Bio-Tek) 提取肠道内容物DNA,实验操作参照试剂盒说明书。以引物5'-CCTACGGGNGGCWGCAG-3'和5'-GACTACHVGGGTATCTAATCC-3' PCR 扩增样品中细菌16S rDNA V3—V4 区序列,利用AMPure XT beads 回收试剂盒 [贝克曼库尔特国际贸易 (上海) 有限公司] 回收扩增产物。使用Illumina 的文库定量试剂盒 (Illumina 公司) 对PCR 产物进行定量测量,并在每个文库中添加正确比例的Adaptor 和Index 序列。合格的文库浓度应在2 nmol·L-1以上,将合格文库进行梯度稀释,使用NaOH 变性为单链后,将文库放入测序仪中进行2×250 bp 的双端测序。选择NovaSeq 6000 测序仪对文库进行测序分析。
根据barcode 信息对样品进行数据拆分,去除RawData 的引物序列和平衡碱基序列后将每一对paired-end reads 根据overlap 区拼接合并成一条更长的tag。对测序reads 进行窗口法质量扫描,将read 从窗口起始到3' 终止的部分截掉 (平均质量值低于20 时),去除截短后长度小于100 bp 的序列、截短后N (不确定模糊碱基) 的含量在5%以上的序列和嵌合体序列。将所得数据通过DADA2 进行长度过滤和去噪,获得ASV (feature) 特征序列和ASV (feature) 丰度表格再进行Alpha 多样性分析。使用SILVA 数据库统计各样本中各物种的丰度,并采用Fisher's exact test 和 Mann-Whitney U test 对各组之间进行差异分析。
LDA Effect Size (LEfSe) 分析利用Kruskal-Wallis 秩和检验检测样本所含特征物种,通过检测不同组间的物种丰度差异,获得显著性差异物种。再利用Wilcoxon 秩和检验检测所获得的显著性差异物种的所有亚种是否处于同一分类级别,并使用线性判别分析 (Linear discriminant analysis,LDA) 得到最终的差异物种。通过PICRUSt2 软件标记基因序列并预测菌群功能丰度,再利用STAMP 进行差异分析。
1.5 非特异性免疫酶活性检测
根据各试剂盒说明书,使用酶标仪对采集的血清样品进行总超氧化物歧化酶 (T-SOD)、LZM、ACP 和AKP 活性测定 (试剂盒均购于南京建成生物工程研究所)。
1.6 数据处理
采用SPSS 19.0 软件进行单因子方差分析(One-way ANOVA),P<0.001 为差异极其显著,P<0.01 为差异极显著,P<0.05 为差异显著,P>0.05 为无显著性差异。结果以 “平均值±标准误()”表示。
2 结果
2.1 复方中草药对中华鳖肠道菌群的影响
2.1.1 菌群Alpha 多样性分析
中华鳖肠道菌群Alpha 多样性指数如图1 所示,Shannon 指数反映物种的相似性,结果显示两组样品间的物种多样性无显著性差异 (P>0.05)。Chao1 指数反映物种的丰富度,结果发现实验组特征数据的丰富程度显著高于对照组 (P<0.05)。
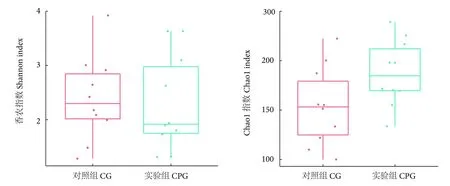
图1 Alpha 多样性指数 box 图注:对照组投喂基础饲料;实验组投喂添加2%的复方中草药的饲粮。后图同此。Fig.1 Alpha diversity index box chartNote: CG.Feeding basal diet; CPG.Feeding diet with 2% of Chinese herbal compound.The same case in following figures.
2.1.2 样品菌群门、属水平结构组成差异分析
中华鳖肠道菌群门水平组成如图2 所示。对照组和实验组的优势菌门相同,均为变形菌门 、厚壁菌门、拟杆菌门、梭杆菌门和软壁菌门等。然而,对照组和实验组中每个优势门的占比存在差异。与对照组相比,实验组的变形菌门、软壁菌门和浮霉菌门相对丰度明显升高。对照组,变形菌门占48.89%,而实验组占比为72.98%。此外,实验组软壁菌门和浮霉菌门占比分别是对照组的32 和2.25 倍。实验组的蓝藻门和梭杆菌门菌群相对丰度占比降低,分别为对照组的26.47% 和22.17%。

图2 对照组和实验组肠道菌群组成丰度差异 (门水平)Fig.2 Relative abundance of intestinal microflora composition of CG and CPG at genus level
中华鳖肠道菌群属水平组成如图3 所示,对照组和实验组排名前8 的优势菌属均为伯克霍尔德菌属 (Burkholderia-Caballeronia-Paraburkholderi)、Romboutsia、螺杆菌属 (Helicobacter)、梭菌属(Clostridium)、Epulopiscium、柠檬酸杆菌属 (Citrobacter)、戴尔福特菌属 (Delftia) 和乳杆菌属(Lactobacillus)。与对照组相比,实验组Epulopiscium、柠檬酸杆菌属和乳杆菌属的相对丰度升高,占比分别是对照组的4.66、55.9 和4.12 倍;而Romboutsia相对丰度在实验组占比降低,为对照组的12.67%。
2.1.3 样品菌群指示物种分析
利用LEFse 分析对照组和实验组菌群差异,获得两组主要的特异性菌群,作为各样品的指示种,分析结果如图4 所示。实验组的特异菌群为变形菌门的根瘤菌科、鞘脂单胞菌科、鞘脂单胞菌目及柠檬酸杆菌属等菌群,对照组的特异菌群为Variovorax菌群。

图4 对照组和实验组肠道菌群 LEfSe 差异分析图注:无显著差异的物种统一着色为黄色,差异物种跟随组进行着色,红色节点表示在红色组别中起到重要作用的微生物类群,绿色节点表示在绿色组别中起到重要作用的微生物类群;圆圈大小与微生物相对丰度成正比例关系。Fig.4 LEfSe variance analysis of intestinal microflora of CG and CPGNote: Species without significant differences are uniformly colored in yellow,and differential species are colored following the group; red nodes represent microbial taxa that play an important role in the red group,and green nodes represent microbial taxa that play an important role in the green group; the size of the circle is proportional to the relative abundance of microorganisms.
2.1.4 样品菌群功能预测
通过PICRUSt2 预测实验组和对照组肠道菌群的可能功能 (图5),与对照组相比,实验组的脂代谢、氨基酸合成、碳水化合物的代谢、蛋白质的合成、消化系统和免疫系统等功能显著强于对照组,具体体现在缬氨酸降解、磷脂酰甘油生物合成、鸟苷酸和腺苷酸合成、β-丙氨酸合成、生物素合成、L-赖氨酸合成等途径。

图5 对照组和实验组肠道菌群功能预测 STAMP 差异分析注:左图所示为不同微生物功能预测在两组样本中的丰度比例,右图为95%置信度区间内微生物功能预测丰度的差异比例;左边纵坐标轴为不同的微生物功能预测分类。Fig.5 STAMP variance analysis of functional prediction of intestinal microflora of CG and CPGNote: The left panel shows the proportion of abundance of different microbial functional predictions in the two groups of samples,and the right panel shows the proportion of differences in the abundance of microbial functional predictions within the 95% confidence interval;the left vertical axis shows different microbial functional prediction classifications.
2.2 复方中草药对中华鳖免疫酶指标的影响
中华鳖血清免疫酶活性测定结果显示,实验组中华鳖血清中T-SOD、LZM、ACP 及AKP 4 种酶的初始活性均显著高于对照组 (图6)。嗜水气单胞菌刺激后,实验组和对照组的T-SOD、LZM、ACP 3 种酶的活性均呈上升趋势:实验组的T-SOD、ACP 活性在第12、第24 小时显著高于对照组(P<0.05),LZM 活性在第24 小时显著高于对照组(P<0.05),但两组酶活性在第72 小时无显著性差异。刺激后血清中AKP 的酶活性先下降后升高,实验组AKP 活性在第12、第24 小时显著高于对照组 (P<0.05),而两组在第72 小时无显著性差异。
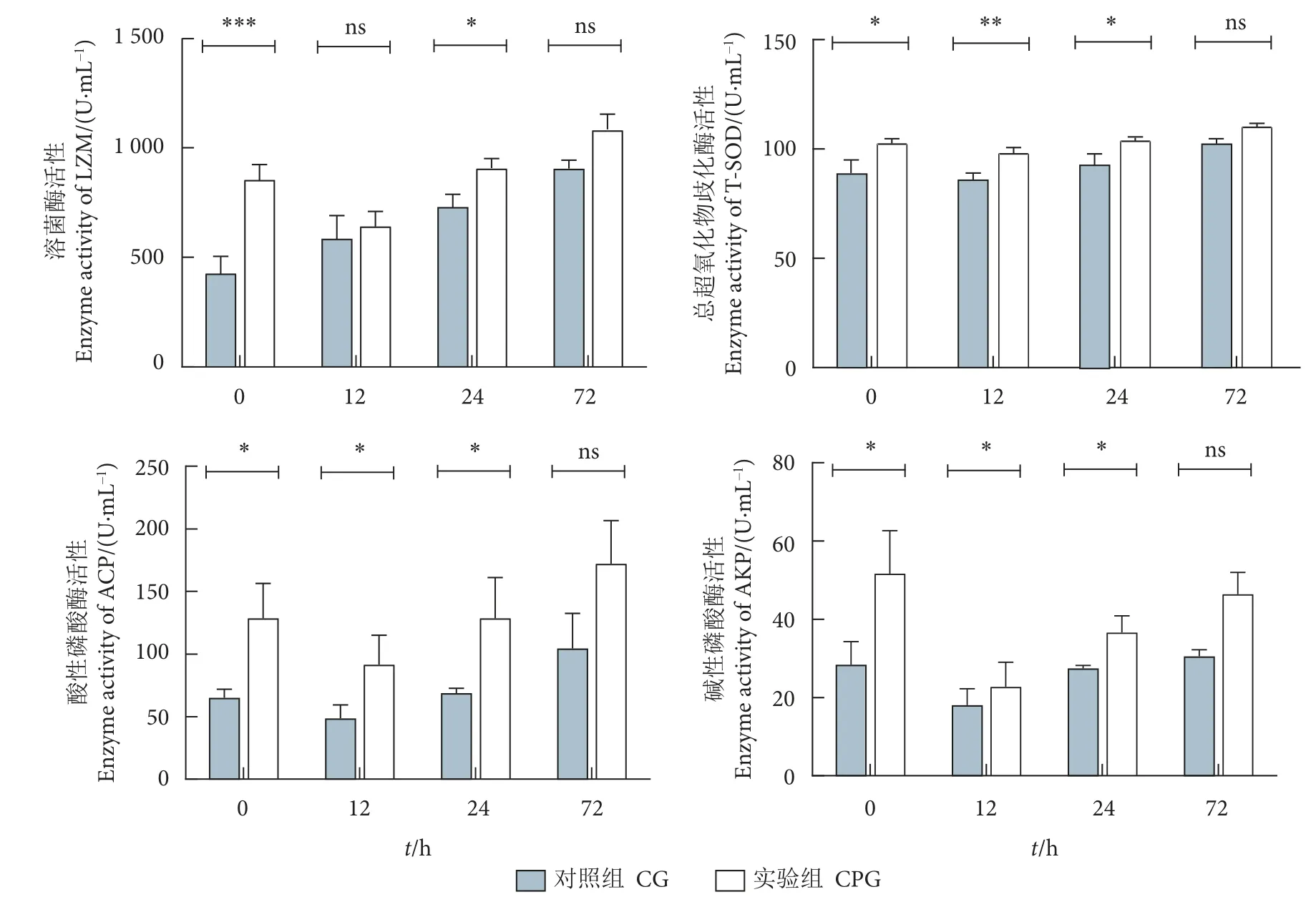
图6 复方中草药对嗜水气单胞菌刺激前后中华鳖血清中总超氧化物歧化酶、溶菌酶、酸性磷酸酶和碱性磷酸酶活性的影响注:误差线用标准误值 (n=6) 表示;*.P<0.05,**.P<0.01,***.P<0.001,ns 表示无显著性差异。Fig.6 Effect of Chinese herbal compound on T-SOD,LZM,ACP and AKP activity in serum of P.sinensis before and after A.hydrophila challengeNote: The error bar is expressed by the SEM value (n=6); *.P<0.05,**.P<0.01,***.P<0.001; ns.No significant differences.
3 讨论
水生生物的肠道菌群与个体健康、免疫屏障、抵御感染能力等息息相关[20]。肠道菌群的多样性可作为评估肠道健康的指标[21]。本文通过Shannon 指数来评估对照组和实验组中华鳖肠道菌群的多样性,结果显示两组肠道菌群类别具有一定的共性,均以变形菌门和厚壁菌门为主,与其他水生生物肠道菌群的组成相似[22]。据报道,变形菌门可能有助于刺激机体免疫系统发育和维持机体正常的免疫功能[23],而厚壁菌门参与肠道黏膜功能的维持和肠道微生态环境的调节[24],因此推测它们可能在维持中华鳖的肠道菌群稳态中发挥重要作用。通过Chao1 指数评估了两组中华鳖肠道菌群的丰富度,结果表明饲喂复方中草药可使中华鳖肠道优势菌门占比发生变化。实验组中华鳖肠道中软壁菌门、浮霉菌门丰度均高于对照组,即复方中草药对这些菌群的增长具有促进作用。研究表明,软壁菌门和浮霉菌门等有益菌群可以促进机体先天免疫相关的代谢功能,且浮霉菌能产生一些抗菌化合物从而维持机体免疫功能[25-26]。本研究检测发现,实验组中华鳖先天性免疫酶活性高于对照组,推测其可能与肠道中软壁菌和浮霉菌的存在和丰度相关。
从属水平对肠道菌群进一步分析,发现添加复方中草药能促进中华鳖肠道中梭菌属、乳酸菌属等益生菌的菌群丰度。梭菌属是鱼类肠道常见菌属,其可分解利用纤维素、单糖和木聚糖等糖类为宿主提供营养[27-28]。从人类粪便样本中分离的梭菌能够在结肠中积累调节性T 细胞 (Regulatory T cells) ,可影响中枢及外周神经系统作用于免疫细胞的信号,从而抑制肠道炎症反应,是肠道中的正向菌群[29]。本研究中实验组梭菌属丰度是对照组的1.62 倍,表明中草药添加剂可以促进梭菌属的定殖,优化肠道菌群结构。乳酸菌也是水产养殖常见的益生菌之一,具有较强的黏附能力,便于长期定殖于肠道,通过增强肠道免疫屏障提高免疫能力,促进机体生长[30-31],其功能已在尼罗罗非鱼 (Oreochromisniloticus)、鲤 (Cyprinuscarpio)、凡纳滨对虾 (Penaeusvannamei) 等水生动物中得到验证[32-34]。乳酸菌属的乳球菌和乳杆菌可通过口服在舌齿鲈(Dicentrarchuslabrax) 的肠道内定殖,其产生的乳酸菌素可作用于弧菌的细胞膜,导致膜内物质和能量泄露,从而达到抑菌效果[35-36]。鲤饲粮中添加复方中草药 (黄芪、鱼腥草、板蓝根、茯苓) 后,肠道中乳酸菌的含量有所增加[37],这与本研究结果吻合。衣原体常以上皮囊肿形式引起呼吸系统感染,是危害水产养殖的病原体之一[38]。本研究显示,实验组中衣原体在属水平的丰度占比降至对照组的2.16%,推测复方中草药的添加能够降低有害菌的菌群丰度,但其作用机理需通过实验进一步挖掘。
肠道菌群及其代谢物通过改善宿主内分泌功能以维持机体生理稳态[39]。通过对测序结果分析可知,中华鳖肠道微生物主要参与类固醇激素合成、脂肪酸代谢和赖氨酸合成等代谢途径。对照组和实验组肠道菌群的功能预测分析结果显示,实验组在代谢能力方面表现更突出。据报道,氨基酸代谢、脂肪酸代谢、碳水化合物代谢等功能与氧化应激紧密相关[40],从钩吻 (Gelsemiumelegans) 中提取的生物碱能够提高武昌鱼 (Megalobramaamblycephala) 肠道菌群的酶活性,提高其代谢效率[41],这与本研究结果一致。此外,实验组肠道菌群在氨基酸合成、蛋白质合成、消化系统和免疫系统等方面也表现出更强的功能。
T-SOD、LZM、ACP 和AKP 是常用于评估水产动物非特异性免疫能力的指标酶。丁鉴锋等[42]、Yin 等[43]、Taee 等[44]、Shaluei 等[45]分别以这4 种酶为指标研究了不同配方或比例中草药添加对仿刺参 (Apostichopusjaponicus) 幼参、斑节对虾(P.monodon)、虹鳟 (Oncorhynchusmykiss) 等水生动物先天性免疫能力的影响。本研究发现,嗜水气单胞菌攻毒激活中华鳖的非特异性免疫,对照组和实验组4 种酶的活性均在第72 小时达到峰值。在正常状态下及刺激后,实验组血清中的T-SOD、LZM、ACP 及AKP 的活性在第0、第12、第24 小时均显著高于对照组,实验组LZM 的活力在第0 和第24 小时高于对照组,但在第12 小时无显著性差异,推测该复方中草药饲喂后能够提高中华鳖的先天性免疫功能。草药中的酚类化合物是一种重要的天然抗氧化剂,可通过上调超氧化物歧化酶 (SOD)等内源性抗氧化酶活性来维持机体内的氧化还原平衡,防止自由基堆积和氧化损伤[46-47];黄酮类、多糖类化合物可通过调节TLRs 信号通路或激活巨噬细胞调控非特异性免疫相关酶的活性[48-49]。刘红柏等[37]将黄芩、茯苓、板蓝根等制成复方中草药制剂,与基础饲料混合投喂后可增强鲤的先天性免疫能力,与本研究结果类似。
4 结论
本研究在饲料中添加复方中草药后,对中华鳖肠道菌群及非特异性免疫功能进行分析,结果表明复方中草药可以影响肠道菌群的构成与群落特征,通过提高益生菌菌群丰度以优化肠道菌群结构,从而提高机体的免疫能力,故本复方中草药具有一定的应用前景。

