基于非靶向代谢组学分析两种日粮模式下克氏原螯虾肌肉的代谢差异
鲍俊杰,王永杰,陈红莲,孙 雯,张 静,周蓓蓓
1.安徽农业科学院水产研究所,安徽 合肥 230031
2.水产增养殖安徽省重点实验室,安徽 合肥 230031
克氏原螯虾 (Procambarusclarkii) 又称小龙虾,于20 世纪30 年代引入中国,因环境适应能力强、食性广、繁殖快、产量高等特点受到养殖者的青睐,近年来已发展成为我国重要的水产养殖品种。2021 年,我国克氏原螯虾产业总值达到4 221.95亿元,经过40 年的发展,已形成集繁育养殖、加工出口、物流餐饮、文化节庆为一体的完整产业链,成为我国农业发展的重要支柱产业之一[1]。随着克氏原螯虾大面积养殖的兴起,其品质参差不齐的问题也随之显现。因此,如何采用复合蛋白来源提升其养殖健康和品质[2],亟须深入研究。
代谢组学技术是研究小分子物质及其在生物体中动态变化的技术[3],检测方式上可以分为非靶向代谢组学和靶向代谢组学,广泛应用于临床医学[4]、食品科学[5]、环境功能[6]等多个研究领域。代谢组学常结合核磁共振技术 (NMR)[7]、液相色谱-质谱联用技术 (LC-MS)[8]、气相色谱-质谱联用技术 (GC-MS)[9]等检测手段满足不同的实验需求[10]。近年代谢组学也已应用于水产领域,刘慧茹等[11]利用代谢组学技术,结合斑马鱼 (Danio rerio) 评价模型,发现皂苷类成分可能与抗疲劳活性有关;张彦坤等[12]通过代谢组学分析测定剑鱼(Xiphophorushelleri) 肝脏内源物的变化,探究了饥饿胁迫对水生动物的影响。
饲料不仅应给动物体提充足的营养和能量[13],还应具有提升养殖功效的活性物质[14]。目前,关于提升水产养殖功效的报道多集中在考察养殖产品的生长、生化指标和肠道微生物检测等方面[15-16]。近些年针对不同日粮下动物肌肉中代谢产物变化的研究逐渐增多,认为肌肉中氨基酸、脂类和功能物质等代谢产物的变化直接影响了肌肉品质[17-18],并结合代谢组分析更加全面准确地把握营养代谢乃至相关基因调控等方面的信息[19-20]。但目前关于克氏原螯虾代谢组学相关的研究报道较少。针对以上问题,本文利用非靶向代谢组学技术结合超高效液相色谱-质谱技术 (UHPLC-MS),通过多元统计分析进行差异代谢物筛选,并对差异代谢物进行 KEGG (Kyoto Encyclopedia of Genes and Genomes) 通路分析,对比两种日粮模式下克氏原螯虾肌肉代谢组的差异及主要特征标志物,探究不同日粮下克氏原螯虾肌肉代谢产物的变化,以为提升克氏原螯虾养殖品质提供参考。
1 材料与方法
1.1 实验设计与样品采集
挑选附肢健全、活力较好的克氏原螯虾于2022 年6 月养于安徽省农业科学院水产研究所基地的克氏原螯虾虾塘。选择临近塘口,保持水源相同,虾塘面积为0.200~0.267 hm2,放养虾苗体质量为5~10 g,放养密度为10 尾·m2,养殖周期为60 d,分别投喂蛋白质质量分数为32%的常规饲料和发酵饲料,饲料配方和基本组成见表1。每日07:00 和18:00 各投饲1次,日投喂量约为虾体质量的4%。养殖期结束后,分别从不同组塘口各取5 尾虾共混合5.0 g 样品冷冻待测备用,每个处理均取3 份作为重复。
克氏原螯虾的体质量增长率 (WGR) 和特定生长率 (SGR) 指标按以下公式计算:
式中:RWG为体质量增长率(%);RSG为特定生长率(%·d-1);m0为养殖初始体质量 (g);mt为养殖末体质量 (g);t为饲喂时间 (d)。
1.2 仪器与材料
低温高速离心机 (Eppendorf 5430R);超声破碎仪 (宁波新芝 JY92-II);MP Fastprep-24 匀浆仪 (MP Biomedicals);质谱仪AB Triple TOF 6600;超高压液相色谱仪Vanquish UHPLC、色谱柱:Waters,ACQUITY UPLC BEH Amide (1.7 μm,2.1 mm×100 mm)。甲醇、醋酸铵、甲酸、乙腈、乙酸铵等购于美国CNW Technologies 科技公司,均为色谱纯;常规饲料和发酵饲料均购于安徽万士生物制药有限公司。
1.3 样本提取
克氏原螯虾肌肉样品室温下解冻后,称取100 mg 到1.5 mL EP 管中,加入钢珠和500 μL 提取液[V(甲醇)∶V(乙腈)∶V(水)=2∶2∶1],-20 ℃低温预冷2 min,经研磨处理4 min,使用匀浆仪混匀,低温超声萃取30 min,重复2 次,置于-20 ℃下60 min,然后 4 ℃离心15 min (13 000 r·min-1),取上清液150 μL (分装管900 μL)。使用0.22 μm 的有机相针孔过滤器过滤后,转移到进样小瓶,-80 ℃下保存。质控样本 (Quality control,QC) 由所有样本的提取液等体积混合制备而成,每个QC 的体积与样本相同。
1.4 UHPLC-MS 分析条件
UHPLC 条件:样品采用超高效液相色谱系统进行分离;柱温25 ℃;流速0.5 mL·min-1;进样量2 μL;流动相组成A:水+25 mmol·L-1乙酸铵+25 mmol·L-1氨水,B:乙腈。梯度洗脱程序:0~0.5 min,95%B;0.5~7 min,B 下降至65%;7~8 min,B 下降至40%;8~9 min,B 维持40%;9~9.1 min,B 上升至95%;9.1~12 min,B 维持95%。整个分析过程中样品置于4 ℃自动进样器中。为避免仪器检测信号波动而造成的影响,采用随机顺序进行样本的连续分析。样本队列中插入QC 样品,用于监测和评价系统的稳定性及实验数据的可靠性。
质谱条件:分别采用电喷雾电离 (ESI) 正离子和负离子模式进行检测。离子源温度:600 ℃,喷雾电压 (ISVF)±5 500 V (正负两种模式);其他参数正负离子模式下相同,毛细管温度为320 ℃;辅助气体加热温度420 ℃;鞘气体流量40 arb;辅助气体流量为20 arb;去簇电压 (DP):±60 V (正负两种模式),碰撞能量:(35±15) eV。
1.5 数据分析
生长性能数据采用SPSS 21.0 软件统计分析,数据均以“平均值±标准差 ()”表示。采用ANOVA 过程进行单因子方差分析,显著性水平为P<0.05。
代谢组数据使用ProteoWizard 软件,将二级质谱原始数据转成mzXML 格式,再使用XCMS 进行峰对齐,做保留时间矫正和峰识面积提取等工作,同时使用自撰写R 程序包和自建二级质谱数据库对峰进行物质鉴定。采用R 软件对鉴定的代谢产物进行主成分分析和正交偏最小二乘法判别分析。根据变量重要性投影评分,将VIP>1 且P<0.05 的代谢物定义为差异代谢物 (Significant changed metabolites,SCMs),将得到的差异代谢物通过代谢通路数据进行注释解析,并通过富集分析法分析发酵饲料组与常规饲料组的变化,筛选关键代谢通路。
2 结果
2.1 不同饲料对克氏原螯虾生长性能的影响
由表2 可知,采用两种不同饲料饲喂克氏原螯虾,养殖期第60 天结束时,两组间克氏原螯虾的体质量增长率和特定生长率无显著性差异(P>0.05)。

表2 不同饲料对克氏原螯虾生长性能的影响Table 2 Effect of different feeds on growth performance of crayfish
2.2 代谢物总览
本研究在正离子和负离子模式下分别筛选出581 和495 个化合物。通过与数据库匹配,正离子和负离子模式下分别注释到269 和273 个化合物(Human Metabolome Database,HMDB)。将所有的代谢化合物进行分类分析,被分为15 个一级类别,其中主要为有机酸及其衍生物,其次是脂质和类脂分子,以及有机杂环化合物、核苷酸类等。
2.3 多元统计分析结果
2.3.1 主成分分析 (Principal components analysis,PCA) 结果
由PCA 分析图 (图1) 所示,每个散点表示一个样本,样本全部处于95%置信区间,对照组与实验组的检测结果说明代谢产物虽存在一定差异,可被区分,但也有部分相似;这可能是由于蛋白质、脂肪等物质产生的水解产物如肽类、氨基酸、脂肪酸等有一定程度的相似。

图1 发酵饲料组和常规饲料组代谢物的 PCA 分析图Fig.1 PCA plots of metabolites in fermented feed group and general feed group
2.3.2 正交偏最小二乘法判别分析 (OPLS-DA) 结果
OPLS-DA 模型分析结果见图2 和图3,可见两组样本明显分离,表明两组数据存在显著性差异。正离子模式下模型R2Y=0.993、Q2=0.965,负离子模式下模型R2Y=0.991、Q2=0.927。随着置换保留度逐渐降低,随机模型的R2和Q2均逐渐下降,说明两种模式下原模型不存在过拟合现象,模型稳定性良好。

图2 发酵饲料组和常规饲料组代谢物的 OPLS-DA 分析图Fig.2 OPLS-DA plots of metabolites in fermented diet group and general diet group

图3 差异代谢物的OPLS-DA置换检验结果Fig.3 OPLS-DA model replacement test results of differential metabolites
2.3.3 差异代谢物火山图
利用t检验和变异系数法比较两组之间的代谢产物差异,设立筛选条件,对正、负离子模式下检测到的所有代谢物 (含未被鉴定的代谢物) 进行差异分析,采用火山图进行可视化展示 (图4),T 和CK 组在正离子和负离子模式下共筛选出差异表达代谢物分别为581 和495 个,其中正离子代谢产物上调314 个、下调267 个,负离子代谢产物上调258 个、下调237 个。
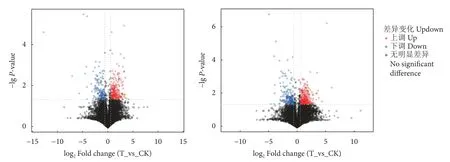
图4 发酵饲料组对比常规饲料组的差异代谢物筛选Fig.4 Differential metabolite screening volcano maps of fermented diet group (T) and general diet group (CK)
2.3.4 差异代谢物中显著差异代谢物筛选结果
根据差异代谢物做筛选,结果如表3 所示。在正离子和负离子模式下分别筛选出17 和10 种显著差异代谢物。其中VIP 表示变量投影重要度;FC 表示差异倍数,FC>1 表示该代谢物上调,FC<1 表示该代谢物下调;m/z 表示质荷比;显著性分析P值越小,表示差异越显著;RT 代表代谢物在色谱上的保留时间,即出峰时间(s)。
2.3.5 差异代谢物的层次聚类分析
图5 为显著差异代谢物 (VIP>1,P<0.05) 的层次聚类分析结果,横轴表示发酵饲料组与常规组,纵轴表示相应的差异代谢物,红色代表显著性上调,蓝色代表显著性下调,颜色深浅表示上、下调的程度。由图可见同组的样本聚在同一簇内,说明同组样本之间的相似度高于组间。筛选出的27 种差异显著的代谢物,发酵饲料组有19 种代谢物发生上调,8 种代谢物发生下调。正离子模式下发酵饲料组中腺苷酸基琥珀酸、鞘氨醇磷酰胆碱、岩藻糖基乳糖、磷酯酰胆碱等高表达,负离子模式下发酵饲料组中苹果酸、补骨脂素、磷酯酰丝氨酸、谷氨酸等高表达。

图5 发酵饲料组和常规饲料组 的层次聚类分析热力图Fig.5 Hierarchical cluster analysis heat maps of fermented diet group (T) and general diet group (CK)
2.3.6 差异代谢物的代谢通路分析
代谢通路分析的结果以气泡图展示 (图6)。通过KEGG 注释分析找到所有差异代谢物参与的通路,本实验根据P值选择显著性最高的前20 条代谢通路,包含氨基酸生物合成、组氨酸代谢、碳酸氢盐回收循环、丙氨酸-天冬氨酸-谷氨酸代谢、蛋白质消化和吸收、精氨酸合成、氨酰tRNA 的生物合成、精氨酸-脯氨酸代谢、氨基酸生物合成等。气泡越大影响因子越大;颜色越深代表P值越小,富集程度越显著。结果显示组氨酸代谢通路、蛋白质消化和吸收代谢通路、精氨酸-脯氨酸代谢通路、氨酰-tRNA 合成这4个差异代谢影响因子最大;精氨酸-脯氨酸代谢通路、蛋白质消化和吸收代谢通路和氨酰-tRNA 合成通路的富集程度最显著。

图6 发酵饲料组对常规饲料组的通路分析气泡图Fig.6 Path analysis bubble chart of fermented diet group and general diet group
3 讨论
本研究对来自不同日粮环境下的两组克氏原螯虾肌肉样本的代谢组进行了比较分析,结果显示两组样本在正离子和负离子模式下,其代谢物均有显著性差异。代谢物主要包括有机酸、氨基酸、脂类和类脂及其衍生物等。显著差异代谢物主要涉及精氨酸-脯氨酸、组氨酸代谢以及蛋白质消化吸收等相关通路。
奎尼酸是一种氨基酸前体物质,在生物体内主要参与脂肪酸代谢过程,有助于维持身体的健康状态,可以帮助将脂肪酸转化为能量[21]。岩藻糖基乳糖是一种多糖类物质,在生物体内可以清除自由基、减轻氧化应激,具有抗氧化、抗炎和免疫调节等作用。亚麻木酚素具有促进血液循环增强机体免疫力的功能[22]。这几种功能物质通常以化合物的形式存在于植物体中,而本研究中,奎尼酸、岩藻糖基乳糖和亚麻木酚素在发酵饲料饲喂环境下在肌肉中的含量均提高了5 倍以上,表明克氏原螯虾利用发酵饲料中的植物成分参与了这几种物质的生成和代谢。
本实验中发酵饲料组增幅种类最多的是磷脂类(包括磷脂酰胆碱、磷脂酰丝氨酸、磷脂酸、鞘磷脂等),此类物质对大脑和血管各种功能起到重要的调节作用[23],能影响生物细胞膜的流动性、通透性,并激活多种酶类的代谢和合成。磷脂酰丝氨酸由丝氨酸合成产生,可改善神经细胞功能,是促神经发育重要营养元素[24]。鞘磷脂对人类肠道和肝脏具有保护和修复的生理功能。此类物质常见于大豆的副产物,而发酵饲料主要成分为豆粕,这类物质的提高可以推断克氏原螯虾通过摄食豆类增加了此类物质的合成。饲料的组成显著影响了克氏原螯虾的肌肉代谢,并使其更具营养[25]。这些肌肉代谢物的增加,说明可以利用投喂发酵饲料实现克氏原螯虾肉中磷脂含量的增加[26]。
代谢物中还存在一些其他具有生理调节功能的物质,例如补骨脂定和苹果酸等。补骨脂定有抗氧化、调节细胞凋亡等作用[27]。可以治疗动脉粥样硬化、心脏病以及心肌损伤[28]。苹果酸作为能量代谢中间体参与生物体内三羧酸循环,可以增加线粒体苹果酸脱氢酶的活性,提高氨基酸的合成效率,机体ATP 的合成效率也可以得到提高[29]。这些物质影响生物的活动能力,因此推断其在肌肉中含量的升高有利于提升克氏原螯虾的运动能力。
显著差异代谢物中还有一部分氨基酸类物质,发酵饲料组相对常规饲料组发生谷氨酸、精-谷氨酸、N-乙酰蛋氨酸组-丝氨酸和甲基甘氨酸等代谢物显著上调。谷氨酸、精氨酸、脯氨酸和谷氨酰胺在动物机体内可相互转化,并发挥重要作用[30]。有研究表明,日粮中添加谷氨酸可以帮助动物减轻肠道氧化损伤[31],增强肌纤维强度[32]。精氨酸有抗胁迫能力,影响生物体的性腺发育速度与非特异性免疫调节的功能[33-34]。表明发酵饲料的丰富氨基酸组成,影响克氏原螯虾新陈代谢和营养物质的吸收转化。
经KEGG 通路分析发现,差异通路主要涉及氨基酸代谢和神经传导等方面,在组氨酸代谢、氨酰-tRNA 生物合成、精氨酸-脯氨酸代谢以及蛋白质消化与吸收这几条通路上差异最显著。本研究中上调的谷氨酸和下调的组氨酸,被富集到氨酰-tRNA 生物合成代谢通路和组氨酸代谢上。氨酰-t R N A 合成,受特定的酶催化氨基酸与相应tRNA 氨酰化,增强生物体遗传信息翻译准确性。谷氨酸可以由组氨酸代谢而来,并且是谷氨酰胺前体,可以在蛋白质合成阶段的后期以谷氨酰尾的形式修饰添加,对肌肉生成有促进作用[35]。表明在发酵饲料饲喂的环境下,克氏原螯虾机体组织相应调整了谷氨酸代谢能力,促进了肌肉的氨酰化反应以及ATP 的激活,提升运动能力。下调表达的组氨酸和精氨酸则被富集到精氨酸-脯氨酸代谢和蛋白质消化与吸收通路中,表明在发酵饲料环境下,谷氨酸向精氨酸和脯氨酸的转化受到抑制,克氏原螯虾为适应不同的日粮环境可能相应地降低了部分蛋白质的翻译。
4 结论
本研究通过代谢组学结合LC-MS 的方法,研究了两种日粮模式下克氏原螯虾肌肉代谢产物的变化。结果表明,投喂发酵饲料一方面促进了克氏原螯虾肌肉中多种生理功能物质的合成,推测克氏原螯虾通过摄食获得运动能力和增强免疫;另一方面促进了肌肉中多种磷脂类物质的合成,提升了克氏原螯虾的食用价值。对差异代谢产物进行了KEGG通路富集分析,发现发酵饲料显著影响了组氨酸代谢、精氨酸-脯氨酸、蛋白质消化吸收和氨酰-tRNA 合成这几条代谢通路。表明日粮能显著影响克氏原螯虾机体氨基酸代谢,推测发酵饲料在促进克氏原螯虾肌肉中特定蛋白质合成、调节代谢和辅助合成氨酰-tRNA 酶类等方面发挥积极作用。

