野生与养殖厚壳贻贝体框特征和线粒体16S rRNA 基因的比较分析
夏飞宇,张秀梅,徐 翩,徐 颖,王一航
浙江海洋大学 水产学院,浙江 舟山 316022
厚壳贻贝 (Mytiluscoruscus) 是广泛分布于黄海和东海沿岸海域的重要经济贝类。浙江省嵊泗县是我国厚壳贻贝的原产地和主要养殖区域[1],20 世纪70 年代前,嵊泗列岛产出的贻贝一直为野生厚壳贻贝[2],它们通常生活在低潮带至水深20 m 处,附着于海浪击打的岩礁上和沟缝中。随着厚壳贻贝人工育苗技术研究的开展和推广[1,3],其养殖业在嵊泗县逐渐发展起来,使用筏或延绳的悬浮养殖技术迅速普及。较其他养殖方式(如木桩养殖和底播养殖),悬浮养殖下的贻贝生长速度更快,软组织饱满程度更高[4]。
潮间带是陆地与海洋的过渡地带,嵊泗县周边潮间带以岩相为主,与养殖海域相比,这是种截然不同的生境。对岩相潮间带的大量研究表明,海浪拍击、岩缝挤压、空气暴露时长以及生长密度会对软体动物的外壳产生深远影响[5-6];这些复杂的因素使得无法直接预测其形态变异。因此,了解厚壳贻贝的生活环境是如何影响其生长的,对贻贝养殖业的高质量发展极为重要。
线粒体DNA (mtDNA)由于具有突变率高、母系遗传几乎不发生重组等特点,是研究物种遗传多样性和分子进化的有效工具。对于双壳贝类形态学的研究,国内外已有较多报道,多与遗传多样性结合(通过微卫星标记和DNA 条形码)[7-9]。如Yuan 等[10]利用形态学、微卫星和mtDNA 标记对日本野生和中国养殖群体栉孔扇贝 (Chlamys farreri) 进行研究,发现它们之间无显著的形态差异,但日本野生扇贝可分为南北两个种群且和中国养殖群体存在遗传差异;He 等[11]通过全基因组测序和壳形分析证实太平洋牡蛎 (Crassostreagigas) 的外壳形状会在环境应激反应中发生变化;徐义平等[12]结合形态学、SRAP 标记两种手段,探究了中国沿海4 个省份的11 个缢蛏 (Sinonovaculaconstricta) 群体,指出浙江乐清湾野生群体间具有较高的形态和遗传相似性。目前关于野生和养殖厚壳贻贝形态差异的研究尚未见报道,尚不清楚这种差异是否由遗传造成。基于此,本研究采集了嵊泗县嵊山、枸杞岛岩相潮间带 (简称野生) 和筏架养殖区 (简称养殖) 不同生境下的厚壳贻贝样本,测量分析其壳长、壳质量,构建体框特征并进行形态特征分析,同时对比其线粒体16SrRNA基因序列,以期为厚壳贻贝的种质资源保护及其养殖产业发展提供参考。
1 材料与方法
1.1 调查区域及样品采集
厚壳贻贝于2021 年8 月至2022 年4 月采自浙江省嵊泗县嵊山镇周边海域 (122.73°E—122.79°E,30.69°N—30.75°N)。其中养殖贻贝取自枸杞岛干斜村金盟厚壳贻贝筏架养殖区;野生样品为枸杞岛岩相潮间带自然生长的贻贝。根据壳长确定厚壳贻贝年龄[13]:1 龄壳长介于24.0~56.0 mm,2 龄壳长介于56.0~75.0 mm,3 龄壳长介于75.0~85.0 mm,4 龄贝壳长介于85.0~100.0 mm,5 龄壳长介于100.0~110.0 mm。为避免异速生长带来的影响,体框特征分析选取的样品为2+ 龄。
1.2 样品处理
采集贝体完整无损的厚壳贻贝,刮干净壳表面附着的生物及足丝,带回实验室解剖。烘干后用电子天平称取壳干质量 (精度0.01 g)。从中随机挑选157 只厚壳贻贝 (养殖78 只,野生79 只),参考白晓倩等[14]的方法并略做改进,构建体框特征模型。体框特征点如图1 所示,包括壳宽(W)、壳高 (H)、壳长顶 (A)、壳背顶 (B)、铰合部上端(C)、壳顶 (D)、宽顶 (O)、足丝孔 (E) 及壳顶至腹缘的垂足(F)。通过电子数显游标卡尺 (精度0.01 mm) 测量它们的长度和距离,以此获得W (L1)、H (L2)、AB (L3)、BC (L4)、CD (L5)、DE (L6)、AE (L7)、OA (L8)、OB (L9)、OC (L10)、OD (L11)、OE (L12)、OF (L13) 13 个贝体框特征指标。

图1 体框特征测量点Fig.1 Measurement points of shell frame characteristics
1.3 线粒体DNA 提取、PCR 扩增及测序
随机额外选择野生和养殖厚壳贻贝各20 只,解剖并提取其闭壳肌mtDNA。步骤如下:取约100 mg 闭壳肌组织,采用标准的酚-氯仿法提取基因组DNA,将乙醇沉淀后的基因组DNA 加入100 μL 胰蛋白酶/EDTA (TE) 缓冲液溶解。扩增16SrRNA基因片段的引物序列如下:16S ar:5'-CGCCTGTTTATCAAAAACAT-3';16S br:5'-CCGGTCTGAACTCAGATCACGT-3'。扩增产物纯化及测序(Sanger) 由上海生工生物公司完成。
1.4 数据处理与分析
1.4.1 形态差异分析
使用SPSS 26.0 软件分别计算野生和养殖厚壳贻贝的体框特征指标平均值、标准差以及变异系数,不同生长区域的贻贝通过独立样本t检验判断显著性 (P<0.05 表示差异显著)。结果由GraphPad Prism 9.0 软件绘图。此外,使用R-4.1.3 软件对13 个体框特征参数进行Pearson 相关性分析;通过主成分分析 (Principal component analysis,PCA) 对数据进行降维,保留特征根大于1 的主成分 (Principal component,PC) 用于后续分析;运用逐步判别法,构建野生和养殖厚壳贻贝的判别函数并计算判别准确率,计算公式参照李思发等[15]。
1.4.2 遗传多样性分析
将测序结果用MEGA 7.0 剪切、比对并辅以人工校对分析核苷酸变异,以Kimura 双参数法 (Kimura-2-parameter)为替代模型并基于邻接距离法 (Neighbor-Joining) 构建野生和养殖厚壳贻贝的系统发育树[16](重抽样3 000 次)。使用DNASP 5.10 计算单倍型数量 (N)、单倍型多样性 (Hd) 和核苷酸多样性 (π) 来估计野生和养殖种群的遗传多样性。由POPART 绘制median joining network (MJN),构建养殖和野生厚壳贻贝的单倍型网络图。
2 结果
2.1 野生与养殖厚壳贻贝壳长与壳质量的关系
对已收集到的所有厚壳贻贝壳长 (L)、壳干质量 (G) 数据 (养殖316 只、野生393 只) 进行回归分析,得到两条回归关系式:G野= 0.000 3L2.5937(R2=0.930),G养=0.000 2L2.5537(R2=0.877)。从回归式和回归曲线 (图2) 可以看出,厚壳贻贝的壳长-壳质量关系式基本符合幂函数增长规律。野生贻贝壳质量与壳长的幂指数b(2.593 7) 要略大于养殖贻贝(b=2.553 7),意味着在相同体长下野生群体的壳质量更大,且这种趋势随着贻贝个体的增长更为明显。
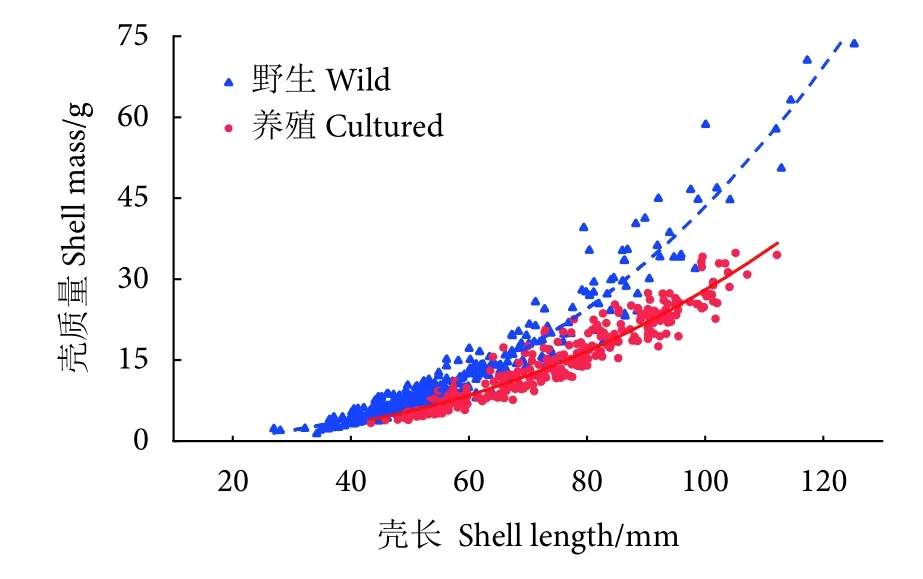
图2 野生与养殖厚壳贻贝壳长和壳质量的关系Fig.2 Relationship between shell length and shell mass of wild and cultured M.coruscus
2.2 野生与养殖厚壳贻贝体框特征参数比较
不同生长区域厚壳贻贝的贝壳体框特征参数见表1。从图3 可以看出,除L4、L11和L13外,野生群体和养殖群体的各项体框特征差异显著 (P<0.01)。与自然生长在潮间带的野生贻贝相比,养殖群体各项体框特征长度均相对较短,仅L7大于野生群体。统计结果显示,野生群体L4的变异系数最大 (21.22%),远高于养殖群体及其他特征指标,说明野生群体贝壳在L4这一指标上的选择潜力很大。13 项体框指标中,野生群体有9 项指标 (L1、L3、L4、L5、L6、L7、L9、L11、L13) 的变异系数大于养殖群体,说明野生群体的贝壳在生长过程中的可塑性要略高于养殖群体。上述结果表明,不同生长区域的厚壳贻贝外观上的区分度较大。

表1 野生与养殖厚壳贻贝体框特征参数Table 1 Shell frame characteristics parameters of wild and cultured M.coruscus
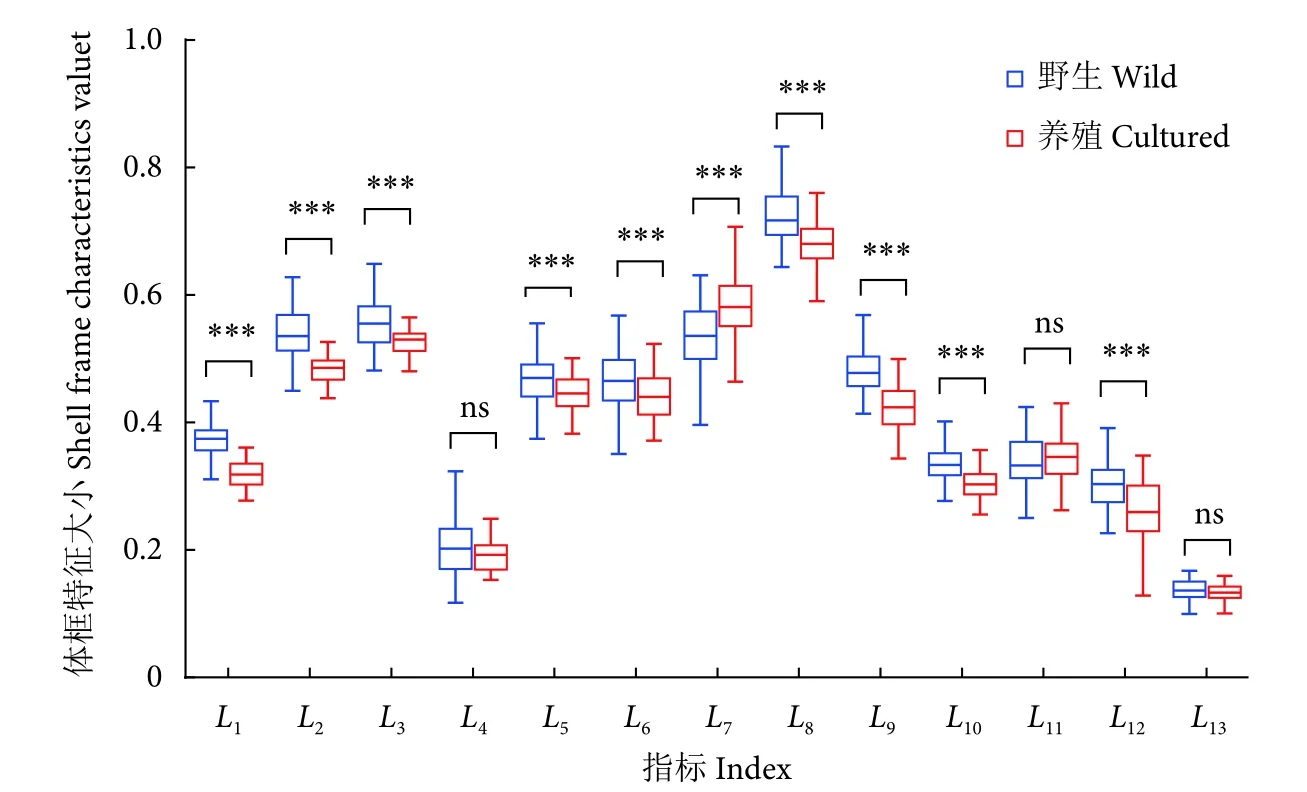
图3 野生与养殖厚壳贻贝体框特征差异Fig.3 Differences in shell frame characteristics between wild and cultured M.coruscus
2.3 体框特征之间的相关性分析和主成分分析
由图4 可知,野生与养殖贻贝各体框特征间存在相关性 (P<0.05),但所有体框特征间的相关系数绝对值均未大于0.7。L1和L2作为衡量厚壳贻贝外部形态的重要指标,与其他变量的正相关最多。而L7与其他变量均为负相关,且与L6的负相关系数最大 (-0.65)。各体框特征中,L11与其他特征的相关程度最低,仅与L8、L9显著相关。L9与L2、L8存在最高的正相关性 (相关系数均为0.63)。

图4 体框特征间的相关性系数Fig.4 Correlation coefficient between shell frame characteristics
通过对体框特征进行KMO 适合度和Bartlett 球形检验,发现各特征值的相关系数矩阵和零矩阵存在显著性差异 (Bartlett 球形检验P<0.01),且主成分分析的适合度为适中 (KMO=0.742>0.7),因此对13 个体框特征进一步做主成分分析。提取的4 个特征根大于1 的主成分中,PC1 解释的方差贡献率为32.44% (表2),远高于另外3 个主成分 (分别为14.02%、11.33%和9.70%)。PC1 由L1、L2、L3、L6、L7、L8、L9、L10、L12决定 (载荷绝对值大于0.5),第二个主成分主要由L5(载荷绝对值等于0.633) 决定 (表2)。L11主要与PC3 相关,而PC4 主要受L4影响。由PC1 和PC2 的得分图 (图5) 可见,养殖群体的数据点较为集中,说明其形态一致性较高;而野生群体的数据点分散,说明其形态更为多样。
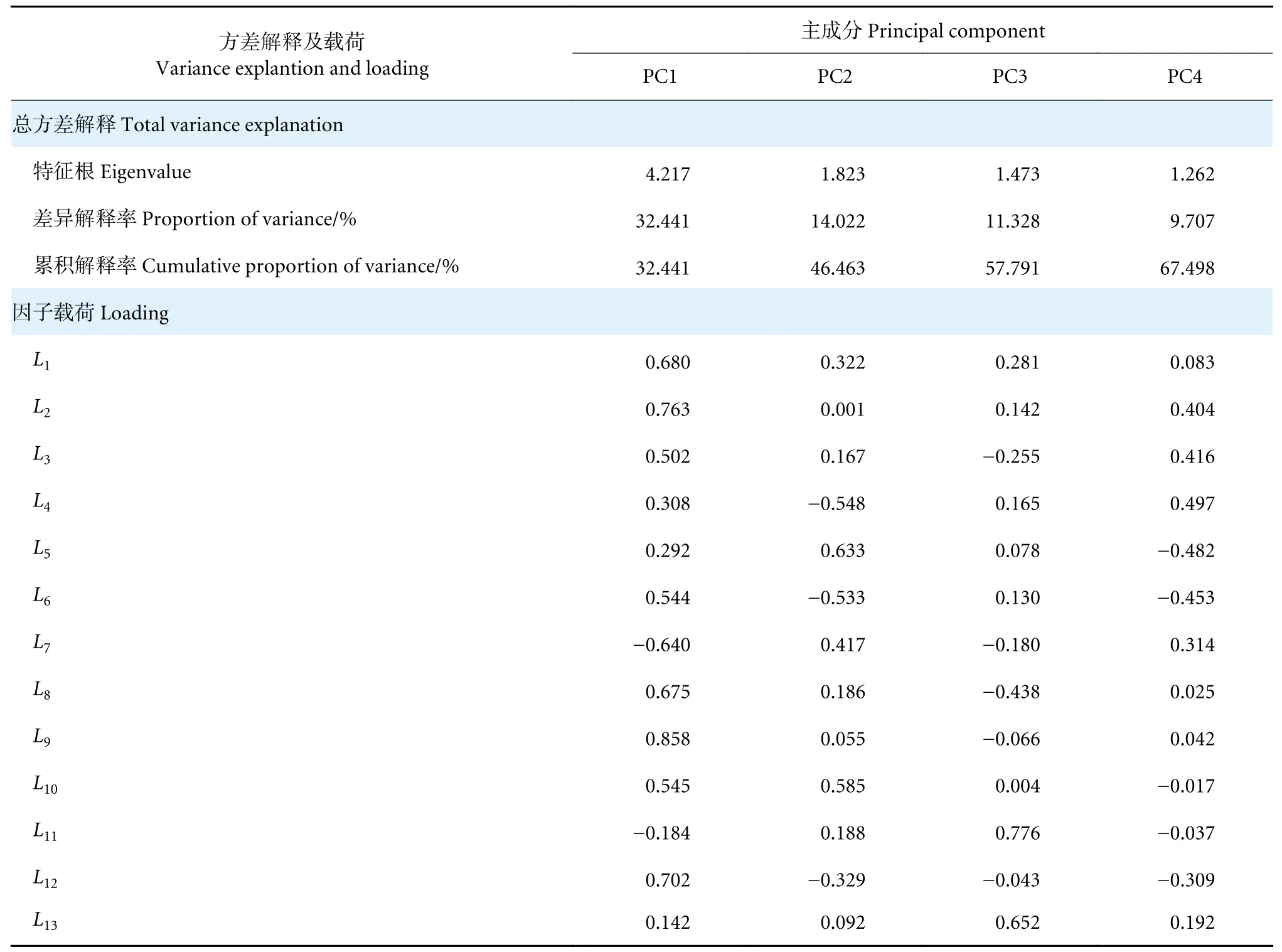
表2 野生与养殖厚壳贻贝体框特征之间的主成分分析Table 2 Principal component analysis of shell frame characteristics between wild and cultured M.coruscus
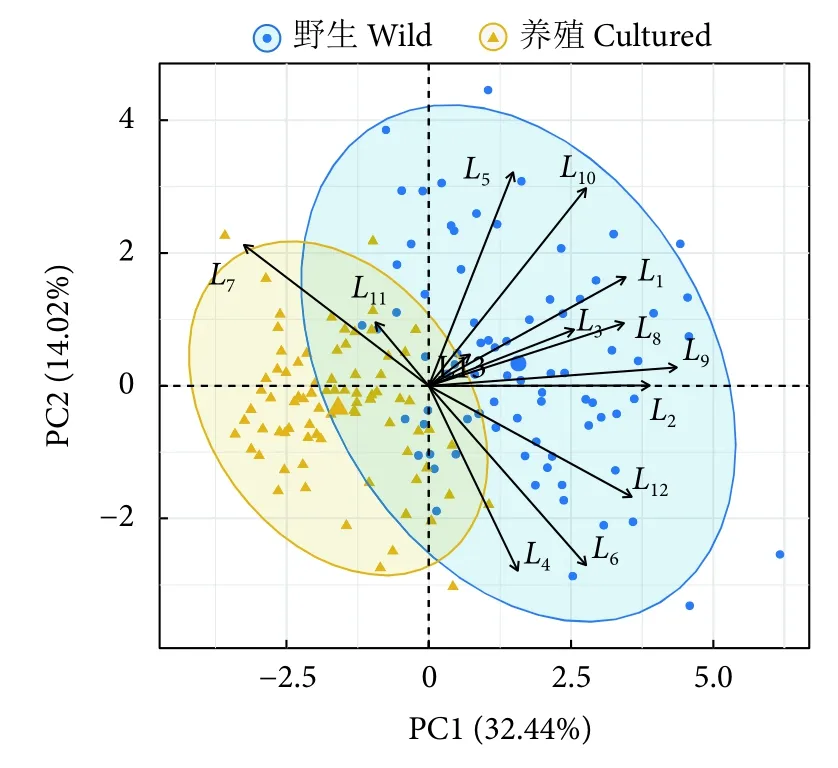
图5 野生与养殖厚壳贻贝主成分分析得分图Fig.5 Principal component scores of wild and cultured M.coruscus
2.4 体框特征之间的判别分析
采用逐步判别分析法,从13 个体框特征中选择对判别结果有显著影响的。F检验结果显示L1、L2、L10、L12这4 个体框特征对判别结果有显著性影响 (P<0.01)。以此得到一个典型判别函数LD1=30.60L1+15.12L2+14.34L10+6.99L12-285.02,典型判别函数相关性为0.848,Wilks'lambda检验显著性<0.01,说明该判别函数具有显著性。
使用Fisher's 判别法,得到各生长区域厚壳贻贝的分类函数如下:
养殖群体:y养=573.15L1+448.99L2+437.26L10+132.74L12-285.02
厚壳群体:y野=670.28L1+497.00L2+482.79L10+154.93L12-364.06
依靠判别函数,对养殖贻贝的判别准确率达到了98.7%,而对潮间带野生贻贝的判别准确率也有91.1%,综合判别准确率为94.9%。可见判别公式能有效区分养殖和野生群体。
2.5 野生与养殖群体16S rRNA 基因差异
对扩增和测序成功的24 只厚壳贻贝序列进行比对后,获得507 bp 的16SrRNA基因片段。样品的平均核苷酸组成为A=30.8%,C =15.9%,G=23.3%,T=30.0%,G+C 平均含量39.2%。共检测出12 个单倍型,其中养殖群体独有单倍型4 个,野生群体独有单倍型6 个,两群体共享单倍型2 个。构建的单倍型网络图 (图6) 显示,厚壳贻贝的单倍型明显分为了两簇 (分别以Hap-1 和Hap-2 为中心),各簇之内的单倍型碱基变异步数均较低,但两簇之间的碱基变异步数达到了101。本次样品未检测到Hap-7 和Hap-8间的连接节点单倍型。由系统发育树 (图7) 可知,每个分支均包含来自野生和养殖的厚壳贻贝,表明野生和养殖厚壳贻贝基本无分子水平上的遗传分化。
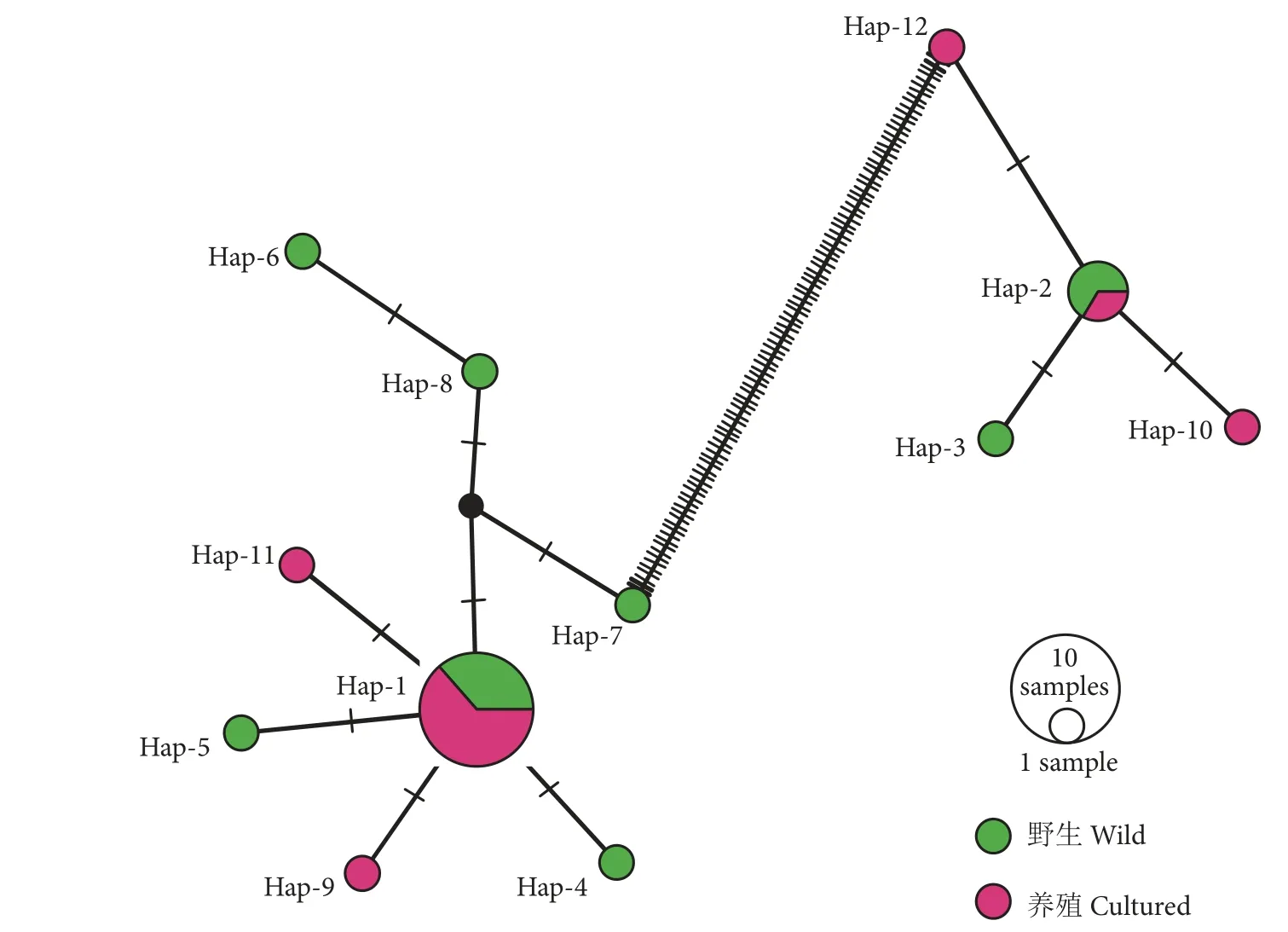
图6 野生与养殖厚壳贻贝16S rRNA基因的单倍型网络图Fig.6 Haploid network diagram of 16S rRNA gene in wild and cultured M.coruscus

图7 邻接距离法构建的厚壳贻贝16S rRNA 系统发育树注:YS 代表野生厚壳贻贝,YZ 代表养殖厚壳贻贝。Fig.7 Neighbour-joining tree based on 16S rRNA gene of M.coruscusNote: YS represents wild M.coruscus,and YZ represents cultured M.coruscus.
由DNASP 分析可见,养殖贻贝的Hd为0.682,明显低于野生贻贝 (0.894)。在两个群体中一共检测到112 个多态位点,其中简约信息位点在野生和养殖群体中的数量均达到105。两个群体的π较为接近 (养殖群体为0.087,野生群体0.089),展现出较高的遗传多样性。
3 讨论
3.1 野生和养殖厚壳贻贝的形态结构比较
壳形既是双壳贝类选育的重要指标,也是实际销售过程中消费者推断其经济价值的重要判断依据。本研究中,L1、L2代表的变量分别是壳宽、壳高,其大小直接影响壳的整体外形。相同体长下野生厚壳贻贝的壳更宽、更厚(P<0.01),意味着野生群体形态可能更圆钝,而养殖群体相对更扁平。这与Grefsrud 和Oivind[17]对巨海扇蛤 (Pectenmaximus) 的研究一致,他们发现与同龄野生巨海扇蛤相比,养殖海扇蛤的壳更脆、更小、更轻,在应对潮汐和海浪时,较大的壳质量及尺寸可以起到更有效的保护作用。L10、L12是通过逐步判别筛选出的另两个重要变量,分别表示壳背顶距离足丝孔和铰合部上端的距离。结合L1、L7、L8与L11的值,可以看出野生厚壳贻贝壳宽顶O 的位置更靠近前端,它将壳面分为上 (四边形AEOB)、下 (四边形EOCD) 两部分,养殖群体有宽大扁平的上部外壳,而野生群体则有较为膨胀的下部外壳。通常来说,扁平的壳形能减小水流阻力,而厚重圆润的壳形使野生厚壳贻贝更能抵抗海浪的拍击。顾志峰等[18]在对马氏珠母贝 (Pinctada martensi) 的研究中也发现大亚湾野生种群的贝体外形较凸,而印度养殖种群的贝体外形显得扁平。L4的大小代表了贻贝背角弯曲的程度,L4越大,贻贝的背角越不明显,背缘呈弧形三角形。L4与其他指标的相关性相对较低且有着极高的变异系数,说明在后天的生长发育过程中,背角可能更易受外界环境干扰。已有研究也报道了厚壳贻贝幼年个体背角很明显,但随着生长会产生不同的变化[19]。
3.2 野生和养殖厚壳贻贝的遗传多样分析
测序结果表明厚壳贻贝出现明显的碱基A/T 倾向性(A/T 占比达到60%),这与软体动物线粒体基因碱基组成特点相一致[20-21]。遗传多样性是生物多样性的重要组成部分,其高低决定了物种的生存进化能力。本研究中野生与养殖厚壳贻贝呈现出高核苷酸多样性和单倍型多样性,其16SrRNA核苷酸多样性均高于0.08,大于四角蛤蜊 (Mactraveneriformis)、西施蛤 (Coelomactraantiquate)[22]、菲律宾蛤仔 (Ruditapesphilippinarum)[23],说明嵊泗厚壳贻贝种质资源保护较好,且野生群体的遗传多样性要高于养殖群体。系统发育结果显示所有厚壳贻贝形成了两个分支,但野生和养殖厚壳贻贝在每个分支均有出现,可能是因为它们之间存在基因流,说明单从遗传差异无法完全解释野生和养殖厚壳贻贝的形态差异。管成林等[8]、Shen 等[24]在对线粒体COI基因的研究中同样发现野生和养殖厚壳贻贝无明显的遗传分化。嵊泗养殖海域厚壳贻贝苗种部分引自福建,叶莹莹等[25]对福州、舟山、温州、宁德4 个地理群体厚壳贻贝的16SrRNA序列分析发现,福州群体与其他群体间遗传距离较大,这可能是造成本研究中单倍型两簇间出现较大碱基差异的原因。
3.3 野生与养殖厚壳贻贝形态差异的解析
双壳贝类的壳表现出一种极强的表型可塑性[26],这种可塑性可能是种内遗传变异所致[27-28],也可以归因于某些环境因素,这是对栖息环境长期适应的结果[29-31]。本研究中,即使是距潮间带仅几百米的养殖厚壳贻贝,壳的形态也与野生群体有显著性差异,这可能是由波浪暴露影响所致。固着生物在生命周期会产生位移风险,这种风险随着流速的增加而上升,随着贻贝韧性或附着强度的增加而降低[32]。很多学者就海洋波浪作用对贻贝壳形态的影响做了研究,发现波浪暴露区域的贻贝有着和非波浪暴露区贻贝不同的壳分泌模式 (形状和厚度)。例如Steffani 和Branch[33]发现紫贻贝 (M.galloprovincialis) 在受到波浪中度暴露时的生长速度及壳厚度,大于无暴露和高强度波浪暴露时。Akester和Martel[34]发现暴露在潮间带中的贻贝 (M.trossulus) 的壳高/宽比较低,还有更坚固的铰合齿和更厚的韧带。因此,波浪暴露可能是影响贻贝壳形态的重要环境因素。
造成野生与养殖贻贝形态差异的另一个原因可能是生长密度导致的营养条件差异。虽然已有研究表明过高的生长密度不会使贻贝受到物理上的直接挤压、磨损[35],但大面积的养殖活动直接影响了海区的水动力结构[36]。温英[37]通过对流场的模拟证实了枸杞岛贻贝养殖区的水层流速会受到贻贝串阻力的衰减作用。由于贻贝是滤食性生物,水流交换强度会直接影响其栖息地的饵料质量和数量。相较于流速平缓的养殖区,潮间带的营养物质扩散更快,沿岸的波浪可以快速弥补贻贝附着地的颗粒有机物消耗[38]。这种营养条件差异会影响贝类的外壳形态,如Watanabe 和Katayama[39]发现栖息于营养条件较好环境中的菲律宾蛤仔个体比生长于贫营养环境中的个体壳宽更小,壳形椭圆化程度更高。由于双壳贝类的壳形与其出肉率关系密切[40-41],在波浪作用频繁的潮间带,食物供应的增加可能使厚壳贻贝生长更快,进而可以分配更多的能量用于软组织发育。但与此同时,海水动力也可能增加厚壳贻贝对足丝附着强度和贝壳厚度的需求,且贻贝的摄食率在食物浓度达到一定阈值时会保持相对稳定,新陈代谢加快,消耗的能量也越来越多[42]。因此推测在一定阈值内,波浪暴露和营养条件会对贻贝生长产生积极影响,但过度的波浪作用和过快的水流速度则可能产生负面影响。
4 结论
综上所述,枸杞岛海域厚壳贻贝种质资源保护较好,但不同的生长环境使浮筏养殖厚壳贻贝较同龄野生群体的贝壳更为轻薄,16SrRNA基因测序结果证明了这种形态差异不是由遗传造成。本研究所选取的13 个体框特征指标中有11 个存在显著性差异,关键判别变量为L1(壳宽)、L2(壳高)、L10(壳顶至铰合部上端距离) 和L12(壳顶至足丝孔距离),这4 个体框特征可作为评价厚壳贻贝整体形状、生长潜力和营养状况的重要指标。生长密度和水动力差异可能是造成厚壳贻贝野生和养殖群体形态差异的主要原因,今后可从这两个角度出发,合理规划枸杞岛贻贝筏架区的布局。

