北苍术化学成分及其血管新生抑制活性
梁 君,王桁杰,胡国强
(1.郑州工业应用技术学院药学与化学工程学院,河南 郑州 451100; 2.河南大学药学院,河南 郑州 450046)
北苍术,又名华苍术、山苍术,主产于我国黑龙江、辽宁、吉林、内蒙古、河北、山东等地[1],为菊科植物北苍术Atractylodeschinensis(DC.)Koidz.的干燥根茎[2],为苍术的正品基原植物。北苍术辛、苦,性温,具有燥湿健脾、祛风散寒、明目的功效。中医临床主要用于湿阻中焦、脘腹胀满、泄泻、水肿、脚气痿躄、风湿痹痛、风寒感冒、夜盲、眼目昏涩等症的治疗[2]。现代药理学发现,北苍术具有抗心率失常、保肝、抗炎、抗菌、利尿等活性[3-6]。进一步检索发现,北苍术与苍术属其他植物类似,主要含有倍半萜类、聚炔类、三萜类、黄酮类成分[7-10],其中以苍术酮和白术内酯类为代表的倍半萜类成分为该属的代表性成分[11-12]。课题组以北苍术为研究对象,从中分离鉴定了11 个萜类化合物,包括9 个倍半萜类、2个三萜类,其中化合物1 是裂环愈创木烷型新化合物,化合物2、4~6、10 ~11 为首次从北苍术中分离。体外细胞学实验发现,化合物1 ~2、5 对人脐静脉内皮细胞具有不同程度的抑制活性,是潜在的血管新生抑制剂。
1 材料
1.1 仪器 Avance-400 型核磁共振光谱仪(德国Bruker 公司); Agilent 1100 系列LC/MSD Trap-SL型质谱仪(美国Agilent 公司); Sephadex LH-20 凝胶(美国GE 公司); 酶标仪(日本Corona 公司);移液枪(德国Eppendorf 公司); CO2培养箱(美国Thermo 公司); 倒置显微镜(上海永科光学仪器有限公司); 超净工作台(江苏苏净集团有限公司)。
1.2 试剂与药物 反相ODS-A 填料、大孔吸附树脂D101 填料(南京元宝峰医药科技有限公司);硅胶薄层板GF254(德国默克公司); 硅胶(青岛海洋化工有限公司); 氘代氯仿(美国CIL 公司);其余试剂均为色谱纯或分析纯。地塞米松注射液(云南白药集团股份有限公司); MTT、PBS 缓冲液(美国Sigma 公司); ECM1001 培养基(南京建成生物工程研究所)。人脐静脉内皮细胞HUVEC(中国科学院典型培养物保藏委员会细胞库)。
北苍术于2020 年6 月购自安徽亳州中药材市场,经郑州工业应用技术学院药学与化学工程学院谢新年副教授鉴定为菊科苍术属植物北苍术Atractylodeschinensis(DC.) Koidz.的干燥根茎。凭证标本(编号20200601) 保存于郑州工业应用技术学院药学与化学工程学院。
2 提取与分离
干燥的北苍术根茎 (25 kg) 经粉碎后,用95%乙醇在室温下浸泡提取3 次,每次48 h,提取液经减压浓缩后得到10 kg 浸膏。浸膏加温水混悬,以乙酸乙酯萃取得到乙酸乙酯提取物600 g。
乙酸乙酯提取物(550 g) 经大孔树脂D101 分离,以乙醇-水(10 ∶90、30 ∶70、50 ∶50、70 ∶30、80 ∶20、90 ∶10、0 ∶100) 梯度洗脱,TLC 检识合并,得到Fr.A~Fr.H。Fr.D (80 g) 经硅胶柱分离,以石油醚-乙酸乙酯(100 ∶0 ~50 ∶50) 梯度洗脱,得到Fr.D1 ~Fr.D5。Fr.D3 (28 g) 经Sephadex LH-20 凝胶柱分离,以石油醚-乙酸乙酯-甲醇(5 ∶5 ∶1) 洗脱,得到Fr.D3-1 ~Fr.D3-4。Fr.D3-2 (9.8 g) 经过反相硅胶柱分离,以乙醇-水(40 ∶60 ~100 ∶0) 梯度洗脱,得到Fr.D3-2-1 ~Fr.D3-2-6。Fr.D3-2-2 (2.2 g) 经硅胶柱分离,以石油醚-丙酮(100 ∶0 ~50 ∶50) 梯度洗脱,得到Fr.D3-2-2-1~Fr.D3-2-2-5 和化合物3 (100 mg),Fr.D3-2-2-3 (309 mg) 经半制备HPLC 纯化,以甲醇-水(68 ∶32) 洗脱,得到化合物1 (tR=24 min,6.9 mg)、2 (tR=33 min,12.7 mg)、3 (tR=35 min,9.6 mg); Fr.D3-2-2-4 (99 mg) 经半制备HPLC 纯化,以甲醇-水(70 ∶30) 洗脱,得到化合物4 (tR=33 min,12.2 mg)、5 (tR=35 min,6.3 mg)、6 (tR=42 min,9.5 mg)。Fr.D4 (14.2 g) 经反相硅胶柱分离,以乙醇-水(40 ∶60 ~100∶0) 梯度洗脱,得到Fr.D4-1 ~Fr.D4-5。Fr.D4-2(4.1 g) 经硅胶柱分离,以石油醚-乙酸乙酯(100 ∶0 ~0 ∶100) 梯度洗脱,得到Fr.D4-2-1 ~Fr.D4-2-8 和化合物7 (250 mg)、8 (180 mg)。Fr.D4-2-5 (158 mg) 经半制备HPLC 纯化,以甲醇-水(77 ∶27) 洗脱,得到化合物9 (tR=59 min,7.4 mg); Fr.D4-5 (1.1 g) 经硅胶柱分离,以石油醚-乙酸乙酯(100 ∶0 ~0 ∶100) 梯度洗脱,得到化合物10 (300 mg)、11 (100 mg)。
3 结构鉴定
化合物1: 黄色油状液体,HR-ESI-MSm/z:233.153 8 [M+H]+,分子式C15H22O2,不饱和度6。13C-NMR、DEPT135 显示化合物中存在15 个碳原子,结合HSQC、1H-NMR 提示化合物中存在2 个羰基信号[δ: 208.5 (C-4),187.0 (C-5)]; 3组双键信号,包括1 组四取代双键[δ: 150.6 (C-1),143.6 (C-10)] 和2 组构成1 个ABX 耦合系统的双键信号 [δ: 6.88 (1H,d,J=1.74 Hz,H-6),6.70 (1H,dd,J=11.92,1.99 Hz,H-8),6.83 (1H,d,J=11.93 Hz,H-9);δ:155.0 ( C-7),138.3 ( C-9),136.4 ( C-6),132.9 (C-8)],同时还观察到2 组亚甲基信号[δ: 2.89 (2H,t,J=7.84 Hz,H-2),2.65(2H,t,J=7.82 Hz,H-3);δ: 41.6 (C-3),26.4 (C-2)] 和2 个甲基信号[δ: 2.34 (3H,s,H-14),2.18 (3H,s,H-15);δ: 29.9 (C-15),24.8 (C-14)]。除此之外,高场区还观察到1 组异丙基信号[δ: 2.71 (1H,sept,J=6.88 Hz,H-11),1.20 (6H,d,J=6.86 Hz,H-12,13);δ: 37.2 (C-11),22.8 (C-12 ~13)]。通过与文献[13] 中的数据进一步比对后发现,化合物1、2 具有相同的骨架结构,均为裂环愈创木烷型倍半萜,不同之处在于缺失了4 个sp3杂化碳原子,由此变成了4 个双键碳原子[δ: 171.9 (C-10),138.7 (C-1)],因此推测化合物1 是经化合物2 上C-1、C-8 ~10 位变为双键后所形成的,以上推测可在HMBC 谱中进一步得到证实。在HMBC 图谱中可观察到2.89 (H-2) 与150.6 (C-1)、143.6 (C-10)、138.3 (C-9) 之间,6.88(H-6) 与132.9 (C-8) 之间,6.70 (H-8) 与37.2 (C-11) 之间,6.83 (H-9) 与155.0 (C-7)、150.6 (C-1) 之间,2.34 (H-14) 与150.6(C-1)、143.6 (C-10)、138.3 (C-9) 之间存在远程相关关系,见图1,由此证实了以上对于化合物1 结构的推测。综上所述,化合物1 结构为7-isopropyl-10-methyl-1- ( 3-oxobutyl ) cyclohepta-6,8,10-trien-5-one,是裂环愈创木烷型倍半萜的新化合物,命名为seco-愈创木酮。1H-NMR、13C-NMR数据见表1。

表1 化合物1 的1H-NMR、13C-NMR 数据Tab.1 1H-NMR and 13C-NMR data on compound 1
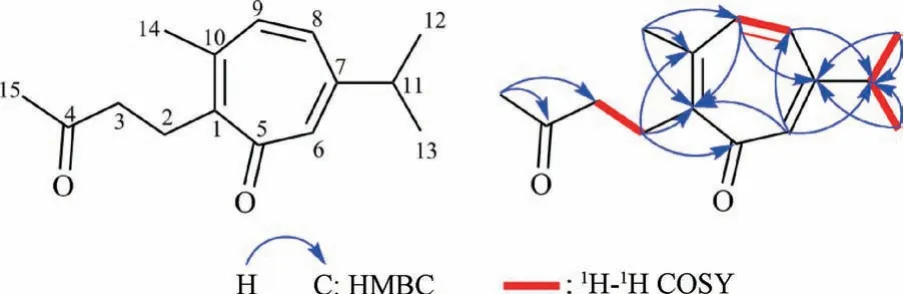
图1 化合物1 的关键HMBC 与1H-1H COSY 相关性Fig.1 Key HMBC and 1H-1H COSY correlations of compound 1
化合物2: 无色油状液体,分子式C15H24O2,ESI-MSm/z: 237 [M +H]+。1H-NMR (400 MHz,CDCl3)δ: 5.88 (1H,s,H-6),2.81 (1H,m,H-1),2.49 (1H,m,H-3a),2.39 (1H,m,H-3b),2.35 (2H,m,H-2a,8a),2.17 (1H,m,H-11),2.19 (1H,m,H-8b),2.10 (3H,s,H-15),1.97 (2H,m,H-9a,10),1.59 (1H,m,H-2b),1.08 (1H,m,H-9b),1.08 (3H,d,J=6.49 Hz,H-13),1.06 (3H,d,J=6.57 Hz,H-12),0.80 (3H,d,J=6.68 Hz,H-14);13C-NMR (100 MHz,CDCl3)δ: 52.7 (C-1),22.1 (C-2),42.1 (C-3),208.8 (C-4),203.5(C-5),127.7 (C-6),170.0 (C-7),29.7 (C-8),36.5 (C-9),34.0 (C-10),38.0 (C-11),20.8 (C-12),20.8 (C-13),16.3 (C-14),29.7(C-15)。以上数据与文献[14] 报道基本一致,故鉴定为gibberodione。
化合物3: 无色油状液体,分子式C15H26O,ESI-MSm/z: 223 [M +H]+。1H-NMR (400 MHz,CDCl3)δ: 2.82 (1H,m,H-4a),2.50 (1H,ddt,J= 14.4,4.30,2.31 Hz,H-2a),1.90(1H,m,H-9b),1.80 (1H,m,H-6a),1.69(3H,s,H-12),1.66 (3H,s,H-13),1.63(1H,m,H-4b),1.55 (2H,tt,J=7.59,3.13 Hz,H-7),1.42 (1H,m,H-1a),1.39 (1H,m,H-8a),1.30 (1H,m,H-6b),1.14 (1H,m,H-10),1.13 (3H,s,H-14),1.11 (1H,m,H-8b),1.06 (1H,m,H-1b),0.96 (3H,s,H-15);13C-NMR (100 MHz,CDCl3)δ: 131.5(C-7),121.1 (C-11),72.5 (C-4),55.9 (C-5),45.4 (C-9),43.7 (C-3),41.2 (C-1),35.0 (C-10),25.6 (C-6),24.8 (C-8),22.2(C-14),20.4 (C-2),20.2 (C-12),20.2 (C-13),18.2 (C-5)。以上数据与文献[15] 报道基本一致,故鉴定为junipercamphor。
化合物4: 无色油状物,分子式C16H22O3,ESI-MSm/z: 263 [M +H]+。1H-NMR (400 MHz,CDCl3)δ: 6.23 (1H,s,H-13a),5.91 (1H,m,H-3),5.58 (1H,s,H-13b),3.75 (3H,s,12-OCH3),2.62 (1H,m,H-7a),2.44 (1H,d,J=12.57 Hz,H-5),2.32 (1H,d,J=16.04 Hz,H-1b),2.20 (1H,d,J=16.16 Hz,H-1a),2.00 (1H,m,H-6a),1.91 (3H,t,J=1.40 Hz,H-15),1.56 (4H,m,H-8~9),1.32 (1H,m,H-6b),0.94 (3H,s,H-14);13C-NMR (100 MHz,CDCl3)δ: 54.4 (C-1),199.3 (C-2),162.7 (C-3),126.9 (C-4),148.1 (C-5),37.5(C-6),40.6 (C-7),26.7 (C-8),29.0 (C-9),40.5 (C-10),144.8 (C-11),167.8 (C-12),123.3 (C-13),22.4 (C-14),7.2 (C-15),51.8(12-OCH3)。以上数据与文献[16] 报道基本一致,故 鉴 定 为 2-one-3,4-dehydro-4,15-dihydrocostic ester。
化合物5: 淡黄色油状物,分子式C15H24O2,ESI-MSm/z: 237 [M +H]+。1H-NMR (400 MHz,CDCl3)δ: 5.14 (1H,s,H-13a),5.12 (1H,s,H-13b),4.70 (1H,d,J=1.86 Hz,H-15a),4.41 (1H,d,J=1.91 Hz,H-15b),4.30 (2H,s,H-12),2.29 (1H,dd,J=4.11,1.77 Hz,H-5),2.28 (1H,m,H-3a),2.03 (1H,m,H-3b),1.67 (6H,m,H-2a,6,8,9a),1.40(4H,m,H-1,2b,9b),0.74 (3H,s,H-14);13C-NMR (100 MHz,CDCl3)δ: 41.5 (C-1),23.7 (C-2),36.9 (C-3),151.0 (C-4),44.4(C-5),35.9 (C-6),74.6 (C-7),32.5 (C-8),36.0 (C-9),35.9 (C-10),154.8 (C-11),65.2(C-12),111.1 (C-13),15.4 (C-14),105.2(C-15)。以上数据与文献[17] 报道基本一致,故鉴定为7α-hydroxycostol。
化合物6: 淡黄色油状物,分子式C15H24O2,ESI-MSm/z: 237 [M +H]+。1H-NMR (400 MHz,CDCl3)δ: 6.33 (1H,s,H-12a),5.83 (1H,dd,J=17.87,10.45 Hz,H-1),5.68 (1H,s,H-12b),4.93 (1H,dd,J=6.04,1.24 Hz,H-2a),4.90 (1H,s,H-3),4.83 (1H,m,H-2b),4.59 (1H,s,H-3b),2.52 (1H,m,H-7),2.09 (1H,dd,J=12.64,3.22 Hz,H-5),1.71 (3H,s,H-14),1.67 (2H,m,H-8),1.55 (2H,m,H-6),1.47 (2H,H-9),1.02(3H,s,H-15);13C-NMR (100 MHz,CDCl3)δ:172.7 ( C-13),150.1 ( C-1),147.5 ( C-4),145.1 (C-11),124.9 (C-12),112.4 (C-3),110.2 (C-2),52.7 (C-5),39.9 (C-7),39.8(C-9),39.5 (C-10),33.5 (C-6),27.4 (C-8),25.0 (C-14),16.8 (C-15)。以上数据与文献[18] 报道基本一致,故鉴定为elema-1,3,11(13) -trien-12-oic acid。
化合物7: 无色油状物,分子式C15H18O2,ESI-MSm/z: 231 [M +H]+。1H-NMR (400 MHz,CDCl3)δ: 5.61 (1H,s,H-9),4.91 (1H,s,H-15a),4.63 (1H,s,H-15b),2.69 (1H,dd,J=16.83,3.90 Hz,H-6a),2.53 (1H,m,H-6b),2.36 (2H,m,H-5,3a),2.08 (1H,m,H-3b),1.91 (3H,d,J=1.51 Hz,H-13),1.67(4H,m,H-1 ~2),0.94 (3H,s,H-14);13CNMR (100 MHz,CDCl3)δ: 39.3 (C-1),23.2(C-2),36.4 (C-3),148.2 (C-4),48.6 (C-5),22.8 (C-6),148.4 (C-7),148.3 (C-8),119.2(C-9),38.3 (C-10),120.6 (C-11),171.5 (C-12),8.6 (C-13),18.7 (C-14),107.6 (C-15)。以上数据与文献[19] 报道基本一致,故鉴定为atractylenolid I。
化合物8: 白色晶体(甲醇),分子式C15H20O3,ESI-MSm/z: 249 [M +H]+。1H-NMR (400 MHz,CDCl3)δ: 4.88 (1H,s,H-15a),4.61 (1H,s,H-15b),2.60 (1H,dd,J=13.27,3.40 Hz,H-6a),2.44 (1H,m,H-6b),2.37 (2H,m,H-3a),2.27 (1H,d,J=13.77 Hz,H-9a),1.97 (1H,m,H-3b),1.84 (1H,m,H-5),1.81 (3H,d,J=1.51 Hz,H-13),1.66 (3H,m,H-1a,2),1.55 (3H,d,J=13.49 Hz,H-9b),1.25 (1H,m,H-1b),1.03 (3H,s,H-14);13C-NMR (100 MHz,CDCl3)δ: 41.5 (C-1),22.5 (C-2),36.3 (C-3),148.7 (C-4),51.9 (C-5),24.8 (C-6),161.0 (C-7),103.7(C-8),51.5 (C-9),36.9 (C-10),122.3 (C-11),172.3 (C-12),8.3 (C-13),16.7 (C-14),107.0 (C-15)。以上数据与文献[20] 报道基本一致,故鉴定为atractylenolid Ⅲ。
化合物9: 淡黄色油状液体,分子式C16H20O3,ESI-MSm/z: 261 [M +H]+。1H-NMR (400 MHz,CDCl3)δ: 4.89 (1H,s,H-15a),4.70 (1H,s,H-15b),2.55 ~2.30 (4H,m,H-3a,6a,9),233 (1H,m,H-6b),2.30 (3H,s,H-13),2.13 (1H,m,H-4),2.04 (1H,m,H-3b),1.70 (2H,m,H-1a,2a),1.54 (2H,m,H-1b,2b),0.76 (3H,s,H-14);13C-NMR (100 MHz,CDCl3)δ: 41.8 ( C-1),23.4 ( C-2),37.2 (C-3),149.0 (C-4),45.3 (C-5),20.7(C-6),119.9 (C-7),155.0 (C-8),39.3 (C-9),6.6 (C-10),133.4 (C-11),138.0 (C-12),39.9 ( C-13),17.5 ( C-14),107.6 ( C-15),164.5 (C-16)。以上数据与文献[21] 报道基本一致,故鉴定为atrchiterpene B。
化合物10: 白色粉末,分子式C30H46O2,ESIMSm/z: 439 [M +H]+。1H-NMR (400 MHz,CDCl3)δ: 5.63 (1H,s,H-12),2.96 (1H,ddd,J=12.77,6.70,4.07 Hz,H-2a),2.63(1H,m,H-2b),2.44 (1H,s,H-9),1.37,1.27,1.18,1.11,1.07,0.91,0.90,0.88(24H,s,8×CH3);13C-NMR (100 MHz,CDCl3)δ: 40.0 ( C-1),34.6 ( C-2),217.3 ( C-3),47.9 (C-4),55.6 (C-5),19.0 (C-6),32.3(C-7),43.7 (C-8),61.3 (C-9),37.0 (C-10),199.6 (C-11),128.1 (C-12),171.1 (C-13),45.1 (C-14),26.6 (C-15),26.5 (C-16),32.7(C-17),47.9 (C-18),45.6 (C-19),31.1 (C-20),34.4 (C-21),36.7 (C-22),26.6 (C-23),21.6 (C-24),15.8 (C-25),18.7 (C-26),23.7(C-27),29.0 (C-28),33.2 (C-29),23.5 (C-30)。以上数据与文献[22] 报道基本一致,故鉴定为olean-12-ene-3,11-dione。
化合物11: 白色粉末,分子式C30H48O,ESIMSm/z: 425 [M +H]+。1H-NMR (400 MHz,CDCl3)δ: 68.00 (1H,ddd,J=14.79,4.70,2.30 Hz,H-2a),2.48 (1H,m,H-12a),2.27(1H,dd,J=13.92,2.12 Hz,H-2b),1.96(1H,m,H-12b),1.25,1.17,1.09,1.03,1.02,0.94,0.89,0.71 (24H,s,8 × CH3);13C-NMR (100 MHz,CDCl3)δ: 218.3 (C-3),134.1 ( C-13),133.8 ( C-18),55.1 ( C-5),50.1 (C-9),47.1 (C-4),45.2 (C-14),41.0(C-8),39.9 (C-1),39.4 (C-19),38.7 (C-22),37.0 (C-16),36.8 (C-10),35.7 (C-21),34.9 (C-17),34.1 (C-2),33.2 (C-20),32.5(C-29),29.8 (C-7),27.0 (C-12),26.8 (C-23),25.1 (C-15),24.1 (C-30),24.3 (C-28),22.5 (C-11),21.5 (C-27),21.1 (C-24),20.1(C-6),17.9 (C-25),16.5 (C-26)。以上数据与文献[23] 报道基本一致,故鉴定为δ-amyrione。
4 血管新生抑制活性研究
参考文献[13] 报道,采用MTT 法测定各化合物对人脐静脉内皮细胞HUVEC 增殖的抑制活性。取HUVEC 细胞复苏、增殖、传代,对数生长期细胞移入96 孔板中,每孔2×104个细胞,在37 ℃、5% CO2下培养24 h 后,加入各化合物及阳性对照(地塞米松),给药浓度为5 μmol/L,空白组加入培养基,每组6 个复孔,继续培养48 h,培养结束前4 h 弃去上清,在570 mm 波长处测定吸光度(A),计算抑制率,公式为抑制率= (1-A样品/A空白) ×100%。
结果,化合物1 ~9 均具有人脐静脉内皮细胞HUVEC 抑制活性,其中1~2、5 与阳性对照相当,见表2。
表2 各化合物抗HUVEC 细胞增殖活性(±s,n=6)Tab.2 Anti-proliferative activities of various compounds against HUVEC cells (±s,n=6)
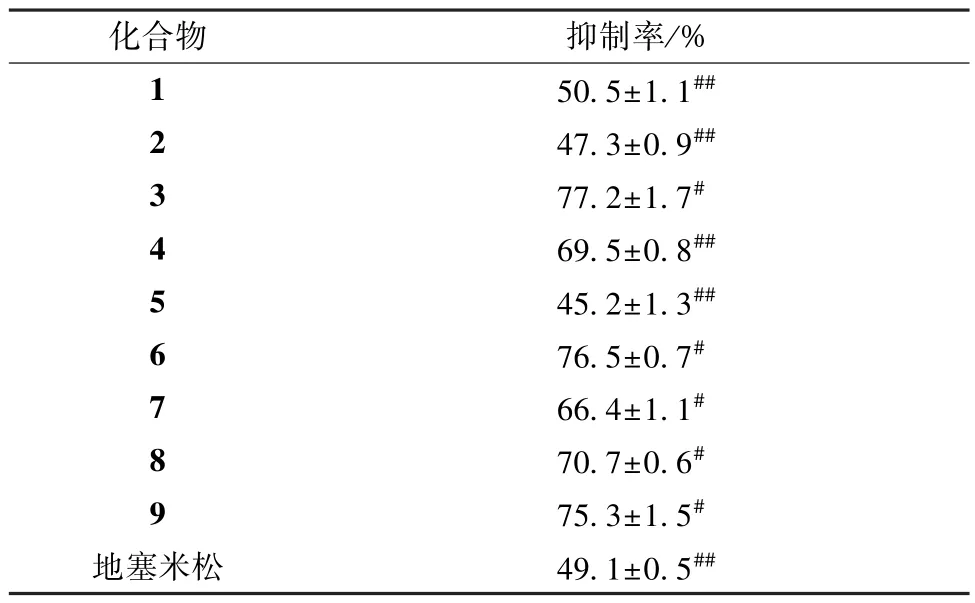
表2 各化合物抗HUVEC 细胞增殖活性(±s,n=6)Tab.2 Anti-proliferative activities of various compounds against HUVEC cells (±s,n=6)
注: 与地塞米松比较,#P<0.05,##P<0.01。
化合物抑制率/%1 50.5±1.1##2 47.3±0.9##3 77.2±1.7#4 69.5±0.8##5 45.2±1.3##6 76.5±0.7#7 66.4±1.1#8 70.7±0.6#9 75.3±1.5#地塞米松49.1±0.5##
5 讨论与结论
北苍术作为中药苍术的正品基原植物,具有较大的中药市场,为了进一步加强该药材的综合开发利用,本研究对北苍术中萜类成分进行系统分离,共鉴定得到11 个化合物,包括9 个倍半萜类、2个三萜类,其中化合物1 是倍半萜新化合物。血管新生是指从已有血管发芽生成新的血管,它是体内重要的生理和病理过程,正常机体处于动态平衡过程,然而当平衡被打破时会造成肿瘤、类风湿关节炎等疾病的产生,因此寻找良好的血管新生抑制剂显得尤为重要[24-25]。体外人脐静脉内皮细胞抑制活性研究表明,化合物1 ~2、5 对HUVEC 细胞的抑制活性与地塞米松相当,提示这3 个化合物血管新生抑制剂的的潜在活性先导化合物,对新生血管相关疾病的治疗具有积极意义。该实验的开展在丰富北苍术化学成分的同时,为该药材的进一步开发提供了新的研究思路。
——青蒿素

