吉列替尼皮肤毒性的机制及冰片的潜在保护作用
周有容,尹一鸣,黄祥良,胡誉怀,何俏军
1.浙江大学药学院,浙江 杭州 310058
2.浙江大学智能创新药物研究院,浙江 杭州 310018
吉列替尼(Gilteritinib)属于第二代FLT3新型分子靶向抑制剂,目前已在多个国家和地区被批准应用于FLT3突变的复发性或难治性(药物难治)急性髓性白血病成人患者的标准化治疗[1]。与接受化疗的患者比较,接受吉列替尼治疗的患者无进展生存期显著延长,白细胞数全部或部分恢复正常水平的患者显著增多,展现出极好的治疗效果[2]。然而,临床研究结果显示,约36%的患者在吉列替尼治疗期间出现了皮疹[3],虽多数患者表现较轻,但仍有部分患者会发展为较为严重的急性发热性嗜中性皮肤病(Sweet 综合征)[4-6],影响患者的生活质量,甚至不得不中止治疗,最终导致肿瘤进展。目前对吉列替尼皮肤毒性的治疗策略和管理手段十分有限,只能通过局部或全身应用类固醇等手段加以缓解,无法从根本上解决问题。
皮肤主要由表皮、真皮、皮下组织构成,皮疹是由于表皮或浅层真皮异常引起的皮肤疾病。由于真皮浅层中富含大量毛细血管,因此药物可以通过毛细血管转运最终直接作用于表皮深层细胞,而表皮深层细胞主要为角质形成细胞。角质形成细胞通过分化、向外迁移至表皮取代表皮脱落的细胞,同时也会分泌各种构成细胞紧密连接的基础角蛋白,对于维持表皮的正常生理功能至关重要[7]。诸多小分子激酶抑制剂可以通过影响角质形成细胞的命运来诱导皮肤毒性的发生,例如直接诱导细胞凋亡以及调节细胞的过度分化、迁移和角化不完全等[8-11]。现代医学发现,多种天然化合物可以通过调控氧化应激、炎症反应、免疫失调和DNA损伤等方式改善受损的皮肤[12-13]。如黄芪、瓜蒌、当归中提取到的活性成分芒柄花素对炎症性皮肤病具有保护作用[14];丹参酮ⅡA 抑制中波紫外线照射引起的人表皮形成细胞生长阻滞与DNA 损伤基因的转录以及信号通路分子磷酸化,减少紫外线辐照造成的人皮肤角质形成细胞的损伤[15];黄芪甲苷可以加速创面组织的恢复和血管生成,缓解糖尿病导致的皮肤缺损[16];甘草素增强抗氧化能力保护长波紫外线诱导的人角质形成细胞氧化损伤[17];对已经受损的皮肤,天然冰片可以通过诱导表皮细胞的增殖和分化,促进受伤部位皮肤的再生,从而达到修复皮肤屏障的作用[18]。基于此,文本聚焦于探索吉列替尼诱发皮肤毒性的机制以及天然化合物能否改善吉列替尼皮肤毒性展开研究,以期为临床解决吉列替尼皮肤毒性寻找一种安全有效的干预策略。
1 材料与方法
1.1 细胞、实验动物、主要试剂与仪器
人角质形成细胞HaCaT购自中国科学院上海生命科学研究院细胞资源中心。6周龄C57BL/6J雄性小鼠购自北京维通利华实验动物技术有限公司。所有小鼠在标准环境条件中饲养,自动光照,每12 h明暗交替,动物自由饮水,自由摄食。动物实验及相关处理均已通过浙江大学智能创新药物研究院动物管理委员会审查(DW22072902 和DW202211211521)。
吉列替尼(分子式C29H44N8O3,货号146621)为大连美仑生物技术有限公司产品;天然化合物库来源于浙江大学药学院药物毒理转化平台,详细化合物见参考文献[19];冰片(分子式C10H18O,货号T00517,主要成分为右旋龙脑)为上海陶素生化科技有限公司产品;(2-羟丙基)-β-环糊精(分子式C63H112O42)为上海阿拉丁生化科技股份有限公司产品;Ki-67 为美国Proteintech 公司产品;一步法TUNEL 检测试剂盒(绿色荧光)、青霉素和链霉素粉末为上海碧云天生物技术有限公司产品;HE 染色试剂盒为北京索莱宝科技有限公司产品;DMEM 培养液为杭州科易生物技术有限公司产品;胎牛血清为美国Hyclone 公司产品;NAC(分子式C5H9NO3S)为上海麦克林生化科技股份有限公司产品;c-PARP为杭州华安生物技术有限公司产品;β-肌动蛋白为杭州戴格生物技术有限公司产品;Western Lightning ECL 化学发光底物试剂盒为珀金埃尔默股份有限公司产品;PI/Annexin V 双染凋亡试剂盒为杭州联科生物技术有限公司产品;生物胞素Alexa FluorTM488为赛默飞世尔科技公司产品。蛋白免疫印迹装置为美国Bio-Rad 公司产品;倒置显微镜为日本Olympus公司产品;低速离心机为德国Eppendorf 公司产品;酶标仪购自帝肯(上海)实验器材有限公司;流式细胞仪为美国Beckman Coulter 公司产品;扫片机为宁波舜宇仪器有限公司产品。
1.2 实验思路
首先采用快速毒性模型造模方式在体内造模,通过组织病理学检测手段分析吉列替尼所致皮肤毒性的机制。再通过人角质形成细胞采用蛋白质印迹法、流式细胞术结合PI/Annexin Ⅴ双染法、流式细胞术结合DCFH-DA 染色法、免疫荧光技术等技术观察吉列替尼所致皮肤毒性的机制。最后通过人角质形成细胞存活实验筛选出干预吉列替尼皮肤毒性的天然化合物,并进一步在人角质形成细胞和小鼠模型中验证。
1.3 体内研究
1.3.1 实验分组及干预 (1)吉列替尼致皮肤损害实验:取16 只C57BL/6J 雄性小鼠,随机分为溶媒对照组和吉列替尼模型组,每组8只。参照吉列替尼的临床推荐剂量(口服120 mg/d),根据Meeh-Rubner方程计算小鼠等效剂量约20 mg·kg-1·d-1,为了缩短吉列替尼皮肤毒性发生所需时间,给予小鼠三倍临床等效剂量(60 mg·kg-1·d-1)。吉列替尼模型组:将吉列替尼分散于环糊精中,每天灌胃给药1 次,连续给药28 d;溶媒对照组:给予不含吉列替尼的等量环糊精溶液。各组给药容量均为5 mL/kg。
(2)天然化合物干预实验:取36 只C57BL/6J雄性小鼠,随机分为空白对照组、吉列替尼对照组、冰片对照组和冰片+吉列替尼组,每组9 只。吉列替尼对照组每天1 次灌胃给予60 mg/kg 吉列替尼,连续给药28 d;冰片对照组每天1次灌胃给予150 mg/kg冰片,连续给药28 d;冰片+吉列替尼组将吉列替尼和冰片同时分散于环糊精中,灌胃给药,给药剂量与吉列替尼对照组或冰片对照组一致,连续给药28 d;空白对照组每天给予不含吉列替尼和/或冰片的等量环糊精溶液处理。各组给药容量为5 mL/kg。
给药周期结束后处死小鼠,对小鼠腹部及腋下皮肤进行观察拍照后,取小鼠腋下至腹部皮肤组织,放入10%磷酸缓冲福尔马林溶液(pH=7.4)中,充分固定皮肤组织后,进行组织脱水,石蜡包埋,并用切片机进行组织切片(厚度5 µm)。
1.3.2 HE染色法观察皮肤组织病理学变化 将石蜡组织切片放置在二甲苯及不同浓度梯度乙醇中去蜡。去蜡的切片置于苏木素染液中染色2 min 后浸没于盐酸乙醇溶液中分化2 s。用自来水冲洗后将石蜡切片浸没于伊红溶液中染色1 min,随后用自来水冲洗。将切片在不同浓度梯度乙醇中脱水后移至二甲苯中,中性树胶封片。采用扫片机扫描并采集染色结果。最外层不含细胞核的部分为角质层,其内透明部分为透明层,中间富含细胞核且较厚部分为颗粒层和棘层,进一步往内细胞核排列较为紧密的部分是基底层,基底层以内则为真皮层,其中真皮层中还分布有毛囊和皮脂腺等附属器官。
1.3.3 TUNEL 检测观察细胞凋亡 组织切片先脱蜡水化,使用10 mmol/L Tris-盐酸缓冲液(pH=7.4)将不含DNA 酶的蛋白酶K 的浓度稀释至20 µg/mL,每片滴加50 µL 至完全覆盖组织,在37 ℃恒温下孵育20 min。用PBS 洗三次。每张切 片 按TdT 酶5 µL、荧 光 标 记 液45 µL 配 制TUNEL 检测工作液。在恒温37 ℃条件下孵育1 h。弃去TUNEL 检测液,用PBS 洗三次,弃去PBS,每片滴加15 µL 抗荧光淬灭剂,盖上盖玻片封片,随后将玻片平放于通风橱中风干12 h。荧光显微镜拍照采集图像并保存。与细胞核共定位且呈绿色的部分代表TUNEL 检测染色阳性区域,表征发生凋亡的细胞。
1.3.4 抗Ki-67 抗体免疫组织化学染色观察细胞增殖激活情况 组织切片先脱蜡水化后在乙二胺四乙酸中热修复抗原表位20 min,在室温下用过氧化物酶阻断液去除内源性过氧化物酶活性10 min,用10%山羊血清封闭20 min。用Ki-67抗体(按1∶5000 稀释)4 ℃下孵育过夜,并进行皮肤组织切片。次日,用PBS 洗涤两次,每次5 min,用HRP 标记的二抗室温孵育1 h。再次洗涤,用DAB 孵育4 min,洗净DAB,苏木精复染8 min,1%盐酸乙醇分化2 s,流水冲洗至无色。封片后用扫片机扫描染色结果。与细胞核共定位且呈现明显棕褐色的部分代表Ki-67 阳性区域,表征细胞增殖的激活。
1.4 体外研究
1.4.1 实验分组及干预 (1)吉列替尼体外造模实验:将贴壁生长的HaCaT 细胞培养于含10%胎牛血清的DMEM 培养液中,并将培养器皿放置在37 ℃、5%二氧化碳的细胞培养箱内培养。培养过程中可额外添加1%双抗(100 U/mL青霉素、0.1 mg/mL 链霉素)。吉列替尼模型组分别给予不同浓度吉列替尼(0.25、0.50、1.00、2.00、4.00 µmol/L 或0.5、1.0、2.0 µmol/L);正常对照组则不给予吉列替尼。
(2)NAC 拮抗实验:将HaCaT 细胞分为空白对照组、吉列替尼对照组、NAC 对照组和NAC 拮抗组。吉列替尼对照组仅给予1 µmol/L 吉列替尼;NAC 对照组仅给予2 mmol/L NAC;NAC 拮抗组同时给予1 µmol/L 吉列替尼和2 mmol/L NAC;空白对照组不给药处理。
(3)天然化合物筛选实验:将HaCaT 细胞分为空白对照组、吉列替尼对照组和56 种不同的天然化合物干预组。吉列替尼对照组仅给予1.0 µmol/L 吉列替尼;56 种不同的天然化合物干预组则同时给予1 µmol/L 吉列替尼和这56 种不同天然化合物的相应临床浓度;空白对照组不给药处理。
(4)天然化合物干预实验:将HaCaT 细胞分为空白对照组、吉列替尼对照组、冰片对照组和冰片+吉列替尼组。吉列替尼对照组仅给予1.0 µmol/L吉列替尼;冰片对照组仅给予75 µmol/L冰片;冰片+吉列替尼组同时给予1.0 µmol/L 吉列替尼和75 µmol/L冰片;空白对照组不给药处理。
1.4.2 SRB 染色法检测细胞存活情况 SRB 染色法具体操作步骤参考文献[20]。将HaCaT 细胞以4000 个/孔的密度接种于96 孔板中,并确保试验期间的细胞处于对数生长期。37 ℃恒温培养箱放置24 h 后,细胞按照吉列替尼体外造模实验和天然化合物筛选实验分别处理,药物作用一定时间后,弃去培养液,每孔加入10%三氯乙酸,在4 ℃固定1 h。弃去三氯乙酸,并用蒸馏水洗涤5 次,放于60 ℃烘箱中干燥。烘干后,96 孔板中每孔加入4 mg/mL的SRB溶液70 µL,室温静置染色20 min,弃去SRB 溶液,并用浓度为1%冰醋酸溶液反复冲洗,再置于60 ℃烘箱中烘干。烘干后每孔加入70 µL 10 mmol/L Tris-base 溶液溶解,将96 孔板置于摇床上振荡20 min 使结合细胞的染料充分溶解,进行脱色。用酶标仪在515 nm 波长下测定每孔的吸光度值。吉列替尼体外造模实验按下式计算:给药处理后细胞存活率(%)=给药处理组平均吸光度值/正常对照组平均吸光度值×100%;天然化合物筛选实验按下式计算:干预效率=不同天然化合物干预组平均吸光度值/吉列替尼对照组平均吸光度值。
1.4.3 流式细胞术(PI/Annexin Ⅴ双染法)检测细胞死亡方式 将HaCaT细胞以2×105个/孔的密度接种于六孔板中。37 ℃、5%二氧化碳下孵育24 h 后,分别按照吉列替尼体外造模实验和天然化合物干预实验处理。药物作用24 h 后,通过胰蛋白酶消化收集细胞至EP 管。细胞用PBS 润洗细胞两次,400×g离心4 min 后,加入300 µL 1×结合缓冲液重悬。在各EP管中加入5 µL Annexin V和10 µL PI,室温下避光孵育。孵育15 min后,将细胞用滤膜过滤至洁净流式管中。最后,用流式细胞仪对滤过后的细胞进行分析。
1.4.4 蛋白质印迹法检测凋亡相关蛋白c-PARP的表达 将HaCaT 细胞以2×105个/孔的密度接种于六孔板中。5%二氧化碳培养箱37 ℃孵育24 h 后,分别按照吉列替尼体外造模实验、NAC拮抗实验以及天然化合物干预实验进行处理。药物作用24 h 后用裂解缓冲液(0.3% NP-40、0.3% TritonX-100、0.25% Leupeptin、0.1% PMSF和0.1% NaVO3)从细胞中制备蛋白裂解物,并加入适量1×上样缓冲液制备为蛋白样本,加热95 ℃。蛋白样本分别用8%、10%、12% SDS 聚丙烯酰胺凝胶电泳分离,每个样品总蛋白为20 µg,并将凝胶整体转移到聚偏二氟乙烯膜。然后将剪切的膜封闭1 h 后,与相应的一抗、二抗孵育。电泳检测c-PARP 和β-肌动蛋白。使用ECL 化学发光底物试剂进行可视化处理,使用Image J软件进行灰度分析。以β-肌动蛋白为内参蛋白,检测c-PARP蛋白的相对表达量并进行归一化处理。
1.4.5 流式细胞术(DCFH-DA染色法)检测活性氧水平 将HaCaT细胞以2×105个/孔的密度接种于六孔板中。5%二氧化碳培养箱37 ℃孵育24 h后,分别按照吉列替尼体外造模实验、NAC 拮抗实验以及天然化合物干预实验处理。药物作用24 h后,通过胰蛋白酶消化收集细胞至EP管。细胞用无血清DMEM 培养液润洗细胞两次,100×g离心4 min 后,加入1 mL 无血清DMEM 培养液。按照1∶1000 加入DCFH-DA 探针,37 ℃下避光孵育20 min。100×g离心4 min 后,无血清DMEM 培养液润洗细胞两次,加入150 µL无血清DMEM培养液重悬,将细胞用滤膜过滤至洁净流式管中。采用流式细胞仪对滤过后的细胞进行分析,通过归一化处理得到DCFH-DA相对荧光强度。
1.4.6 抗γ-H2AX 抗体免疫荧光观察细胞DNA损伤情况 将HaCaT 细胞以4000 个/孔的密度接种于96孔板中,确保试验期间的细胞处于对数生长期。37 ℃恒温培养箱放置24 h后,分别按照吉列替尼体外造模实验和天然化合物干预实验处理,药物作用时间为24 h。弃去培养基并用新制备的4%多聚甲醛溶液在室温下固定20 min。用含0.1%Triton X-100的PBS溶液在4 ℃下透化细胞10 min。用PBS洗涤两次,每次5 min。用含4%牛血清白蛋白的PBS 溶液封闭30 min,PBS 洗涤两次,每次5 min。配置一抗γ-H2AX(按1∶200稀释)在4 ℃下孵育过夜。PBS 洗涤后,将细胞与Alexa Fluor 488标记的二抗孵育1 h,PBS洗涤两次,每次5 min,DAPI 染色5 min,置于荧光显微镜下观察。与细胞核共定位且呈现绿色的部分代表免疫荧光阳性区域,表征发生DNA损伤的细胞。
1.5 统计学方法
采用Prism 软件进行统计分析。每个实验数据用三个样本进行重复分析,符合正态分布的计量资料采用均数±标准差(±s)表示。若组别数为两组,组间显著性差异采用Student’st检验进行分析;若组别数超过两组,其组间的显著性差异采用方差单向分析以及后续的Dunnett T3检验方法进行分析。P<0.05表示差异有统计学意义。
2 结 果
2.1 吉列替尼可诱导小鼠皮肤病理性改变
相比溶媒对照组,吉列替尼模型组大体观察出现不同程度的皮疹,表现为腹部、腋下等皮肤干燥、脱屑、毛发稀疏,表明造模成功,见图1。吉列替尼模型组皮肤的表皮部分显著增厚,角化不全导致角质层不连续且疏松分层,棘层和颗粒层角质形成细胞凋亡,基底层角质形成细胞过度增殖,毛囊增大,皮脂腺增生,见图2。TUNEL检测结果显示,吉列替尼模型组可以明显观察到棘层和颗粒层角质形成细胞的细胞核绿色荧光强度显著增强,见图3。吉列替尼模型组平均阳性细胞数(33.33±7.41)多于溶媒对照组(4.33±0.47),表明细胞DNA发生了断裂,即发生细胞凋亡。免疫组织化学检测结果显示,增殖标志物Ki-67在吉列替尼模型组中表达明显增多,见图4,阳性区域主要分布在基底层角质形成细胞,表明吉列替尼可促进基底层角质形成细胞的过度增殖。上述结果提示,皮肤角质形成细胞的过度增殖可能与吉列替尼早期引起部分角质形成细胞的凋亡相关。

图1 吉列替尼模型组与溶媒对照组小鼠皮肤大体观Figure 1 Skin appearance of the mice in gilteritinib group and the control group
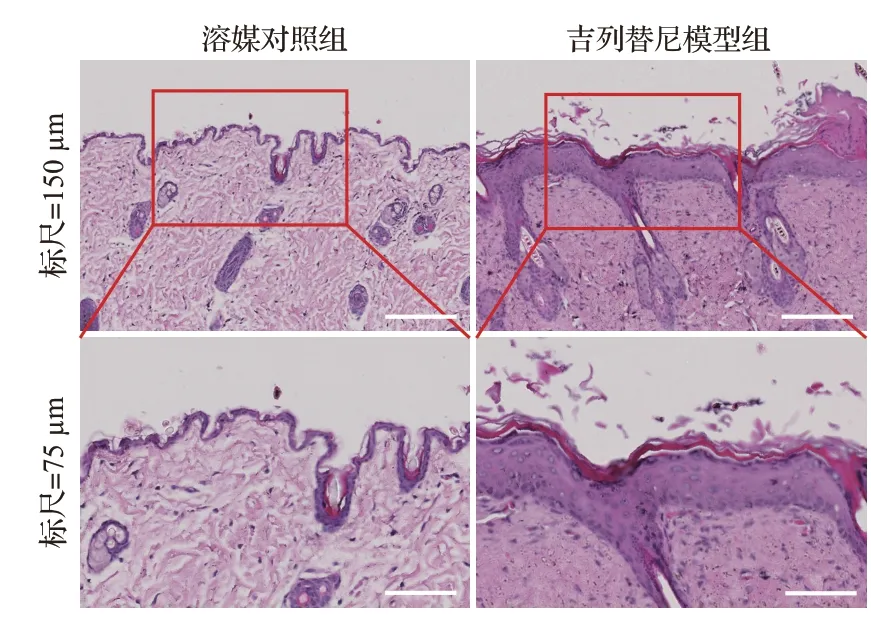
图2 吉列替尼模型组与溶媒对照组皮肤组织病理学表现(HE染色)Figure 2 The histopathological changes in skin from mice in gilteritinib group and the control group (HE staining)
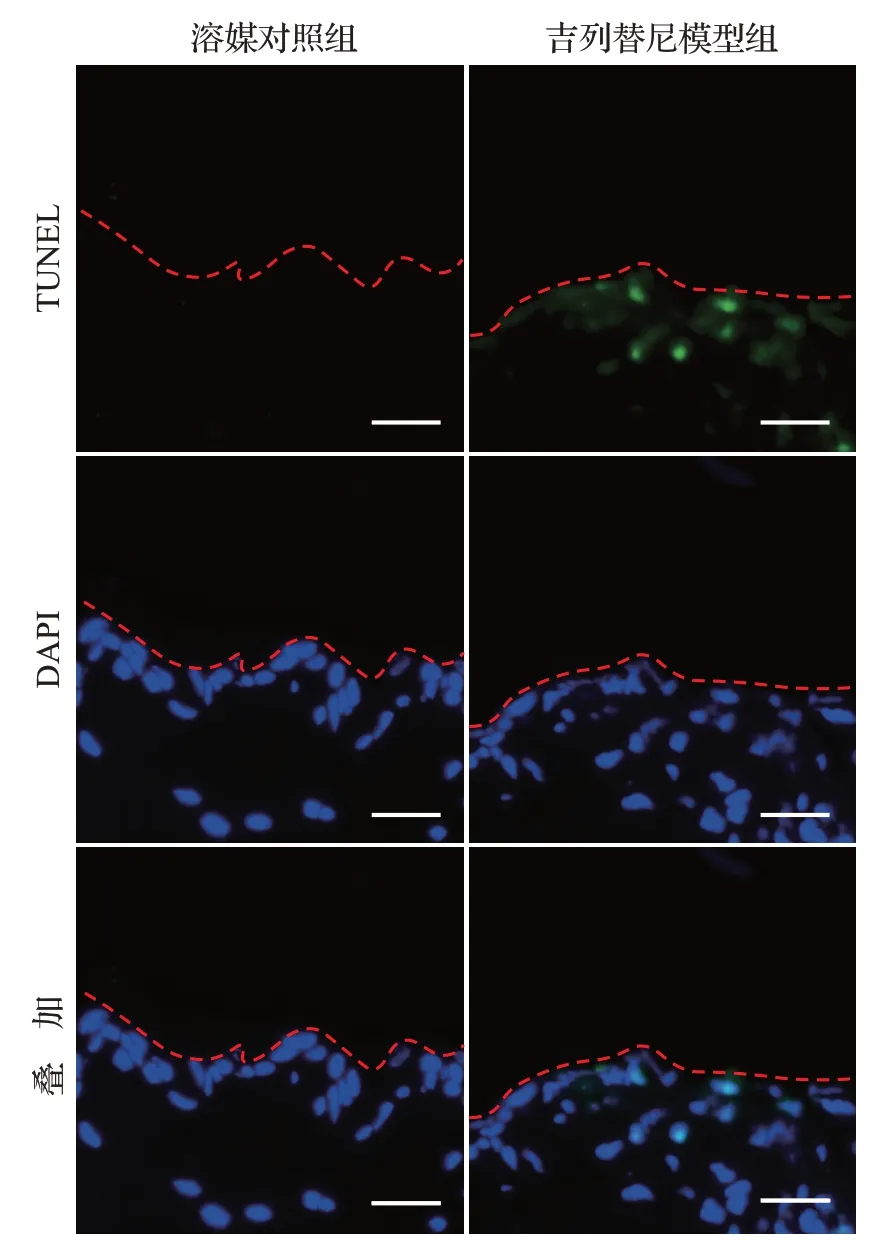
图3 吉列替尼模型组与溶媒对照组皮肤组织细胞凋亡情况(TUNEL检测)Figure 3 Apoptosis of the skin tissue cells from mice in gilteritinib group and the control group(TUNEL assay)
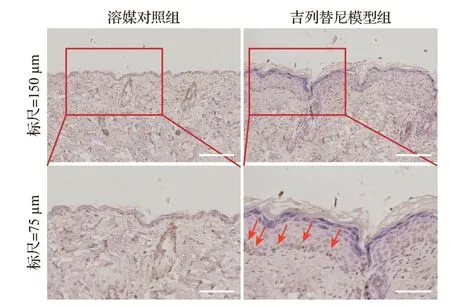
图4 吉列替尼模型组与溶媒对照组皮肤组织Ki-67表达(免疫组织化学染色)Figure 4 Ki-67 expression in the skin from mice in gilteritinib group and the control group(immunohistochemical staining)
2.2 吉列替尼体外可诱导角质形成细胞死亡和形态变化
SRB 染色法结果显示,不同浓度的吉列替尼分别作用于角质形成细胞24 和48 h 后,随着浓度不断升高,作用时间延长,细胞存活率逐渐下降,见图5。考虑到吉列替尼的最大血药浓度为0.56 µmol/L,选取三个浓度梯度(0.5、1.0、2.0 µmol/L)进行后续研究。

图5 不同浓度吉列替尼作用后HaCaT细胞存活率Figure 5 The survival rates of HaCaT cells after treated with different concentrations of gilteritinib
光学显微镜下观察发现,在不同浓度吉列替尼作用24 h 后,相比正常对照组,吉列替尼模型组贴壁细胞数明显下降,且随着吉列替尼浓度升高,角质形成细胞数逐渐减少。同时,细胞出现变圆和皱缩等细胞凋亡形态特征,见图6。提示吉列替尼会诱导角质形成细胞死亡和形态变化。
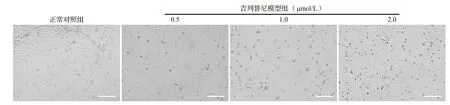
图6 不同浓度吉列替尼作用后HaCaT细胞在显微镜下所见Figure 6 Observation of HaCaT cells treated with different concentration of gilteritinib under microscope
2.3 吉列替尼体外可诱导角质形成细胞凋亡
不同浓度吉列替尼作用下凋亡角质形成细胞数逐渐增多,见图7和表1。
表1 吉列替尼模型组与正常对照组细胞凋亡相关指标比较Table 1 Comparison of apoptosis related indicators between gilteritinib groups and the control group(±s,n=3)
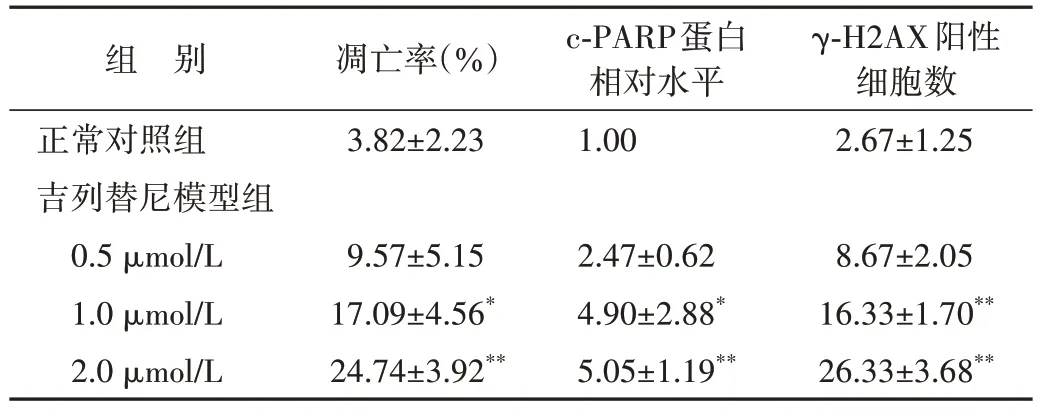
表1 吉列替尼模型组与正常对照组细胞凋亡相关指标比较Table 1 Comparison of apoptosis related indicators between gilteritinib groups and the control group(±s,n=3)
与正常对照组比较,*P<0.05,**P<0.01.c-PARP:切割型多腺苷二磷酸核糖聚合酶;γ-H2AX:磷酸化组蛋白H2AX.
组 别正常对照组吉列替尼模型组0.5 µmol/L 1.0 µmol/L 2.0 µmol/L凋亡率(%)3.82±2.23 c-PARP蛋白相对水平1.00 γ-H2AX阳性细胞数2.67±1.25 8.67±2.05 16.33±1.70**26.33±3.68**9.57±5.15 17.09±4.56*24.74±3.92**2.47±0.62 4.90±2.88*5.05±1.19**

图7 吉列替尼模型组与正常对照组流式细胞检测结果Figure 7 Flow cytometry results of the gilteritinib groups and the control group
蛋白质印迹法结果显示,角质形成细胞在不同浓度吉列替尼作用24 h 后,凋亡标志蛋白c-PARP蛋白表达水平随药物浓度的升高而上调,见图8和表1。免疫荧光结果显示,代表DNA双链断裂发生的标志物γ-H2AX 的水平在吉列替尼作用后显著上调,见图9和表1。上述结果提示,吉列替尼可诱导角质形成细胞发生凋亡。
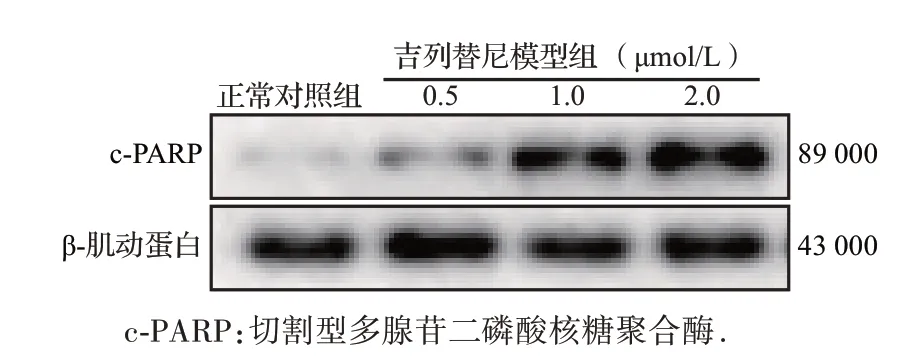
图8 吉列替尼模型组与正常对照组角质形成细胞中c-PARP蛋白电泳图Figure 8 Western blotting results of c-PARP expression in HaCaT cells in gilteritinib groups and control group

图9 吉列替尼模型组与正常对照组γ-H2AX表达(免疫荧光染色)Figure 9 Expression of γ-H2AX in gilteritinib groups and the control group(immunofluorescence staining)
2.4 吉列替尼通过诱导活性氧累积导致角质形成细胞凋亡
流式细胞术检测结果显示,不同浓度吉列替尼作用后,细胞内DCFH-DA相对荧光强度上升,并呈剂量依赖性,见图10A,提示细胞内活性氧发生累积。而NAC拮抗组可以减少吉列替尼作用后引起的细胞内DCFH-DA 相对荧光强度上升,见图10B,提示NAC可以逆转细胞内吉列替尼引起的活性氧累积。
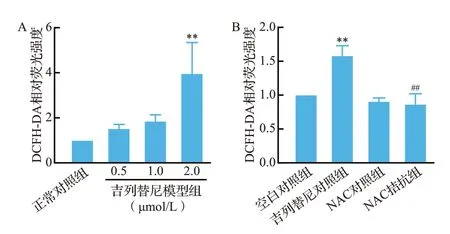
图10 各组DCFH-DA荧光强度比较Figure 10 The relative fluorescence intensity of DCFH-DA in each group
蛋白质印迹法结果显示,与吉列替尼对照组(3.18±0.44)比较,NAC 拮抗组的c-PARP 表达水平(1.39±0.78)下降(t=0.24,P<0.05),见图11。以上结果表明,抗氧化剂NAC 能减轻吉列替尼诱导的角质形成细胞活性氧的过度累积和凋亡。

图11 NAC 拮抗组与各对照组细胞中c-PARP 蛋白电泳图Figure 11 Western blotting results of the c-PARP protein expression in NAC antagonist group and the control groups
2.5 天然化合物冰片能拮抗吉列替尼导致的角质形成细胞死亡
SRB 染色法结果显示,在天然化合物库的56种药物中,除了一种化合物使吉列替尼对照组的细胞存活率进一步下降,其余55 种药物皆能导致吉列替尼对照组的细胞存活率不同程度上调,其中冰片上调细胞存活率的效率最高(2.05),见图12。
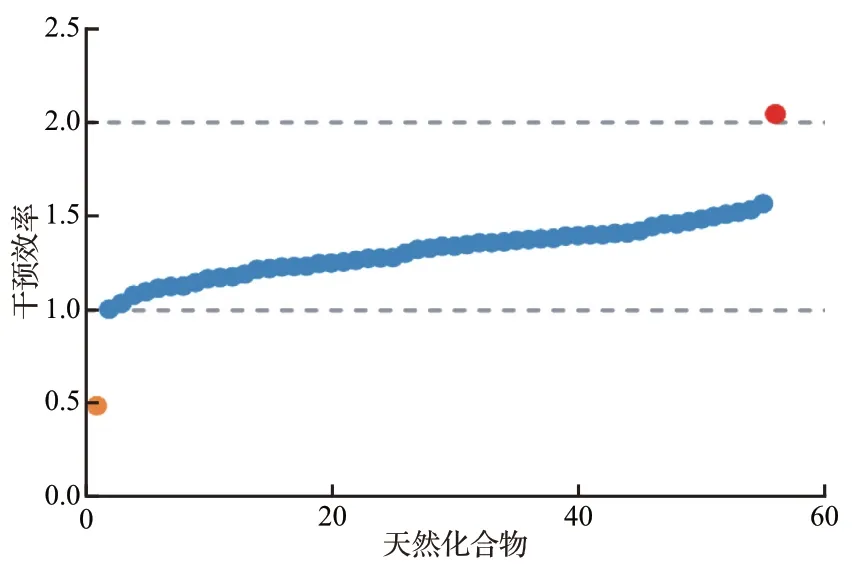
图12 56 种天然化合物对吉列替尼模型组细胞存活率的干预效率Figure 12 Interventional efficiency of 56 natural compounds on cell survival rate of the gilteritinib group
2.6 冰片可逆转吉列替尼引起的角质形成细胞死亡和形态变化
光学显微镜下,与吉列替尼对照组比较,冰片+吉列替尼组细胞数明显增多,变圆和皱缩的细胞数明显减少(图13),提示冰片可以逆转吉列替尼引起的角质形成细胞死亡和形态变化。
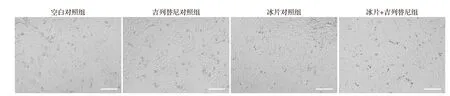
图13 冰片+吉列替尼组与各对照组显微镜下图像Figure 13 Microscopic images of the borneol+gilteritinib group and the control groups
2.7 冰片可逆转吉列替尼引起的角质形成细胞角质形成凋亡
流式细胞术检测结果显示,与吉列替尼对照组比较,冰片+吉列替尼组角质形成细胞凋亡率由(20.36±1.21)%降低至(14.29±3.12)%(t=0.16,P<0.05),见图14 和表2。蛋白质印迹法检测结果显示,与吉列替尼对照组比较,冰片+吉列替尼组角质形成细胞c-PARP 表达水平下降,见图15和表2。免疫荧光检测结果显示,与吉列替尼对照组比较,冰片+吉列替尼组角质形成细胞中γ-H2AX 的表达显著下调,见图16和表2。结果表明,冰片可减少吉列替尼诱导的角质形成细胞凋亡。
表2 冰片+吉列替尼组与各对照组细胞凋亡相关指标比较Table 2 Comparison of apoptosis related indicators between borneol+gilteritinib group and the control groups(± s,n=3)
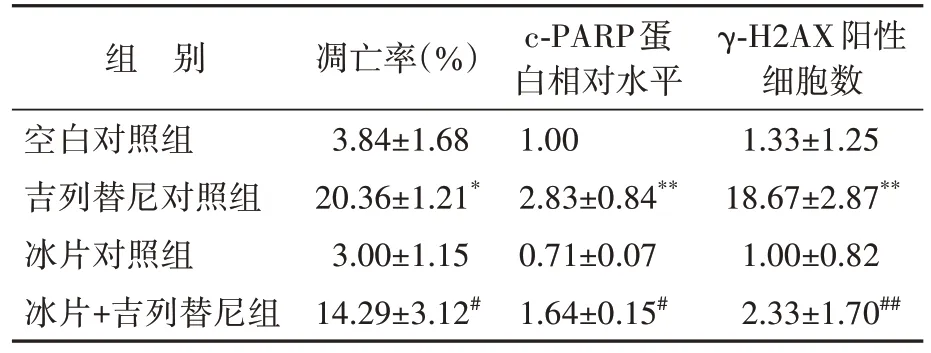
表2 冰片+吉列替尼组与各对照组细胞凋亡相关指标比较Table 2 Comparison of apoptosis related indicators between borneol+gilteritinib group and the control groups(± s,n=3)
组 别空白对照组吉列替尼对照组冰片对照组冰片+吉列替尼组凋亡率(%)3.84±1.68 20.36±1.21*3.00±1.15 14.29±3.12#c-PARP蛋白相对水平1.00 2.83±0.84**0.71±0.07 1.64±0.15#γ-H2AX阳性细胞数1.33±1.25 18.67±2.87**1.00±0.82 2.33±1.70##

图15 冰片+吉列替尼组与各对照组c-PARP 蛋白表达电泳图Figure 15 Western blotting results of c-PARP protein expression in the borneol+gilteritinib group and the control groups
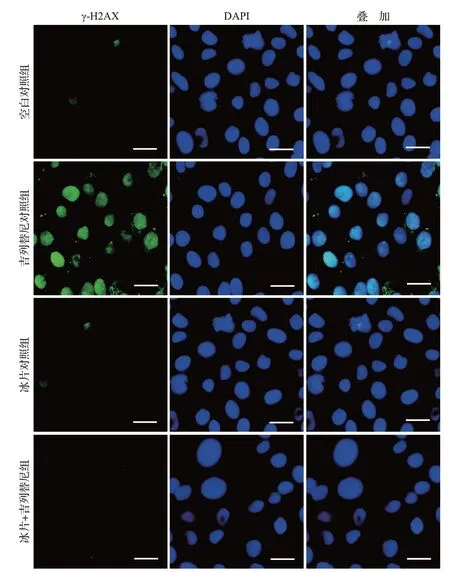
图16 冰片+吉列替尼组与各对照组γ-H2AX表达(免疫荧光染色)Figure 16 Expression of γ-H2AX in the borneol+gilteritinib group and the control groups (immunofluorescence staining)
2.8 冰片可减少吉列替尼诱导的角质形成细胞活性氧过度累积
流式细胞术检测结果显示,与吉列替尼对照组比较,冰片+吉列替尼组角质形成细胞DCFH-DA 相对荧光强度由(1.91±0.19)下降至(1.36±0.37),差异有统计学意义(t=0.17,P<0.01),提示细胞内活性氧水平下降。
2.9 冰片可缓解吉列替尼诱导的小鼠皮肤病理性改变
HE 染色结果显示,相比吉列替尼对照组,冰片+吉列替尼组皮肤表皮层厚度恢复正常,毛囊增大、皮脂腺增生等变化也得到显著改善,见图17。结果提示,冰片可缓解吉列替尼诱导的小鼠皮肤病理性改变。
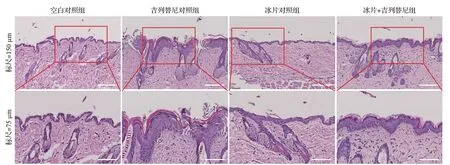
图17 冰片+吉列替尼组与各对照组皮肤组织病理学表现(HE染色)Figure 17 The histopathological changes in skin from mice in the borneol+gilteritinib group and the control groups(HE staining)
2.10 冰片可缓解吉列替尼诱导的小鼠皮肤细胞凋亡
TUNEL 检测结果显示,与吉列替尼对照组比较,冰片+吉列替尼组皮肤角质形成细胞的绿色荧光显著降低,两组平均阳性细胞数分别为(27.00±2.45)和(12.33±3.40),差异有统计学意义(t=0.28,P<0.01)。DAPI染色结果显示,在吉列替尼作用后小鼠皮肤角质形成细胞DNA 片段和核固缩增加,而冰片+吉列替尼组皮肤角质形成细胞的细胞核形态恢复正常,见图18。以上结果表明,冰片能够在体内水平显著抑制吉列替尼诱导的皮肤角质形成细胞凋亡。
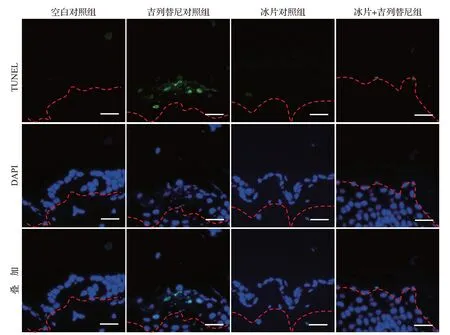
图18 冰片+吉列替尼组与各对照组皮肤组织细胞凋亡情况(TUNEL检测)Figure 18 Apoptosis of the skin tissue cells from mice in the borneol+gilteritinib group and the control groups (TUNEL assay)
与空白对照组比较,*P<0.05,**P<0.01;与吉列替尼对照组比较,#P<0.05.c-PARP:切割型多腺苷二磷酸核糖聚合酶;γ-H2AX:磷酸化组蛋白H2AX.
3 讨 论
在接受TKI 治疗的患者中,皮疹、毛发和指甲变化、黏膜炎、光敏性等皮肤毒性发生率很高[21-22]。目前,相较于其他脏器的毒性,临床上对皮肤毒性关注度不高。然而,皮肤作为人体最大的器官,是人体防御外界刺激的第一道屏障,具有调节体温、代谢、呼吸等多种生理功能[23]。药物性皮肤毒性的发生会极大地改变外表,给患者带来身心困扰,降低生活质量。严重的药物性皮肤毒性不仅会影响治疗效果,甚至会导致死亡[24]。吉列替尼是一种多靶点激酶抑制剂,应用于FLT3突变的复发性或难治性(药物难治)急性髓性白血病成人患者的一线治疗,但在其治疗期间约36%的患者出现了皮肤毒性[3],吉列替尼皮肤毒性机制不明以及干预策略的缺乏极大限制了其临床应用。因此,研究吉列替尼引起皮肤毒性的机制并制订相应的干预策略至关重要。但在目前药物的皮肤毒性研究中,会存在实验造模表型与临床毒性表型不一致的问题,导致结果的可靠性与可复制性较低[25-26]。
如何构建能够较好模拟药物临床毒性的模型对于后续毒性机制和干预策略的研究起着决定性的作用。本研究中,C57BL/6J 雄性小鼠连续28 d 灌胃给予吉列替尼(60 mg·kg-1·d-1,临床血药浓度的三倍)后,身上出现了皮疹,其表型主要为脱屑、结痂、局部区域毛发稀疏、皮肤干燥等,对病变部位皮肤病理学分析的结果也证明表皮部分明显增厚、毛囊增大、皮脂腺增生,皮疹现象与临床研究结果一致,表明该模型用作后续吉列替尼毒性研究有较强的可靠性。值得注意的是,个别小鼠在给药后不会出现皮疹或皮疹程度较轻,这可能是不同个体对药物的毒性耐受程度不同所致,且临床数据也说明皮肤毒性的发生存在一定的概率,提示本研究采用的造模方式较为可靠。
进一步组织病理学分析发现,表皮部分显著增厚,角化不全,推测角化不全是由于棘层和颗粒层角质形成细胞凋亡引起,而这部分角质形成细胞的凋亡又会代偿性地激活基底层角质形成细胞的过度增殖,从而引起皮疹部位表皮的显著增厚。已有文献报道Ki-67 指数与凋亡体指数呈正相关[27],这也验证了基底层角质形成细胞的增殖可能是皮肤角化不全的一种代偿机制。考虑到角质形成细胞的凋亡可能是吉列替尼皮肤毒性的起始因素,而在体内直接开展毒性机制的研究具有一定的困难,因而本研究以HaCaT 细胞作为体外研究模型,深入考察验证吉列替尼皮肤毒性发生的机制。结果显示,吉列替尼可以显著诱导活性氧过度累积,而活性氧可以改变细胞内各种信号传导分子和蛋白质的活性,从而影响细胞凋亡相关的信号传导网络[28],通过联用抗氧化剂NAC 可以显著逆转细胞凋亡,从而证明了吉列替尼通过上调活性氧诱导细胞凋亡。
近年来,有研究发现天然化合物具有防治TKI所致皮肤毒性的作用[10]。本研究在体外模型中对天然化合物库进行筛选发现,冰片可以显著逆转吉列替尼引起的角质形成细胞死亡,表明其干预吉列替尼皮肤毒性的潜力。冰片是一种提取自樟科植物龙脑樟枝叶的天然产物,在中医药治疗中常作为佐使药,以加强主药的药效或减弱主药毒性,进而起到相辅相成、相得益彰的功效[29]。本文资料显示,冰片能改善吉列替尼诱导的角质形成细胞活性氧过度累积和凋亡,且其本身对角质形成细胞没有杀伤作用。为了验证冰片在临床上应用的可能性,本研究采用小鼠体内模型验证了冰片对吉列替尼皮肤毒性的干预作用,结果表明冰片与吉列替尼的合用可以有效地抑制吉列替尼引起的皮疹,改善表皮增厚、角质形成细胞凋亡等毒性表型。此外,仅给予冰片的小鼠未产生明显的毒性症状,证明了冰片临床应用的安全性。
综上所述,吉列替尼可通过引起细胞内活性氧累积诱导角质形成细胞凋亡,致使皮肤毒性发生,而冰片可以通过减少活性氧累积和皮肤角质形成细胞凋亡,改善吉列替尼皮肤毒性。虽然上述研究结果已在动物体内进行了验证,但受限于目前临床研究对吉列替尼所致皮疹的具体特征未展开详细描述,因此不能确定动物模型上发生的皮疹表型与临床完全一致,仍须后续进一步考察吉列替尼皮肤毒性的临床表型。同时,考虑到其他TKI 如EGFR 抑制剂等在应用期间会出现丘疹、瘙痒、干燥等症状,而这与吉列替尼诱发的皮肤毒性又具有一定的相似性,因而冰片是否也能对EGFR 抑制剂的皮肤毒性发挥干预作用需要后续进一步探究。此外,虽然目前对吉列替尼的案例报道和临床研究均未发现性别与其皮疹发生率之间的明显相关性。但一些研究表明药物性皮疹存在性别差异,如在一项针对药物性皮疹的研究中,发现女性患者在使用某些药物后更容易出现严重的药疹[30]。此外,性别差异可能还受到其他因素的干扰,如特定药物的性别偏好和基因差异表达等[31]。因此雌性小鼠该机制能否适用,冰片能否起效也值得更深入研究。
志谢 研究得到国家自然科学基金(82204516)支持
Acknowledgements This paper was supported by the National Natural Science Foundation of China (82204516)
利益冲突 所有作者均声明不存在利益冲突
Conflict of Interests The authors declare that there is no conflict of interests
©The author(s) 2023.This is an open access article under the CC BY-NC-ND 4.0 License (https://creativecommons.org/licenses/by-nc-nd/4.0/)

