配合饲料替代冰鲜鱼对高体幼鱼生长及肝脏转录组的影响
杨桐林,黄 洋,茹笑影,李 锦,朱锟锋,杨佳慧,陈培培,朱春华
(1.广东海洋大学水产学院/2.广东省名特优鱼类生殖调控与繁育工程技术研究中心/3.广东省海水养殖生物育种工程实验室,广东 湛江 524088/4.南方海洋科学与工程广东省实验室(湛江),广东 湛江 524025)
肝脏是鱼类重要的代谢器官,不仅参与糖类、脂质及蛋白质等重要生物化合物的合成与代谢,还在生长信号通路内分泌控制、保持体内能量稳态、免疫防御病原体的入侵及解毒等方面有重要作用[7],肝脏转录组测序[8]可从分子水平揭示生物在特定实验条件下的生理调控机制。本研究以配合饲料替代冰鲜鱼喂养高体幼鱼,对幼鱼肝脏转录组数据进行生物信息学分析,获得差异表达基因(DEGs)及功能通路,重点挖掘与高体幼鱼生长、物质代谢相关基因,以期揭示配合饲料影响高体幼鱼生长、代谢的分子机制,为后续精准配合饲料开发提供理论依据。
1 材料与方法
1.1 实验饲料
表1 高体配合饲料组成Table 1 Composition of formula feed for Seriola dumerili

表1 高体配合饲料组成Table 1 Composition of formula feed for Seriola dumerili

表2 配合饲料和冰鲜鱼的营养成分Table 2 Nutritional composition of formula feed and chilled fish %
1.2 实验鱼及饲喂管理
实验用鱼为南方海洋科学与工程广东省实验室(湛江)人工繁育的高体幼鱼。高体是肉食性鱼类,实验前须驯食:每日投喂2 次,配合饲料与冰鲜鱼交替投喂,以连续1 周投喂的配合饲料被高体全部摄食、水面无配合饲料残留作为驯食完成标准。实验于6 m×6 m×3 m 的网箱中进行,水温21.7~ 29.2 ℃,溶解氧5.9~ 8.7 mg/L,盐度27.2~27.5,pH 8.2~8.8,氨氮低于0.02 mg/L,亚硝酸盐低于0.01 mg/L。取平均体质量(171.4±9.2)g 的健康高体幼鱼1 600 尾,随机分为配合饲料组(FF)与冰鲜杂鱼组(C),每组800 尾,分别饱食投喂配合饲料、冰鲜鱼,养殖60 d。
养殖实验结束后,每组各随机取鱼10 尾,麻醉后测量体长、体质量等生长指标,计算增质量率(WGR,%)、特定生长率(%·d-1)、饵料系数、成活率(%)等生长性能指标:
取其肝脏组织,经液氮速冻后置-80 ℃保存备用。
1.3 RNA提取、cDNA文库构建及测序
每组各随机取3尾鱼的肝脏组织,使用Trizol法提取高体幼鱼肝脏组织总RNA,用琼脂糖凝胶电泳检测RNA 样品降解情况及是否存在DNA 污染。通过Nanodrop2000 分光光度计检测RNA 的纯度和浓度,使用Agient 2100 检测RNA 的完整性,取质量合格的RNA 样品富集mRNA,并构建cDNA 文库。构建的文库使用Qubit3.0 进行初步定量,再使用Qsep400 检测文库插入片段,质检合格后,在Illumina NovaSeq6000平台上测序分析。
1.4 转录组数据处理分析
评估测序得到的原始数据(Raw reads)的质量,去除含有接头序列、低质量reads,获得高质量测序序列(Clean reads)。采用HISAT2 软件将高质量数据与高体基因组(Seriola_dumerili.v1.0.genome.fa)[9]进行比对;利用StringTie 对比对上的Clean reads 进行组装和定量,以FPKM(Fragments Per Kilobose of transcript per Million fragments mapped,每千个碱基的转录每百万映射读取的片段数)值作为衡量基因表达水平的指标。利用DESeq2 软件分析mRNA 差异表达,以差异倍数(Fold change,FC)≥2且错误发现率(False discovery rate,FDR)<0.05 作为筛选标准。以log2(FC) 值为横坐标、-lg (FDR)值为纵坐标建立差异表达基因火山图,横坐标绝对值越大,说明两样品间的表达量差异越大;纵坐标值越大,表明差异表达越显著。利用基因本体(GO)数据库对筛选的DEGs 进行功能注释,利用KEGG数据库富集分析DEGs的信号通路。
1.5 引物合成与qRT-PCR验证
选择转录组中的差异表达基因进行qRT-PCR验证。以β-actin为内参基因,使用Primer5.0设计由生工生物工程(上海)股份有限公司合成的引物(表3)。采用2-ΔΔCt法分析基因的相对表达量,使用Graphpad Prism 9 软件进行T 显著性检验分析,数据以平均值± 标准差表示,P<0.05 时,差异显著;P<0.01时,差异极显著。

表3 本研究所用引物Table 3 Primers used in the present study
2 结果与分析
2.1 差异表达基因分析
图1 图显示,获得144 个DEGs,其中,83 个DEGs 表达上调,61 个DEGs 表达下调。表4 展示差异表达前20的基因。
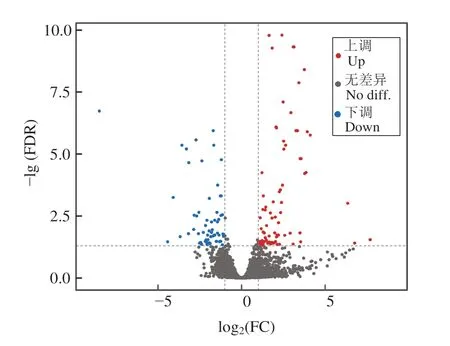
图1 差异表达基因火山图Fig.1 Volcano plot of differentially expressed genes
2.2 幼鱼生长相关参数
2.3 幼鱼转录组测序数据及比对分析
配合饲料组(FF)和冰鲜鱼组(C)的肝脏组织经转录组测序后,各样品Q30均不低于94.11%。将所得Clean reads 与参考基因组Seriola_dumerili.v1.0.genome.fa 进行比对,各样品比对效率均不低于95.83%(表6)。这表明测序数据质量较高,可用于后续分析。
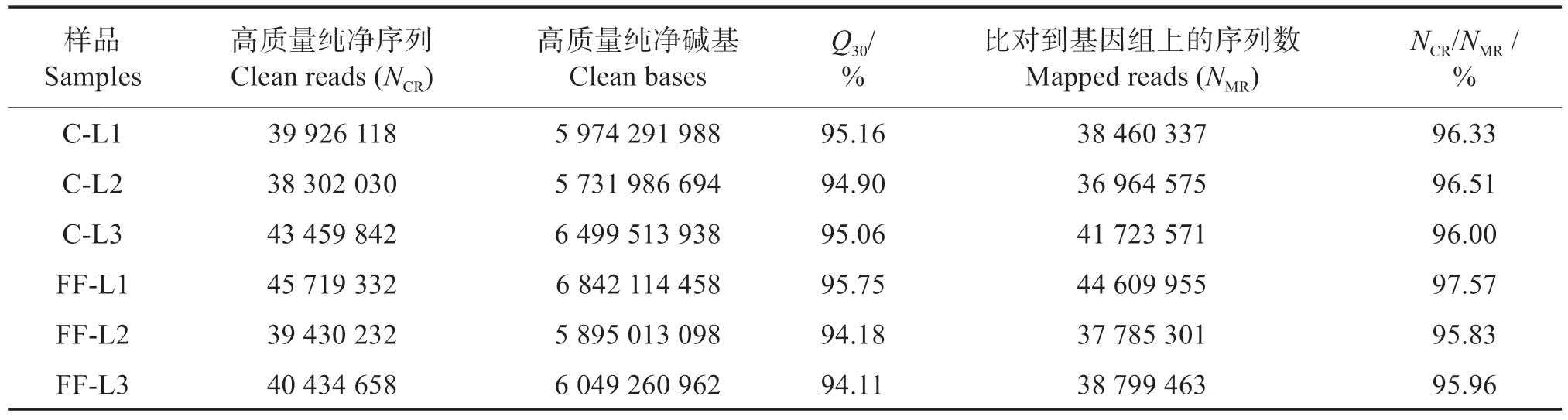
表6 测序数据质量和比对情况Table 6 Sequencing data quality and alignment
2.4 GO功能分析
对所得DEGs进行GO功能富集分析,共富集到28 个GO 条目,归类到GO 注释系统的生物学过程、分子功能和细胞组分等3 个主要分支。其中,有18个涉及代谢过程、细胞过程、生物调控等生物学过程;3 个涉及细胞解剖实体、细胞内、蛋白-含复合物等细胞组分;7 个涉及催化活性、结合、转运蛋白活性等分子功能(图2)。
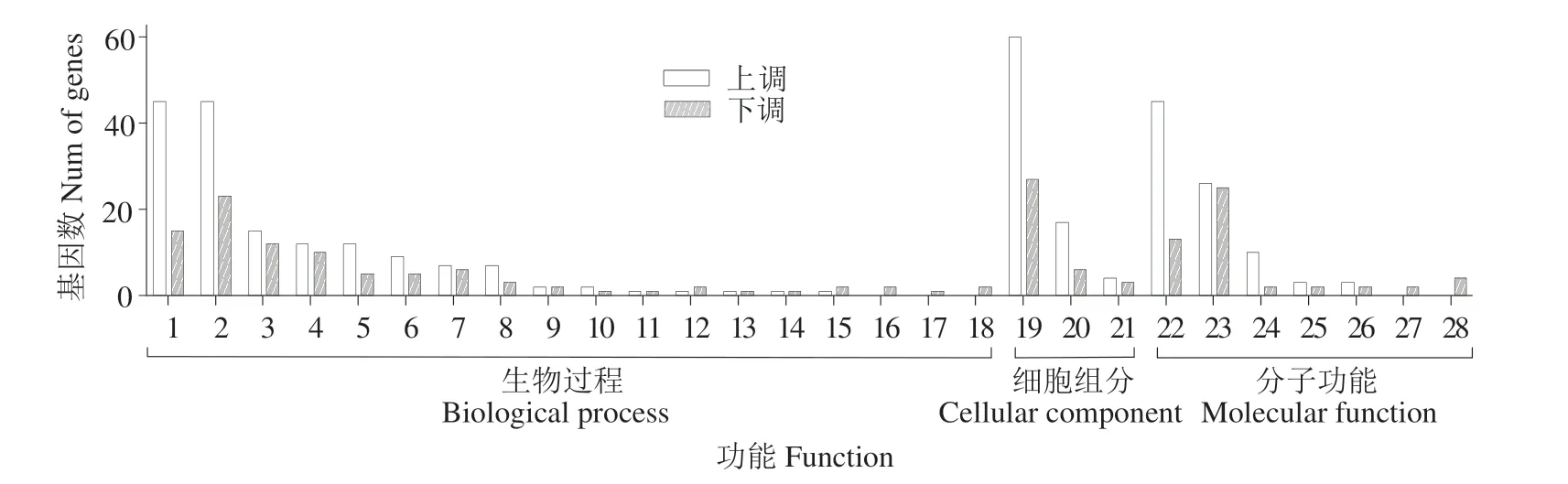
图2 差异表达基因的GO功能富集分析Fig.2 GO enrichment analysis of differential expression genes
2.5 KEGG富集分析
差异表达基因的KEGG 富集通路分析表明,共富集到79 个通路,主要包括甾体生物合成、萜类骨架生物合成、PPAR 信号通路、不饱和脂肪酸的代谢、脂肪酸代谢、胆固醇代谢、脂肪代谢等脂质合成与代谢通路(图3)。
2.6 肝脏组织生长、代谢相关基因表达
转录组结果(图4(A))显示:生长相关基因igf1和igf2的表达无显著差异(P>0.05),代谢相关基因lss、fdft1、soat2、acat2和hmgcra的表达显著上调,acsvl的表达显著下调(P<0.05)。RT-qPCR 结果(图4(B))与肝脏转录组结果相一致。
3 讨论
3.1 投喂配合饲料和冰鲜鱼对高体肝脏中生长相关基因表达的影响
GH-IGF 生长轴在鱼类生长调控方面发挥重要作用,一般认为,该系统通过垂体分泌gh,gh与相关受体结合,从而介导肝脏组织促进igf的合成与表达[10]。IGFs 具有促进有丝分裂、诱导细胞分化、调节生长等作用[11]。在硬骨鱼中,IGFs 的表达量与营养水平[12]、生长呈正相关。如大口黑鲈(Micropterus salmoides)[13]与大黄鱼(Larimichthys crocea)[14]在禁食实验中的生长均与肝脏中igf1表达量水平呈正相关;在饲料替代实验中,黄姑鱼(Nibea albiflora)[15]、银大马哈鱼(Oncorhynchus kisutchWalbaum,1792)[16]与日本鳗鲡(Anguilla japonica)[17]肝脏中igf1表达量水平与生长状况、营养水平均呈正相关;外源注射igf2的罗非鱼(Oreochromis)体质量远高于对照组[18]。本研究中,冰鲜鱼组和配合饲料组的终末体质量、增质量率、特定生长率及存活率等均无显著差异;冰鲜鱼组和配合饲料组igf1和igf2及相关受体基因的表达无显著差异(P>0.05)。差异表达基因KEGG富集分析表明,无生长相关信号通路被显著富集。可见,以饲料替代冰鲜鱼未对高体幼鱼的生长造成显著影响,这与尖吻鲈(Lates calcariferBloch,1790)、褐点石斑鱼(Epinephelus fuscoguttatus)[19]与中华绒鳌蟹(Eriocheir sinensis)[20]等其他水产动物饲料替代的结果相一致。这也证明了开发高体专用配合饲料以替代冰鲜鱼养殖的可行性。
3.2 投喂不同饵料对肝脏中代谢相关基因表达的影响
食物营养成分可影响鱼类的代谢功能。饲料脂肪源会影响杂交鲟(Acipenser baerii♀×Acipensersvhrenckii♂)幼鱼肝脏脂肪代谢酶活性,鱼油组和大豆油组肝脏脂肪代谢相关酶活性显著高于亚麻油组、菜籽油组和棕榈油组[21];饲料脂肪源显著影响大黄鱼肝脏甘油三酯脂肪酶和脂肪酸合成酶等脂质代谢酶活性,对肝脏中脂质代谢相关基因表达亦有显著影响[22];斜带石斑鱼(Epinephelus coioide)肝脏中肝酯酶、脂蛋白酯酶、脂肪酸合成酶及谷丙转氨酶等代谢酶活性明显受饲料蛋白质水平和淀粉水平的影响[23]。复合蛋白源过高水平替代鱼粉时会对中华绒鳌蟹的生理代谢产生不良影响[24]。本研究中,以配合饲料替代冰鲜鱼喂养60 d 后,高体幼鱼肝脏转录组KEGG 富集通路中显著富集了甾体生物合成、萜类骨架生物合成、PPAR 信号通路、不饱和脂肪酸的生物合成、脂肪酸代谢、甘油磷脂代谢、α-亚麻酸代谢、脂肪代谢、胆固醇代谢等脂质代谢通路;slc43a3基因表达下调,plin2基因表达上调。脂肪酸以酯化物或游离形式存在,与甘油合成甘油三酯储存于脂滴中;slc43a3是脂肪细胞摄取脂肪酸的负调节因子,slc43a3低表达会增强脂肪细胞摄取脂肪酸合成甘油三酯[25];plin2是肝脏中与脂质代谢相关的脂滴蛋白,plin2过表达会使脂滴形状变大,甘油三酯水平升高[26]。由此表明,配合饲料会促进脂滴合成,以储存甘油三酯。脂肪酸也参与胆固醇的生物合成。acat2参与将游离的胆固醇催化生成胆固醇酯,并将胆固醇酯与脂蛋白结合或储存到脂滴 中[27],acat2过表达会使idi1、fdft1、msmo1、cyp51a1以及dhcr7等参与胆固醇生物合成的基因表达上调[28],本研究转录组测序及qPCR 结果表明,acat2、fdft1表达显著上调;由此可见,投喂配合饲料会使高体幼鱼肝脏脂质代谢相关基因表达上调,而参与胆固醇合成与甘油三酯基因高表达也说明配合饲料中脂肪含量较高,易导致肝脏中有大量脂质堆积,从而导致脂肪肝。配合饲料对高体 肝脏的影响有待进一步研究。
