喉癌细胞外泌体miR-20a对肿瘤相关巨噬细胞增殖和凋亡的影响
杜 丽,袁耀宗,王 徽,高宏生
喉癌是常见的头颈部恶性肿瘤,在呼吸道恶性肿瘤中的发生率位居第二。早期的喉癌患者经过放疗、化疗、手术等治疗后生存情况有所改善,但是晚期患者的预后仍然较差[1,2]。研究指出,喉癌的发生发展与吸烟、饮酒、饮食等因素相关,但是其具体的发病机制尚不确定[3],所以需要完善调控喉癌发展的机制。外泌体是一类由多种活细胞分泌的纳米级囊泡,可在细胞间发挥信息传递的功能[4],其中,肿瘤细胞分泌的外泌体可在肿瘤微环境中调控巨噬细胞、中性粒细胞、成纤维细胞等基质细胞的功能,进而影响肿瘤的生长和转移[5,6]。在肿瘤微环境中,肿瘤相关巨噬细胞是重要的免疫细胞之一,可诱导肿瘤的生长和转移,靶向肿瘤相关巨噬细胞是肿瘤免疫治疗的重要路径[7],但是肿瘤细胞分泌的外泌体可通过分泌miRNA、DNA、蛋白质等多种内含物而促进肿瘤相关巨噬细胞的功能,进而实现免疫逃逸[8]。MiR-20a被发现在多种肿瘤外泌体中高表达,并调控肿瘤的病理进程,例如,Shi等[9]发现,外泌体miR-20a可抑制非小细胞肺癌的化疗敏感性,Moloudizargari等[10]发现,外泌体miR-20a可作为血液系统肿瘤诊断的标志物。但是,喉癌外泌体miR-20a是否能调控肿瘤相关巨噬细胞的功能尚无报道,由于肿瘤相关巨噬细胞的功能和表型与M2型巨噬细胞相似,所以M2型巨噬细胞常作为探究肿瘤相关巨噬细胞的体外模型[11]。本文探究了喉癌细胞外泌体miR-20a对M2型巨噬细胞增殖和凋亡的影响,旨在为喉癌的免疫治疗提供帮助。
1 材料与方法
1.1 材料 人单核细胞THP-1、支气管上皮细胞系16HBE,喉癌细胞系TU686、TU177、TU212购自中国典型培养物保藏中心,Trizol试剂和Lipofectamine 2000试剂盒购自赛默飞世尔科技有限公司,All-In-One 5X RT MasterMix试剂盒和BlasTaqTM2X qPCR MasterMix试剂盒购自爱必梦生物科技有限公司,CCK8试剂盒和细胞凋亡检测试剂盒购自沈阳万类生物科技有限公司,佛波酯(Phorbol 12-myristate 13-acetate,PMA)、白细胞介素4( Interleukin 4,IL-4)和 白细胞介素13( Interleukin 13,IL-13)购自美国 Sigma 公司,NF-κB、p-NF-κB、GAPDH、CD9、CD63、TSG101抗体、山羊抗兔IGg购自Cell Signaling Technology公司。
1.2 细胞培养与转染 16HBE、TU686、TU177、TU212培养于含10% 胎牛血清(fetal bovine serum, FBS)的RPMI-1640培养基中,细胞置于37 ℃,5%CO2的细胞培养箱中,细胞生长至汇合度达80%时进行细胞传代。取对数生长期的TU212 细胞使用Lipofectamine 2000试剂盒转染阴性对照和miR-20a 模拟物。
THP1细胞培养于含10% FBS的RPMI-1640培养基中,THP1细胞与10 ng/ml PMA共孵育24 h,诱导其极化为 M0 型巨噬细胞,M0 型巨噬细胞与20 ng/ml IL-4和20 ng/ml IL-13共孵育48 h,诱导其分化为 M2 型巨噬细胞。
1.3 外泌体的提取与鉴定 收集16HBE、TU686、TU177、TU212细胞,以及转染miR-20a 模拟物和阴性对照的TU212细胞培养上清,使用差速离心法提取外泌体(记为16HBE exo、TU686 exo、TU177 exo、TU212 exo、miR-NC exo、miR-20a exo),将细胞培养清液3000×g,4 ℃离心15 min去死细胞;取上清液6000×g 离心 40 min,取上清;10 000 ×g离心1 h,取上清;100×kg离心1 h,收集沉淀,用400 μl无菌 PBS 重悬外泌体,所得外泌体-80 ℃条件下保存。透射电镜下观察外泌体的结构,Western blot检测外泌体标志蛋白CD9、CD63、TSG101。
1.4 细胞分组 M2型巨噬细胞分为PBS组、16HBE exo组、TU686 exo组、TU177 exo组、TU212 exo组、miR-NC exo组、miR-20a exo组,即M2型巨噬细胞分别与PBS及10 ng/ml的16HBE exo、TU686 exo、TU177 exo、TU212 exo、miR-NC exo、miR-20a exo共孵育48 h。
1.5 实时荧光定量PCR检测miR-20a、Arg-1、CD206、iNOS和CD16表达 根据Trizol试剂盒提取各组细胞及外泌体中的总RNA,然后使用All-In-One 5X RT MasterMix试剂盒将总RNA反转录为cDNA,然后使用BlasTaqTM2X qPCR MasterMix试剂盒进行qRT-PCR反应,反应条件为:95 ℃ 3 min,1次循环;95 ℃ 15 s,60 ℃ 1 min,40次循环。记录CT值,以U6或GAPDH为内参,使用2-ΔΔCT法检测miR-20a、Arg-1、CD206、iNOS和CD16的相对表达量。引物序列如表1。

表1 miR-20a和U6的引物序列
1.6 CCK8法检测细胞增殖 将上述各组M2型巨噬细胞稀释至2×104个/ml,然后96孔板每孔接种100 μl,每组设置3个复孔,然后将96孔板放置于培养箱中培养,在0、24、48、72 h去除对应的96孔板,每孔加入10 μl的CCK8溶液,共孵育4 h后,使用酶标仪检测450 nm条件下各孔的吸光度值(OD值)。
1.7 流式细胞术检测细胞凋亡 取各组M2型巨噬细胞1×105个于流式管中,PBS溶液清洗后再用500 μl的Binding Buffer重悬,各组流式管中加入5 μl Annexin V-FITC和5 μl PI,并设置Annexin V-FITC和PI单独染色管,用于调光补偿,4 ℃避光染色15 min,使用流式细胞仪检测各组细胞凋亡率。
1.8 Western bloting检测各组M2型巨噬细胞及外泌体总蛋白 RIPA蛋白提取试剂盒提各组M2型巨噬细胞及外泌体总蛋白,蛋白定量后,取10 μg进行SDS-聚丙烯酰胺凝胶电泳1.5 h,使用湿法转膜将蛋白转移至PVDF膜,然后使用5%的脱脂牛奶封闭PVDF膜2 h,与p-PI3K、PI3K、p-AKT、AKT、GAPDH、CD9、CD63、TSG101(1∶1000稀释)一抗孵育过夜,与山羊抗兔IGg二抗(1∶5000稀释)室温孵育1.5 h,TBST洗膜后使用ECL试剂盒曝光拍照,用Image J软件对曝光结果进行定量分析。
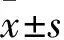
2 结 果
2.1 外泌体鉴定结果 本文所提取的16HBE exo、TU686 exo、TU177 exo、TU212 exo具有双层膜结构,粒径为30~100 nm,形态呈“杯托”样。并且16HBE exo、TU686 exo、TU177 exo、TU212 exo均表达外泌体标志蛋白CD9、CD63、TSG101(图1)。

图1 喉癌细胞外泌体结构及标志物鉴定
2.2 M2型巨噬细胞诱导结果 qRT-PCR检测结果显示,M0+IL-4+IL-13组细胞M2型巨噬细胞标志蛋白Arg-1(5.45±0.62)高于M0+PBS组(1.00±0.00)(t=12.39,P<0.001),CD206(3.90±0.71)表达水平亦高于M0+PBS组(1.00±0.00)(t=7.09,P<0.01)。M0+IL-4+IL-13组细胞M1型巨噬细胞标志蛋白iNOS表达(0.11±0.05)显著低于M0+PBS组(1.00±0.00)(t=30.74,P<0.001),CD16表达(0.12±0.04)亦显著低于M0+PBS组(1.00±0.00)(t=43.57,P<0.001),说明M0细胞使用IL-4和IL-13诱导后可显著促进M2型巨噬细胞的极化,所得M2型巨噬细胞用于后续研究。
2.3 喉癌细胞外泌体调控M2型巨噬细胞的增殖与凋亡 CCK8检测结果显示,相比于PBS组,TU686 exo组、TU177 exo组、TU212 exo组M2型巨噬细胞在24、48、72 h的OD值显著增加(P均<0.05),而16HBE exo组M2型巨噬细胞OD值无显著变化(表2)。细胞凋亡检测结果(图2)显示,TU686 exo组(9.67%±1.53%)、TU177 exo组(8.67%±2.08%)、TU212 exo组(4.00%±1.00%)M2型巨噬细胞凋亡率显著低于PBS组(21.67%±4.72%)(t=4.19、4.36、6.33,P均<0.01),16HBE exo组(19.67%±4.16%)M2型巨噬细胞凋亡率无显著变化(t=0.55)。

图2 喉癌细胞外泌体对M2型巨噬细胞凋亡的影响

表2 各组喉癌细胞M2型巨噬细胞OD值比较
2.4 miR-20a高表达于喉癌细胞及外泌体 qRT-PCR检测结果显示,喉癌细胞TU686(3.18±0.56)、TU177(4.23±0.27)、TU212(5.24±0.27)中miR-20a表达显著高于PBS组(1.00±0.00)(t=6.73、20.55、27.34,P<0.01),TU212中miR-20a表达最高。TU686 exo(3.25±0.25)、TU177 exo(3.63±0.28)、TU212 exo(4.30±0.31)中miR-20a表达显著高于16HBE exo(1.00±0.00)(t=15.31、16.50、18.57,P<0.001)。在TU212中转染miR-20a 模拟物以及阴性对照后,并收集外泌体(miR-20a exo和miR-NC exo),相比于miR-NC exo(1.00±0.00),miR-20a exo中miR-20a表达(5.12±0.57)显著上调(t=12.50,P<0.001)。
2.5 外泌体miR-20a影响M2型巨噬细胞的增殖和凋亡 CCK8检测结果显示(表3),相比于miR-NC exo组,miR-20a exo组M2型巨噬细胞在24、48、72 h的OD值显著增加(P<0.01)。细胞凋亡检测结果(图3)显示,相比于miR-NC exo组(14.33%±1.53%),miR-20a exo组M2型巨噬细胞凋亡率(8.33%±1.52%)显著降低(t=4.81,P=0.0086)。

图3 流式细胞术检测各组喉癌细胞凋亡率

表3 各组喉癌细胞M2型巨噬细胞OD值比较
2.6 外泌体miR-20a激活M2型巨噬细胞PI3K/AKT信号通路 Western blot检测结果(图4,表4)显示,相比于PBS组,TU686 exo组、TU177 exo组和TU212 exo组M2型巨噬细胞中PI3K和AKT磷酸化水平均显著增高(P<0.001),16HBE exo组细胞中PI3K和AKT磷酸化水平与PBS组无显著差异。相比于miR-NC exo组,miR-20a exo组M2型巨噬细胞中PI3K和AKT磷酸化水平均显著增高(P<0.001)。

图4 Western blot 检测各组喉癌细胞中PI3K

表4 各组喉癌细胞PI3K和AKT磷酸化水平比较
3 讨 论
外泌体是粒径为30~100 nm的微囊泡,内含包括miRNA、lncRNA、mRNA、DNA等多种遗传物质,其多数内含物具有作为肿瘤诊断和治疗标志物的前景[12],其中miRNA是一类研究较为广泛的外泌体内含物,外泌体miRNA可调控肿瘤的生长、转移、血管新生、免疫逃逸等多种病理进程[13,14]。Yu等[15]研究表明,肿瘤外泌体miR-15-5p可增强喉癌细胞的生长和转移。血清外泌体miR-941可作为喉癌诊断的重要标志物[16]。本研究发现miR-20a在喉癌细胞及喉癌细胞分泌外泌体中显著高表达。Xu等[17]发现,miR-20a可调控肿瘤相关巨噬细胞的功能。本文即探究了喉癌细胞外泌体中miR-20a对肿瘤相关巨噬细胞的影响及机制。
肿瘤微环境是一个复杂的系统,由多种基质细胞组成,包括肿瘤干细胞、血管内皮细胞及免疫细胞等。巨噬细胞通常分为M1和M2两种表型,其中M1型巨噬细胞具有抗肿瘤的作用,而M2型巨噬细胞能够促进肿瘤的生长和转移[18],肿瘤相关巨噬细胞是肿瘤微环境中的重要免疫细胞,其功能以及表型与M2型巨噬细胞相似,可促进肿瘤的生长和转移[19]。因此,在体外研究中可以使用M2型巨噬细胞作为肿瘤相关巨噬细胞的研究模型。M2型产生促肿瘤作用,依赖IL-4/IL-13或免疫复合物激活,分泌组织蛋白酶和丝氨酸蛋白酶等破坏内皮细胞的基底层,促使肿瘤细胞迁移[20]。本文首先利用IL-4和IL-13的诱导获得M2型巨噬细胞,然后将喉癌细胞外泌体与M2型巨噬细胞共孵育,发现喉癌细胞外泌体可促进M2型巨噬细胞的增殖,以及抑制M2型巨噬细胞的凋亡,所以推测喉癌外泌体具有调控肿瘤相关巨噬细胞增殖和凋亡的功能。Su等[21]发现,肿瘤相关巨噬细胞的激活可促进喉癌的淋巴管生成, Guo等[22]发现,肿瘤相关巨噬细胞的激活可促进喉癌细胞化疗敏感性,所以,我们也推测喉癌外泌体激活的肿瘤相关巨噬细胞可促进喉癌的发生发展。
miRNA是重要的外泌体内含物,肠癌外泌体miR-934可促进M2型巨噬细胞极化[23],膀胱癌外泌体miR-21可激活肿瘤相关巨噬细胞[24]。本研究发现喉癌细胞以及其外泌体中miR-20a均高表达,并且发现喉癌外泌体miR-20a可促进M2型巨噬细胞的增殖,抑制M2型巨噬细胞的凋亡。PI3K/AKT信号通路是经典的胞内信号通路,其下游的基因如Nf-kB、VEGF、FOXO等,多是促增殖抑凋亡的因子[25],本研究发现,喉癌细胞外泌体以及外泌体miR-20a可促进M2型巨噬细胞中PI3K和AKT的磷酸化,即PI3K/AKT信号通路激活,所以推测,喉癌外泌体可激活PI3K/AKT信号通路而调控M2型巨噬细胞的增殖和凋亡。
综上所述,喉癌细胞外泌体miR-20a可促进M2型巨噬细胞的增殖,抑制凋亡,其机制可能为激活PI3K/AKT信号通路,但是miR-20a是通过靶向何种靶基因而发挥的调控作用还需进一步探究,并且外泌体miR-20a是否可作为喉癌诊断和治疗的新靶点也需进一步探究。

