菊粉调控 NF-κB 信号抑制细胞凋亡减轻小鼠炎症性肠病的研究
王蕤兰,王月兴,杨 健,邓丽娟
炎症性肠病(inflammatory bowel disease,IBD)是一种慢性复发性炎症性疾病,包括克罗恩病和溃疡性结肠炎,其发病机制仍不清楚,可能的病理机制包括免疫反应失调、细胞炎症因子产生异常、肠上皮屏障功能受损和肠道菌群紊乱[1]。IBD主要临床症状包括腹痛、腹泻、黏液脓血便等,此外还可能出现关节炎、口腔溃疡、巩膜炎和结节性红斑等胃肠道之外的症状[2]。IBD目前主要治疗原则是对症治疗,延缓病程发展,必要时进行手术切除,主要用药包括氨基水杨酸盐、皮质类固醇、免疫调节剂和生物制剂等[3]。肠上皮细胞凋亡和炎症反应在IBD的发生发展中至关重要,因此可能成为干预疾病的有效靶点。
菊粉是一种可溶性的膳食纤维,研究表明,菊粉可以调节肠道菌群组成结构,使双歧杆菌明显增加,厌氧菌和乳酸菌的相对丰度增加,拟杆菌的相对丰度减少[4]。菊粉可维持肠道稳态,缓解消化系统疾病症状,调节脂质代谢,降低血糖,抑制炎症因子表达,降低结肠癌风险,增强矿物质吸收,缓解便秘,调节高尿酸血症等[5-7]。研究发现,菊粉通过调节细胞凋亡和抗氧化发挥器官保护作用[8],也通过抑制肿瘤坏死因子-α(tumor necrosis factor-α,TNF-α)、白细胞介素-1β(interleukin-1β,IL-1β)、白细胞介素-6(interleukin-6,IL-6)等炎症因子释放和抑制核因子κB(nuclear factor kappa-B,NF-κB)蛋白通路来消除机体炎症[9],但是菊粉对IBD的影响和作用机制尚不明确。本研究通过2.5%葡聚糖硫酸钠(dextran sulfate sodium,DSS)诱导IBD小鼠模型,探讨菊粉对IBD小鼠的影响,深入挖掘其潜在的作用机制,为IBD治疗提供新的思路。
1 材料与方法
1.1 材料和主要试剂 40只雄性7~8周C57BL/6小鼠,体重20~24 g,饲养于温度、湿度恒定的动物房内,光暗循环12 h,小鼠自由活动、进食。菊粉(Sigma-Aldrich);DSS (Sigma-Aldrich);Trizol(Absin);反转录试剂盒(Thermo Fisher);TNF-α、IL-1β、IL-6、GADPH引物由上海生工生物合成;Bcl-2、Bax、cleaved caspase-3、NF-κB和GADPH抗体(CST)。
1.2 方法
1.2.1 实验分组 40只实验小鼠随机分为正常对照组、菊粉对照组、模型组和菊粉治疗组,每组10只。菊粉对照组和菊粉治疗组提前灌胃500 mg/kg菊粉干预14 d,每日一次,正常对照组和模型组每天灌胃0.9%氯化钠注射液,在干预第8天时开始造模,称量小鼠体重作为初始质量,模型组和菊粉治疗组通过饮用7 d 2.5% DSS溶液诱导IBD模型,正常对照组和菊粉对照组饮用蒸馏水,14 d后处死小鼠进行分析。
1.2.2 DAI评分 从使用DSS诱导IBD模型开始,每日对小鼠的体重、粪便黏稠度、是否便血进行记录,按照DAI评分细则进行评分,这三项指标的平均分即为疾病活动指数(disease activity index,DAI)评分。(1)体质量减轻:无,0分;1%~5%,1分;6%~10%,2分;11%~15%,3分;>15%,4分。(2)粪便黏稠度:良好颗粒,0分;不会黏附于肛门糊状粪便,2分;黏附于肛门的稀便,4分。(3)是否便血:无,0分;隐血试验阳性,2分;肉眼血便4分。
1.2.3 结肠检查 (1)结肠长度测量:小鼠麻醉后,打开腹腔寻找到结肠与盲肠的交界处,分离结肠到直肠,将其剪断,4 ℃的0.9%氯化钠注射液冲洗表面的粪便,然后测量结肠长度。(2)病理学检查:取下小鼠结肠组织4%多聚甲醛进行固定,脱水、透明、包埋等步骤后,对小鼠结肠组织进行切片,用苏木精和伊红进行染色,显微镜下观察结肠组织结构的改变。
1.2.4 实时荧光定量PCR 取下小鼠结肠组织后迅速置于液氮进行保存,使用Trizol法提取结肠组织RNA,根据反转录试剂盒操作将RNA反转录成相应的cDNA,加入TNF-α、IL-1β、IL-6、GADPH对应的引物[10]、结肠cDNA、SYBR qpcr Master Mix以及无菌无酶水组成10μl体系在PCR仪设置程序中进行反应,测定各组小鼠TNF-α、IL-1β、IL-6的荧光强度,通过2-ΔΔCt法进行计算(表1)。

表1 引物序列
1.2.5 蛋白质印记法检测 分离结肠组织后,用0.9%氯化钠注射液进行洗涤2次,裂解组织后进行提取蛋白,在100 ℃水中煮沸蛋白使其变性,加样,进行聚丙烯酰胺凝胶电泳,电泳完后进行转膜2 h,将蛋白转移到PVDF膜上,用5%牛奶进行封闭,与Bcl-2、Bax、cleaved caspase-3、NF-κB和GADPH的一抗进行孵育,4 ℃过夜。次日,洗膜3次后,室温孵育相应二抗2 h,洗膜3次后进行ECL发光显影,以GADPH作为内参进行归一化处理,计算不同条带的灰度比值。
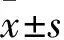
2 结 果
2.1 小鼠一般情况和DAI评分 正常对照组和菊粉对照组在实验期间未出现腹泻、血便现象,并随着实验进展,该两组小鼠体质量稍有增加,两组的DAI评分无统计学差异,精神状态良好,活动自如。相比于正常对照组,模型组在造模第3天出现明显血便和腹泻现象,体质量/初始质量下降,DAI评分增加[0vs.(3.72±0.31),P<0.05],精神萎靡,活动明显减少。与模型组相比,菊粉治疗组小鼠造模第5天血便和腹泻现象明显缓解,体重量/初始质量有所恢复,DAI评分降低[(3.81±0.25)vs.(1.78±0.18),P<0.05],精神状态良好,活动增加,使用菊粉治疗改善了IBD症状(表2,表3)。

表2 各组小鼠DAI评分

表3 各组小鼠体质量/初始质量变化
2.2 小鼠结肠长度 与正常对照组相比,菊粉对照组中小鼠结肠长度无明显差异[(8.21±0.32)vs.(8.31±0.22),P>0.05],模型组小鼠的结肠长度明显缩短[(8.21±0.32)vs.(6.61±0.33),P<0.05]。
与模型组相比,菊粉治疗组小鼠结肠长度有所增加[(6.61±0.33)vs.(7.06±0.31),P<0.05],说明经菊粉治疗干预后,小鼠症状有所改善(图1)。

图1 各组小鼠治疗后结肠长度比较
2.3 小鼠结肠组织病理学 与正常对照组相比,模型组的结肠黏膜明显受损,黏膜结构被破坏,绒毛排列明显紊乱,炎症细胞浸润增多,菊粉对照组与正常对照组在病理组织学二者无明显差异。与模型组相比,菊粉治疗组结肠病理结构明显改善,病变减轻,黏膜破坏减少,绒毛排列稍整齐,炎症细胞浸润也减少(图2)。
2.4 结肠组织TNF-α、IL-1β、IL-6的mRNA 与正常对照组相比,模型组TNF-α、IL-1β、IL-6的mRNA表达水平明显上调(P<0.05),菊粉对照组无统计学差异(P>0.05)。与模型组相比,菊粉治疗组的TNF-α、IL-1β、IL-6的mRNA表达水平下降(P<0.05;表4)。

表4 各组小鼠结肠组织TNF-α、IL-1β、IL-6的mRNA水平
2.5 结肠组织细胞凋亡相关蛋白和NF-κB蛋白表达 WB结果显示,与正常对照组相比,模型组小鼠结肠组织Bcl-2蛋白表达下降,Bax、cleaved caspase-3和NF-κB蛋白表达明显增加(P<0.05),菊粉对照组小鼠各蛋白表达无统计学差异(P>0.05)。与模型组相比较,菊粉治疗组增加Bcl-2蛋白表达,减少Bax、cleaved caspase-3和NF-κB蛋白表达(P<0.05;图3,表5)。

图3 各组小鼠结肠组织细胞凋亡相关蛋白

表5 各组小鼠结肠组织细胞凋亡相关蛋白和NF-κB蛋白表达
3 讨 论
IBD是一种病因不明的肠道疾病,其中,NF-κB通路、肠道炎症和肠道细胞凋亡在IBD中发挥重要作用。菊粉可增强机体的免疫功能和肠道屏障功能,具有抗炎、抗氧化、抗细胞凋亡功能。本研究发现使用菊粉进行干预治疗可抑制IBD小鼠肠道炎症,改善小鼠肠道组织病理,减少肠道细胞的凋亡,抑制NF-κB蛋白表达,单独使用菊粉对小鼠并无不良影响。本研究推测菊粉可能通过抑制NF-κB信号通路进而减少细胞凋亡与抑制炎症反应来缓解IBD小鼠的症状。
DSS是一种高度水溶性的化合物,在小鼠的饮用水中短期给予DSS会诱导高度急性炎症,该炎症仅限于结肠,其特征为糜烂溃疡、隐窝消失和炎症细胞浸润[11]。该模型操作简单可重复性强,且炎症反应明显,DSS诱导的症状和组织学特征与人类IBD中的特征相似,为本研究提供了稳定的实验模型。这种由化学药物诱发的动物模型与自发性基因小鼠模型存在一定区别,前者更加偏向后天环境的因素影响,而后者更偏向于研究遗传因素影响[12]。本研究建立DSS模型小鼠表现与之前研究一致,在DSS给药后3~5 d出现明显血便与体重下降,精神萎靡、活动能力下降、腹泻、眼屎增多,结肠变薄缩短,肠上皮出现糜烂溃疡,病理切片显示隐窝消失、炎症细胞浸润增多等,说明使用2.5% DSS自由喂养小鼠可诱发IBD症状,成功建立实验模型。
炎症反应在IBD的发生发展中起到了重要的推动作用,其中TNF-α、IL-6、IL-1β在肠道炎症的诱导和维持中发挥重要作用。TNF-α是IBD发病机制中的关键因素,在DSS诱导的IBD中高度上调,与其受体TNFR1和TNFR2结合发挥作用,可诱导细胞凋亡,促进细胞因子产生,敲除TNFR2会减轻结肠炎的严重程度,减少促炎细胞因子的产生,细胞凋亡减少,而敲除TNFR1会导致相反的结果[13]。在目前IBD治疗中,TNF-α是一个关键的治疗靶点,通过使用抗TNF-α单克隆抗体阻断TNF-α信号可以显著抑制IBD炎症并促进肠黏膜愈合[14]。TNF-α在促进炎症方面也起着重要作用,促进IL-6、IL-1β的产生和释放,扩大炎症级联反应[15]。IL-6通过与其可溶性IL-6受体结合发挥促炎作用,有研究证明使用抗IL-6受体单克隆抗体可以阻断黏附分子表达进而抑制白细胞募集来缓解小鼠结肠炎[16]。IL-1β是一种促炎细胞因子,可增加抗原呈递并增加促炎细胞因子的释放,从而加重肠道黏膜炎症。菊粉在肠道中发挥重要的抗炎作用,调节肠道菌群,增强肠上皮屏障功能。本研究中DSS诱导IBD小鼠模型中,小鼠肠组织的TNF-α、IL-6、IL-1β的mRNA水平显著增高,使用菊粉治疗后,肠组织炎症因子的水平下降,炎症反应缓解,再次证明菊粉在肠道炎症中发挥了重要的抗炎作用。因此,本实验可能通过抗炎功能来保护IBD小鼠。
此外,肠道上皮细胞的完整性在肠道保护中占据着重要作用,肠道上皮的屏障功能有赖于肠道上皮细胞的完整性。肠道上皮细胞的凋亡与增殖处在一种动态平衡中进而保证细胞的更新和正常的功能,一旦凋亡过度会造成屏障功能受损,导致细菌从管腔进入肠壁甚至血液造成败血症并引发炎症级联反应,这也是IBD发病机制之一[17]。IBD患者肠黏膜中TNF-α表达增加,会诱导肠上皮细胞凋亡[18]。菊粉在抗细胞凋亡方面也发挥重要作用,菊粉可通过抑制甲氨蝶呤造成的肝细胞过度凋亡从而改善肝功能,可减少心脏细胞凋亡进而降低2型糖尿病中心脏并发症的发生率[19],也可减少肠道细胞凋亡。在本研究中,DSS诱导IBD小鼠肠道细胞凋亡增多,Bax、cleaved caspase-3蛋白表达明显增加,Bcl-2蛋白表达下降,经过菊粉治疗后,肠道的细胞凋亡被抑制,Bax、cleaved caspase-3蛋白表达明显减少,Bcl-2蛋白表达增加,说明菊粉可通过抗细胞凋亡来缓解IBD症状。
NF-κB的激活与IBD中免疫反应激活相关,通过抑制NF-κB可抑制结肠炎的发生发展,表明了NF-κB在炎症诱导和病程发生发展的重要作用[20]。肠上皮细胞中NF-κB通路的稳态对于维持肠上皮完整性和肠道的免疫稳态至关重要。NF-κB在IBD患者中被显著诱导激活,特别是在巨噬细胞和肠上皮细胞中,从而促进肠黏膜炎症反应[21]。NF-κB也是介导炎症反应重要的转录因子,可促进下游炎症因子和黏附分子的释放。此外,NF-κB可诱导下游TNF-α的释放,反过来TNF-α能够进一步增强NF-κB的激活,形成正反馈级联放大机制。菊粉可通过抑制TLR4/NF-κB通路激活调节肠道微生物来减轻炎症反应,并且菊粉不被肠道消化吸收,可直接到达结肠段被菌群分解代谢从而发挥局部调节优势。在本研究的DSS诱导小鼠模型中,检测到NF-κB蛋白表达量明显增加,这与之前的研究是一致的,使用菊粉干预后,可降低NF-κB的表达,由此推测菊粉可通过抑制NF-κB进而减少细胞凋亡和抑制炎症反应来发挥肠道保护作用。
本研究为临床治疗IBD提供了新的思路和方向,扩展了菊粉应用的适应证,为未来IBD的治疗奠定了一定理论基础。但是本研究目前局限在实验动物身上,尚未进行临床试验,结论能否应用于临床还需要进一步的论证与实践。

