基于转录组分析的SlCMT4 基因敲除对番茄花器官的影响
郭绪虎,李凤,刘丽珍,弓晏婉
(山西大同大学 农学与生命科学学院,山西 大同 037009)
DNA 甲基化在基因印记、基因组稳定性、发育过程调控以及逆境胁迫响应中发挥关键作用[1-2]。DNA 甲基化主要由植物中的DNA 甲基转移酶催化,包括甲基转移酶1(MET1)、染色质甲基化酶(CMTs)、域重排甲基转移酶(DRMs)以及DNA 甲基 转 移 酶2(DNMT2)[3]。其 中,MET1 参 与 维 持CG 甲基化。研究发现在反义MET1拟南芥植株中观察到多效性的表型,例如植株变小、叶片大小和形状改变、顶端优势降低、开花时间改变和生育力下降[4-5]。MET1和CMT3的功能障碍导致拟南芥胚活力降低、细胞分裂数量改变[6]。通过表达反义NtMET1载体,在烟草转基因株系中检测到CG 序列中DNA 的低甲基化[7]。基因组DNA 甲基化水平显著降低的NtMET1转基因植株表现出严重的形态缺陷,包括节间变短、叶片变小和花器官形态异常[7]。在CRISPR-Cas9 基 因 编 辑 产 生 的 番 茄slmet1突变体中也观察到明显的发育缺陷,比如缺陷的花序、小而卷曲的叶片以及单性结实[8]。
CMTs 和DRMs 介导CHG 和CHH(H=A/C/T)的 甲 基 化[9]。Moritoh 等[10]的 研 究 揭 示 了 水 稻OsDRM2的靶向破坏在不同的生长发育阶段表现出一系列发育表型,如生长缺陷、半矮化、分蘖数量减少、抽穗延迟或不抽穗、异常圆锥花序和小穗形态,以及完全不育。然而,在拟南芥的drm2突变体中没有观察到发育缺陷。玉米DRM2功能缺失突变体dmt103,在繁殖阶段种子形态表现出严重的发育缺陷,而在营养发育阶段没有形态变化[11]。此外,水稻甲基转移酶基因OsTSD2的T-DNA 插入植株表现出矮化等一系列变化[12]。Bartee 等[13]报道了pai1C251Y 背景下的拟南芥cmt3突变体表现出发育改变。这些变化包括幼苗期荧光强度明显降低,成苗期荧光强度部分降低,植株大小增加,株数减少,育性增加。Cao 和Jacobsen[14]发现cmt3单突变体和drm1、drm2双突变体均无形态缺陷,但drm1、drm2、cmt3三突变在植株发育中表现出多效性的改变。Chen 等[15]研究表明,在番茄突变体中通过病毒诱导的基因沉默(VIGS)抑制CMT3基因的表达,结果诱导CNR的表达并引发表观突变体的果实成熟。SlMET1、SlDRM7和SlCMT2病毒诱导的基因沉默对Cnr番茄突变体成熟过程具有类似影响。此 外,Fieldes 等[16]研 究 表 明 用5-azaC(5-azacytidine,一种甲基化抑制剂)处理亚麻后,甲基化水平降低,开花时间提前。病毒诱导的本氏烟草NbCMT3/3-2基因的沉默在植株形态上表现出多效性,这表明其在发育中不可或缺。沉默NbCMT3/3-2对茎和根的发育具有多效性[17]。
近年来,DNA 甲基转移酶基因在植物发育、转录调控和代谢途径控制中的重要性日益得到认可。目前,关于番茄花器官形成相关转录因子的研究报道较多,但从表观遗传学,尤其是DNA 甲基化方面阐明番茄花器官调控机制的研究报道较少。番茄花器官形成发育的表观遗传调控机制尚不清楚。前期研究表明,我们克隆的番茄DNA 甲基转移酶基因SlCMT4(Solyc08g005400.2)在花器官和未成熟青果实中高表达,但在叶片发育和果实成熟过程中表达下降[18]。为了研究番茄SlCMT4基因功能,本研究应用CRISPR-Cas9 介导的基因敲除产生了SlCMT4的靶向突变,SlCMT4 是负责从头和非CG甲基化的DNA 甲基转移酶,此外,我们从形态和转录组水平上分析了SlCMT4突变株系。本研究加深了我们对SlCMT4在番茄不同器官发育过程中功能的认识,具有重要的理论意义。
1 材料和方法
1.1 植物材料和生长条件
在本研究中,我们选择经典番茄栽培品种Ailsa Craig(AC++)作为野生型(wild type,WT)。植株在标准温室条件下(16 h/8 h 昼/夜循环、25 °C/18 °C昼/夜温度、80%湿度和250 μmol·m-2·s-1光强度)进行培养。当番茄开花时开始做标记,根据开花后天数(DPA)和果实颜色,野生型番茄果实成熟被分为IMG、MG、B、B4 和B7 五个时期。其中,开花后20 d 的果实被定义为未成熟的青果(IMG)。开花后35 d 的果实被定义为成熟的青果(MG),其特征是果实为绿色、有光泽,没有明显的颜色变化。开花后38 d 的果实被定义为破色期果实(B),其果实颜色从绿色转变为黄色。另外还使用了破色后4 d(B4)和破色后7 d(B7)的果实。采收果实样品后立即用液氮冷冻并储存于-80 °C 冰箱以备使用。
1.2 番茄SlCMT4 基因表达特性的研究
从野生型番茄(AC++)和突变体(Rin、Nr)不同发育时期果实中提取总RNA,以SlCMT4基因特 异 片 段 设 计 引 物(F:5′-CTTGGCACAAAACTCTCTGGTC-3′,R:5′-TTCTCAACACCTTCATTCCTAACAT-3′),采 用荧光实时定量PCR 技术,研究SlCMT4基因在番茄不同果实发育时期的表达模式。
1.3 SlCMT4 基因敲除载体构建及遗传转化
利用CRISPR-Cas9 筛选2 个靶向番茄SlCMT4的特异性sgRNA。包含扩增gRNA-U6 片段的寡聚体与CRISPR-Cas-BGK012-DSG 载体(15 250 bp)相 连。使 用 农 杆 菌 将 得 到 的BGK012-DSG-SlCMT4载体转化到野生型番茄中。从转化植株的幼叶中提取基因组DNA,并使用靶位点两侧的引物(F:5′-AATTAGCTCTGTTTTACCCTCAA-3′,R:5′-CTGCTTCCTCACACTTTTCTCTG-3′)进 行PCR 扩 增。对PCR 产物通过测序来鉴定突变。2 个靶向位点位于SlCMT4基因的第1 个外显子上。从T0 代转基因植株中共获得了6 个卡那霉素抗性株系。通过CRISPR-Cas9 基因编辑和测序技术,我们获得了4 个突变株系CR-01、CR-02、CR-08、CR-09,其中CR-08 和CR-09 株系出现明显的表型变化,因此,将这2个株系作为主要研究对象[19]。
1.4 RNA 提取、文库构建及测序
使用RNAprep 纯化植物试剂盒从野生型和SlCMT4突变株系中提取番茄花器官的总RNA。使用NanoDrop 2000 测量RNA 浓度和纯度。使用Agilent Bioanalyzer 2100 系统的RNA Nano 6000 Assay Kit 评 估RNA 完 整 性。共 用1 μg 纯 化 的mRNA 构建cDNA 文库。在Illumina平台上对文库制备进行测序,并生成配对末端读数。对野生型和SlCMT4突变体进行了3个生物重复。
1.5 转录组数据质控和比较分析
我们收集了野生型和SlCMT4突变株系花器官样本。用于转录组测序所有样品都具有3 个生物学重复。fastq 格式的原始数据(原始读取)首先通过内部perl 脚本进行处理,以从原始数据中删除包含适配器的读取、包含ploy-N 的读取和低质量的读取。同时计算Clean Data 的Q20、Q30、GC 含量和序列重复水平。所有下游分析均基于高质量的Clean Data。然后使 用HISAT2 和StringTie 将这些Clean Reads 匹配到番茄基因组版本SL4.0 和注释版本ITAG4.0。只有完全匹配或1 个不匹配的读数被保留来计算表达量。
1.6 基因表达水平定量和差异表达基因分析
基因表达水平通过每千碱基转录本的片段数/百万匹配的片段(FPKM,fragments per kilobase of transcript per million mapped reads)来量化,公式如下:FPKM=cDNA 片段/[匹配片段(百万)×转录物长度(kb)]。使用DESeq2 对野生型和突变株系进行差异表达分析[20]。使用Benjamini 和Hochberg控制错误发现率(FDR)的方法调整得到的P值。P值<0.05,以及1.5 倍或更大表达变化的基因被指定为差异表达基因。
1.7 差异表达基因功能注释和富集分析
用于DEG 功能注释的数据库包括GO(Gene Ontology)、KO(KEGG Ortholog database)、COG(Clusters of Orthologous Groups of proteins)、Pfam(the database of homologous protein families)、nr(NCBI non-redundant protein sequences)等。差异表达基因(DEG)的基因本体论(GO)富集分析由基于Wallenius 非中心超几何分布的GOseq R 包进行[21]。KOBAS 软件用于测试KEGG 通路中差异表达基因的统计富集。
1.8 统计分析方法
采用Excel整理数据、GraphPad Prism 6 进行统计分析并作图,每个数值代表3 个生物重复的平均值±SD。使用t检验比较野生型和SlCMT4突变株系之间差异显著性,检验标准α=0.05。从野生型和CR-08 株系中采集花器官样本,进行比较转录组分析,将3 个生物学重复的Pearson 相关系数r(Pearson′s Correlation Coefficient)作为生物学重复相关性的评估指标,其越接近1,说明2 个重复样品相关性越强。
2 结果与分析
2.1 SlCMT4 基因在野生型和突变体番茄植株中的表达模式
研究表明番茄DNA 甲基转移酶基因SlCMT4在番茄花器官和青果时期表达水平相对较高,在番茄其它器官及果实成熟期表达水平较低[18]。本研究使用qPCR 进一步研究了该基因在突变体番茄(Nr和Rin)不同果实发育阶段的表达模式,发现Sl-CMT4基因在番茄成熟突变体Nr和Rin果实中,该基因的表达水平显著高于野生型番茄AC++(图1),这些结果表明SlCMT4可能在番茄花器官和果实发育过程中发挥重要作用。

图1 基于qPCR 的SlCMT4 在野生型(AC++)和突变体(Nr 和Rin)番茄果实不同发育阶段中的相对表达模式Fig.1 Expression profiles of SlCMT4 in different fruit developmental stages in wild-type and mutant (Nr and Rin)tomato
2.2 CRISPR-Cas9 介导的SlCMT4 基因敲除影响番茄花器官形态
为了深入研究SlCMT4的功能,我们通过CRISPR-Cas9 技术获得了SlCMT4突变株系(CR-08)。在番茄SlCMT4突变株系的花器官中,观察到一系列表型变化,包括雄蕊外翻卷曲、雌蕊变短变粗(图2)。

图2 番茄花器官Fig.2 Tomato flower organ
2.3 转录组测序
去除含有接头的低质量序列以及污染读数后,在 野 生 型 文 库(WT-1、WT-2 和WT-3)中 获 得22.70 Gb高质量Clean bases,突变体文库(CR08-1、CR08-2 和CR08-3)中 获 得22.81 Gb 的 高 质 量Clean bases(表1)。使用番茄基因组版本SL4.0,对于野生型文库,匹配的Clean Reads为42.42~47.32百万(94.99%~95.29% 匹配;91.85%~92.12%唯一匹配),对于突变体文库,匹配的Clean Reads为39.70~50.27 百 万(92.45%~95.58% 匹 配;89.60%~92.57%唯一匹配;表2)。

表1 番茄6 个花器官样品的转录组测序数据的特征Table 1 Characteristics of the RNA-sequencing data obtained from analysis of six floral organ samples of tomato

表2 番茄6 个花器官样品RNA 测序Clean Reads 的匹配结果Table 2 Mapping results of RNA-seq clean reads from obtained from analysis of six floral organ samples
2.4 SlCMT4 突变株系花器官中的差异表达基因
我们从野生型和CR-08 株系中采集花器官样本,进行比较转录组分析。由3 个生物学重复的Pearson 相关系数,可得转录组数据是可靠的(图3A)。6 个样品(PCA)的主成分分析表明野生型和CR-08 株系存在2 个水平的基因表达(图3B)。我们关注在CR-08 株系的花器官样品中差异表达的基因。使用差异倍数FC1.5 倍,错误发生率FDR<0.01 作为差异表达基因的筛选条件(图3C)。我们鉴定了1398 个差异表达基因,其中512 个上调,886个下调(图3D)。
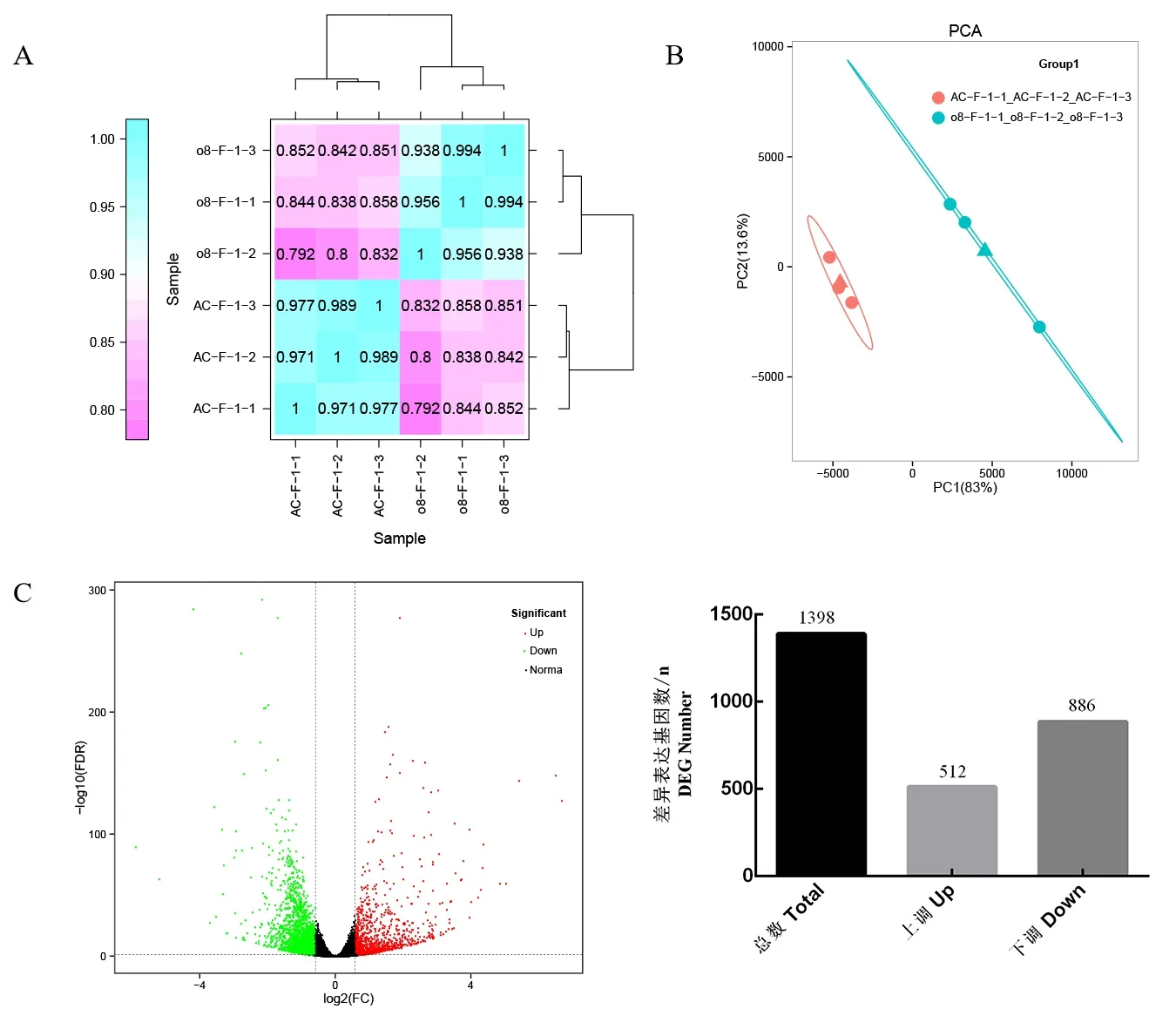
图3 野生型和SLCMT4T 突变株系(CR-08)株系番茄花器官转录组分析概述Fig.3 Overview of tomato floral organs transcriptome in WT and CR-08 lines
2.5 差异基因富集分析
对于差异表达基因,我们使用基于Wallenius非中心超几何分布的GOseq R 包对DEG 进行了基因本体论(GO)富集分析[21]。图4 表明,与重要生物过程相关的GO 条目在SlCMT4突变株系中富集,包括生长、细胞杀伤。细胞组分,如细胞膜、胞外区、大分子复合物等也得到了富集。分子功能富集包括分子功能调控、结构分子活性、转录因子活性和养分储库活性。COG 数据库对基因功能和同源性进行分类的结果表明,大多数差异表达基因与碳水化合物转运和代谢、信号转导机制、脂质转运和代谢、次级代谢物生物合成,转运和分解代谢等有关(图5)。

图4 差异表达基因(DEGs)的基因本体(GO)富集分析Fig.4 GO enrichment analysis of DEGs

图5 COG 数据库对差异表达基因的功能和同源性进行分类Fig.5 COG database to classify the differentially expressed genes function and homology
本研究还进行了KEGG 通路分析,以进一步为DEG 的功能分类提供信息。差异表达基因的KEGG 分析结果表明,大多数DEG 被归类为以下功能通路:1)代谢,包括淀粉和蔗糖代谢、戊糖和葡萄糖醛酸转换、氨基糖和核苷酸糖代谢、苯丙烷生物合成等;2)环境信息处理,包括植物激素信号转导;3)细胞过程包括内吞作用;4)有机体系统包括植物病原菌互作(图6)。DEGs 表达上调的KEGG 途径主要包括苯丙烷生物合成、淀粉和蔗糖代谢、氨基糖和核苷酸糖代谢、玉米素生物合成(图7A)。相反,DEGs表达下调的KEGG 途径主要包括植株-病原菌互作、淀粉和蔗糖代谢、内吞作用以及戊糖和葡萄糖醛酸盐相互转化(图7B)。上述结果表明,SlCMT4可能调控花器官发育相关基因的表达,导致番茄中这些基因的表达上调或下调。富集分析表明,SlCMT4对番茄花器官发育过程具有明显影响。

图6 差异表达基因的KEGG 通路分析Fig.6 KEGG pathway analysis of the differentially expressed genes functional categorization

图7 富集差异表达基因的KEGG 通路分析Fig.7 KEGG pathway analysis of differentially expressed genes enriched
2.6 SlCMT4 突变株系差异表达基因的转录水平
以野生型和CR-08 株系花器官为材料,采用转录组测序技术研究差异表达基因的转录水平。基于转录组测序,发现在CR-08 株系中生长素响应基因IAA29、花粉类受体蛋白激酶基因LePRK2、木葡聚糖内转葡萄糖酶水解酶基因LeXTH3均显著下调,乙烯生物合成相关基因LeACS2、细胞分裂素代谢相关基因SlCKX7显著上调(图8)。其中,LeACS2和SlCKX7在突变株系CR-08 花器官中分别上调了约9倍和8倍。

图8 基于转录组数据的差异表达基因的FPKM 值Fig.8 FPKM values of the differentially expressed gene (DEG)based on RNA-seq data
2.7 SlCMT4突变植株中富集的差异表达转录因子
转录因子是在基因转录调控中起关键作用的DNA 结合蛋白。本研究发现GO 条目转录因子活性显著富集在SlCMT4突变植株中(图5)。番茄花器官中的许多转录因子对SlCMT4基因的突变作出响应,关于上调或下调的反应不同(表3)。根据PlantTFDB[22]分类为8 个家族的169 个番茄转录因子在响应SlCMT4的突变时差异表达,包括AP2、NAC、MYB、WRKY、bHLH、bZIP、C2H2 和MADS-box。其中,88 个转录因子基因上调,81 个下调。
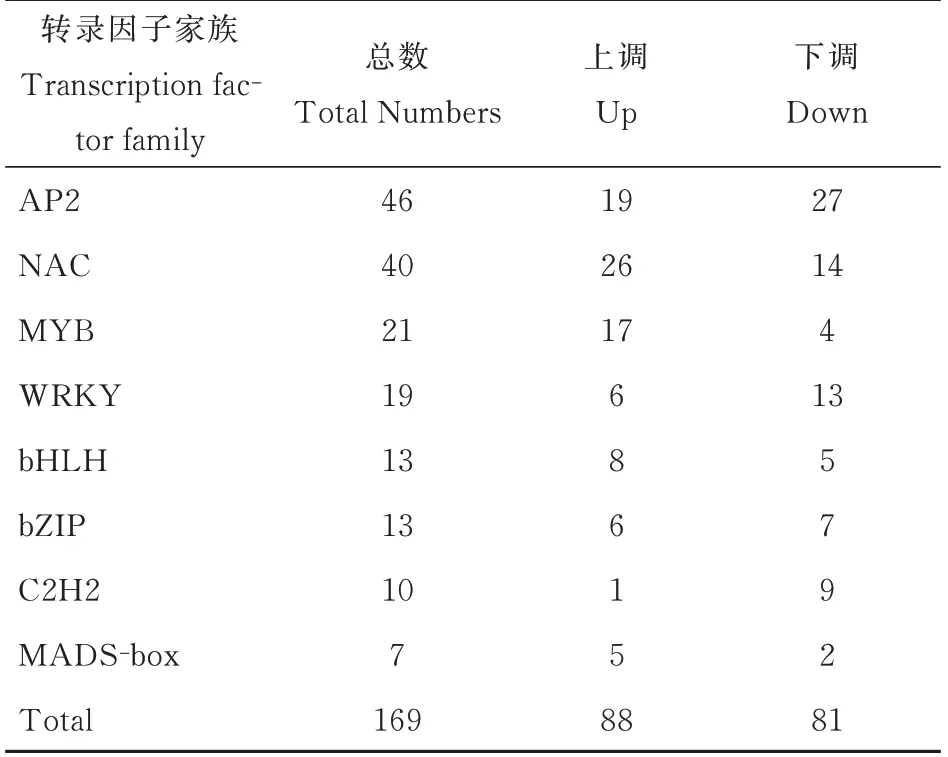
表3 野生型和SlCMT4 突变体花器官之间差异表达的转录因子Table 3 Differentially expressed transcription factors between WT and SlCMT4 mutant in floral organs
3 讨论
DNA 甲基化在调控植物的许多发育途径中起着重要作用。在本研究中,我们发现SlCMT4在番茄成熟突变体Nr和Rin果实中的表达水平显著高于野生型番茄AC++,表明SlCMT4基因的表达可能受激素乙烯信号和成熟相关转录因子RIN 的负调控,推测突变体番茄Nr和Rin果实不能正常成熟,部分原因可能与这些突变体的SlCMT4基因高水平表达,导致许多成熟相关基因启动子被SlCMT4高度甲基化而降低表达水平有关。
在前期研究中,项目组构建了SlCMT4基因的CRISPR-Cas9 载体,转化了野生型番茄,并筛选了SlCMT4基因的突变体。基于突变株系的表型,从多层次水平表征了SlCMT4基因的一些可能功能。研究结果表明SlCMT4基因的突变引起番茄植株形态和繁殖器官的变化。其中,CRISPR-Cas9 介导的SlCMT4敲除严重影响了番茄花器官的形态和结构,包括有缺陷和外翻的雄蕊,以及短而粗的雌蕊[19]。上述研究并没有从转录组水平深入挖掘其分子机理。在本研究中,进行了比较转录组分析,以深入了解SlCMT4调控番茄花器官发育的分子机制。我们确定了SlCMT4突变后番茄花器官的转录组学响应。使用RNA-seq 在SlCMT4突变植株的番茄花器官中鉴定了1398 个差异表达基因,其中下调的差异表达基因数量高于上调的差异表达基因。差异表达基因的KEGG 分析结果表明,大多数DEG 被归类为植物激素信号转导、苯丙烷生物合成、淀粉和蔗糖代谢、氨基糖和核苷酸糖代谢、玉米素生物合成等功能代谢通路。参与生长素激活信号通路与木葡聚糖代谢过程的基因下调表达较多,乙烯生物合成与细胞分裂素代谢过程的基因上调表达较多,这些代谢途径可能在番茄花器官形成和发育过程中发挥了重要的作用。基于转录组测序分析,我们发现在突变株系CR-08 中参与生长素激活信号通路基因IAA29、花粉受体激酶基因LePRK2、木葡聚糖代谢过程基因LeXTH3均显著下调,乙烯生物合成基因LeACS2、细胞分裂素代谢相关基因SlCKX7显著上调。这些结果表明SlCMT4是参与番茄花器官发育过程的重要调控因子。
转录因子在植物生长、代谢以及繁殖器官发育、成熟和衰老等过程中发挥重要作用[23-29]。在本研究中,鉴定了几种响应SlCMT4突变的差异表达转录因子,包括NAC、MYB、AP2、bHLH、WRKY、bZIP、MADS-box 等,这表明SlCMT4基因可能直接或间接调控这些转录因子基因的表达。
4 结论
SlCMT4基因在番茄果实成熟突变体Nr和Rin中的表达水平显著高于野生型,表明SlCMT4基因的表达可能受激素乙烯信号和成熟相关转录因子RIN 的负调控。基于CRISPR-Cas9 介导的突变株系的表型,本研究从形态学和转录组水平研究了SlCMT4基因的调控功能。结果发现SlCMT4突变株系出现严重的花器官发育缺陷,这表明DNA的低甲基化会导致植物发育异常。本研究增加了我们对SlCMT4甲基转移酶基因在番茄不同发育过程中功能的理解,对阐明SlCMT4基因的功能具有重要的理论意义。

