球孢白僵菌真菌病毒BbPmV-4外壳蛋白多克隆抗体制备及应用
郭文博 路杨 隋丽 赵宇 邹晓威 张正坤 李启云,3
(1. 吉林省农业科学院植物保护研究所 吉林省农业微生物重点实验室 农业农村部东北作物有害生物综合治理重点实验室,长春 130033;2. 吉林农业大学植物保护学院,长春 130118;3. 吉林农业科技学院,吉林 132101)
球孢白僵菌(Beauveria bassiana)是一种重要的昆虫病原真菌,因其具有杀虫谱广、对人畜无害、杀虫机制多样、害虫不易产生抗药性等优点,已被广泛用于农林害虫的生物防治[1]。但由于球孢白僵菌自身遗传背景的多样性,及在继代培养过程中毒力退化造成的高毒力菌种筛选困难,限制了其进一步应用[2]。高毒力菌株的创制主要以野生菌株筛选为主,但其筛选周期长,并且保存和应用过程中的菌种退化造成了资源浪费;而基因工程育种由于受到环境安全因素的影响,尚不能广泛应用[3-4]。
真菌病毒是影响寄主真菌的致病力和生物学性状的重要因素之一[5]。目前真菌病毒感染造成寄主致病力降低是在植物病原真菌中广泛研究的主要现象,已经有多个利用真菌病毒防治植物病原真菌造成病害的先例[6-11]。而对于昆虫病原真菌,则需提高其毒力。目前已有研究表明,真菌病毒有助于提高生防真菌的生防能力[12-14]。Kotta‑Loizou等[15]从球孢白僵菌中分离到两株真菌病毒Beauveria bassiana polymycovirus‑1(BbPmV‑1)和Beauveria bassiana non‑segmented virus 1(BbNV‑1),生物学实验表明,这两种病毒能够增加寄主的生物量,并且提高对大蜡螟(Galleria mellonella)的毒力。作者研究团队于2021年从田间亚洲玉米螟僵虫上分离纯化得到的球孢白僵菌中,鉴定出了一株新的双链RNA真菌病毒,该病毒为产多聚真菌病毒Beauveria bassiana polymycovirus 4(BbPmV‑4),能提高球孢白僵菌对寄主的毒力,促进菌株生长[16],并能通过共培养实现病毒在球孢白僵菌种内和种间水平传播和垂直传播。由此可见,可以将真菌病毒用于球孢白僵菌高毒力菌株的创制。然而,真菌病毒在寄主中复制和传播机制尚不明确。
目前,真菌病毒与寄主互作机理主要是利用转录组筛选病毒与寄主互作通路和关键基因,且主要集中于植物病原真菌。例如,在多核灰霉菌(Botryosphaeria dothidea)中,携带病毒BdCV1和BdPV1的菌株与无病毒株差异基因的变化明显,GO富集涉及代谢过程、细胞过程、催化活性、转运蛋白活性、信号转导和其他生物途径。KEGG功能分析表明,丰富的差异表达基因参与了代谢、转录、信号转导和ABC转运[17]。在核盘菌中,共有958个mRNA受病毒hypovirus2‑L的影响,其中有100多个基因参与基本代谢及糖和脂质的运输[18]。作者团队前期利用转录组学,明确了BbPmV‑4与寄主互作过程中关键通路和基因,寄主被病毒感染后,一些丝裂原活化蛋白激酶(MAPK)、细胞色素P450(CYP450)和聚酮合酶(PKS)编码基因显著上调[19]。因此,为了进一步明确病毒和寄主互作机理,蛋白质水平的研究极其重要,特异性的真菌病毒抗体可为其提供实验材料。同时,血清学技术是检测动植物病毒的常规技术,通过制备病毒外壳蛋白单克隆或多克隆抗体,对病毒进行检测、定位及病毒与寄主互作机制研究[20-22]。然而,目前真菌病毒检测方法主要为RT‑PCR扩增,血清学检测体系尚不成熟。
本研究对BbPmV‑4病毒外壳蛋白进行原核表达,并制备多克隆抗体,利用血清学检测方法进行病毒检测,在寄主球孢白僵菌胞内和胞外的定位,深入研究真菌病毒在球孢白僵菌中的复制情况,并为真菌病毒的实验室诊断及病毒感染真菌细胞中的定位和动态分布提供技术支持。在未来可借助血清学方法,对球孢白僵菌中的真菌病毒进行快速检测,丰富球孢白僵菌中真菌病毒检测的方法,并在实际应用中进行推广。
1 材料与方法
1.1 材料
1.1.1 菌株、病毒和实验动物 本研究使用球孢白僵菌菌株BbOFJY,真菌病毒是本团队于2018年从采自吉林省靖宇县(42°06′ N,126°30′ E)采集的亚洲玉米螟(Ostrinia furnacalis)僵虫中分离得到,保存于中国微生物菌种保藏中心(菌种保藏号:CGMCC No. 22429);球孢白僵菌无毒健康菌株BbOFDH1‑5(GenBank登录号:PRJNA178080),保存于中国农业微生物菌种保藏中心(菌种保藏号为:ACCC No.32726)。
以上菌株均保存于20%(体积分数)甘油溶液中,使用前需将其涂布在马铃薯葡萄糖琼脂(PDA)培养基中,26℃培养5 d对菌株进行活化。
日本大耳兔:购自于辽宁长生生物技术股份有限公司。
1.1.2 主要试剂和仪器 限制性内切酶QuickCut Xho I和QuickCut BamH I、DNA片段纯化回收试剂盒、Gel Extraction Kit、E. coli DH5α和E. coli BL21(DE3)感受态细胞均购自生工生物(上海)股份有限公司;原核表达载体pET‑28a(+)为本实验室保存;SDS‑PAGE 凝胶制备试剂盒购自上海雅酶生物医药科技有限公司;Ni Bestarose FF(Fast Flow)金属螯合层析介质购自博格隆(上海)生物技术有限公司;截流分子量15 kD蛋白超滤离心管购自密理博(中国)有限公司;BCA Protein Quantification Kit‑BOX购自南京诺唯赞生物科技股份有限公司;丝状真菌总蛋白提取试剂盒购自北京百奥莱博科技有限公司。激光共聚焦显微镜(Leica SP8)为Leica徕卡公司产品。
1.2 方法
1.2.1 引物设计与合成 根据本实验室分离鉴定的BbPmV‑4双链RNA病毒ORF4上的外壳蛋白基因序列BbPmV‑4‑CP(GenBank登录号:MW385788),设计带有Xho I和BamH I酶切位点的特异性引物,具体见表1。引物委托生工生物工程(上海)股份有限公司合成。
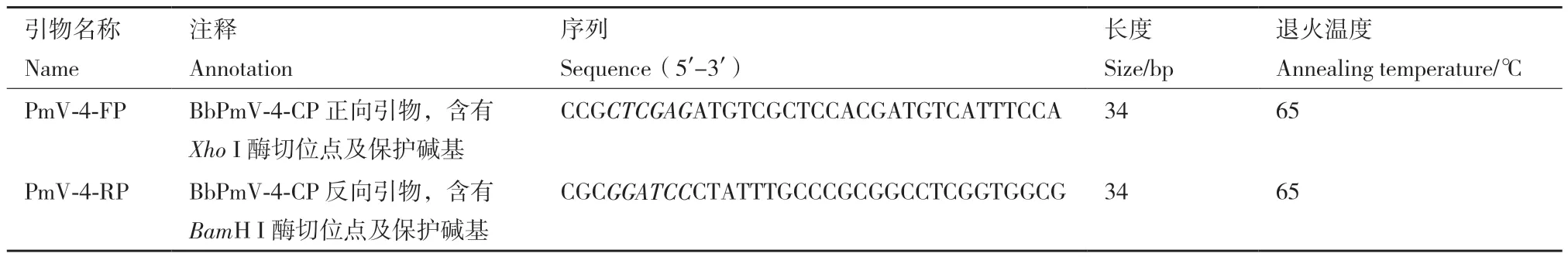
表1 引物信息Table 1 Quote sequence information
1.2.2 外壳蛋白基因的扩增 采用常规dsRNA提取法提取球孢白僵菌菌株BbOFJY的dsRNA,反转录后利用特异性引物通过PCR反应扩增BbPmV‑4‑CP基因。PCR反应程序:98℃预变性30 s;98℃变性10 s,58℃退火15 s,72℃延伸20 s,共25个循环;72℃延伸2 min,于4℃保存。利用胶回收试剂盒纯化回收大小在798 bp的目的条带,送交生工生物工程(上海)股份有限公司测序。
1.2.3 重组原核表达载体的构建与鉴定 利用Xho I和BamH I对扩增得到的BbPmV‑4‑CP和原核表达载体pET‑28a(+)进行双酶切,酶切产物经过回收后与T4 DNA连接酶连接,4℃过夜。将连接产物转化至E. coli DH5α感受态细胞,挑选菌落PCR阳性克隆,过夜培养。采用质粒提取试剂盒提取阳性克隆质粒并送交生工生物工程(上海)股份有限公司进行测序验证。
1.2.4 重组质粒的诱导表达 取1 μL pET‑28a(+)∷BbPmV‑4‑CP质粒转化至E. coli BL21(DE3)感受态细胞中,挑取单菌落至含有50 μg/mL硫酸卡那霉素的LB液体培养基中进行活化,次日转接进行扩大培养,37℃,180 r/min,3 h后加入0.4 mmol/L IPTG,25℃诱导过夜。
1.2.5 重组蛋白的纯化与鉴定 采用Ni2+亲和层析对过表达的BbPmV‑4‑CP蛋白进行纯化,采用超滤浓缩管对纯化得到重组蛋白进行脱盐处理及浓缩,然后进行SDS‑PAGE检测。采用BCA蛋白定量试剂盒测定纯化得到的BbPmV‑4‑CP蛋白浓度。
1.2.6 多克隆抗体的制备及效价测定 取纯化后的BbPmV‑4‑CP蛋白与等体积的弗氏完全佐剂乳化对日本大耳兔进行首次免疫,免疫剂量为1 mg/只,免疫方式为颈背部三点皮下及大腿肌肉两点注射。每隔7 d进行加强免疫,共加强免疫4次;加强免疫时,将纯化得到的BbPmV‑4‑CP蛋白与等体积的弗氏不完全佐剂混匀乳化,免疫剂量为0.5 mg/只。免疫结束7 d后,对日本大耳兔进行心脏采血,收集血清,置于37℃培养箱30 min后,4℃放置过夜,4 000 r/min离心。相关动物实验方案已遵守相关实验动物福利规定,获得吉林大学第一医院动物伦理委员会批准,伦理审批号(2022年)临审第(124)号。
以200 ng/100 μL将纯化得到的BbPmV‑4‑CP蛋白包被96孔酶标板,4℃过夜,5%脱脂奶粉溶液37℃封闭2 h。取倍比稀释的BbPmV‑4‑CP蛋白多克隆抗体(1∶500-1∶256 000),37℃孵育1 h,100 μL/孔,每个稀释度3次重复;加入HRP标记山羊抗兔IgG(1∶5 000),37℃孵育1 h;加入TMB底物溶液,避光反应5 min。加入终止液终止反应,利用酶标仪测定OD450值,分析数据,实验进行3次重复。
1.2.7 克隆抗体Western blot检测 采用丝状真菌蛋白提取试剂盒提取含病毒BbPmV‑4菌株BbOFJY的总蛋白后,分别收集细胞上清液及蛋白裂解液,将样品变性处理后进行SDS‑PAGE分离,然后转移至PVDF膜上,5%脱脂奶粉溶液室温封闭2 h。按1∶5 000比例加入BbPmV‑4‑CP蛋白多克隆抗体,37℃孵育1 h。按照1∶6 000比例加入HRP标记的山羊抗兔IgG,37℃孵育1 h;最后采用DAB(20×)显色试剂盒避光反应5-10 min,使用Western blot蛋白印迹成像仪曝光成像。
1.2.8 间接ELISA病毒含量检测 利用ELISA方法对含有病毒BbPmV‑4的BbOFJY菌株进行病毒含量检测。检测样品为SDY液体培养的BbOFJY菌液上清及菌体沉淀。以纯化BbPmV‑4‑CP蛋白为阳性对照,SDY液体培养基为阴性对照,去离子水为空白对照。
从培养7 d的培养皿上挑取BbOFJY菌丝接种至SDY液体培养基中,26℃ 180 r/min培养。2 d后收集100 mL菌液,12 000 r/min离心,弃上清,PBS缓冲液重悬菌体,12 000 r/min离心15 min,分别收集上清液与沉淀,放入液氮中反复冻融3次后置于冰上,采用超声波破碎仪功率40 W超声15 min;离心取上清为包被液,后续采用间接ELISA检测方法进行检测。
1.2.9 球孢白僵菌原生质体制备及间接免疫荧光分析 BbOFJY原生质体制备:刮取PDA中培养7 d的球孢白僵菌菌丝,接入200 mL新鲜的SDY液体培养基中,26℃ 180 r/min培养48 h;12 000 r/min离心管收集菌液;0.7 mol/L NaCl溶液洗涤菌体2次;加入5 mL 0.01 mol/L β-巯基乙醇重悬菌体,30℃水浴20 min;12 000 r/min,15 min离心后弃上清,0.7 mol/L NaCl洗涤2次。加入5 mL 0.7 mol/L NaCl为渗透压稳定剂配制的真菌溶壁酶酶液(6.0 mg/mL)中,30℃水浴1.5 h,4 000 r/min,4℃离心10 min;加入0.7 mol/L NaCl,将制备的原生质体洗涤2次,最后将细胞悬浮于0.7 mol/L NaCl中。
间接免疫荧光分析:向制备的BbOFJY菌株原生质体中加入500 μL 4%多聚甲醛,固定30 min;4 000 r/min,15 min去除多聚甲醛,PBS缓冲液清洗3次;5%脱脂奶37℃封闭1 h;一抗为1∶5 000稀释的阴性兔血清、阳性血清(BbPmV‑4‑CP多抗),37℃孵育1 h;二抗为FITC标记的山羊抗兔IgG(1∶6 000),37℃避光孵育1 h;DAPI染色液避光染色10 min,然后在激光共聚焦显微镜下进行观察,激发波长:495 nm,发射波长:425 nm。以首次免疫前采集的兔血清为阴性对照。
2 结果
2.1 重组表达载体的构建
琼脂糖凝胶电泳检测结果表明,BPmV‑4‑CP扩增产物长度约为800 bp,结果与预期798 bp相符(图1‑A)。对胶回收得到目的基因BPmV‑4‑CP进行Xho I和BamH I双酶切处理,与经过相同处理的表达载体pET‑28a(+)进行连接(图1‑B),转化至E. coli DH5α感受态细胞中,对重组表达质粒pET‑28a(+)∷BbPmV‑4进行测序鉴定。
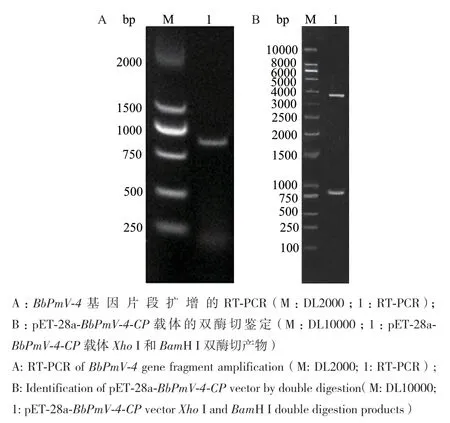
图1 BbPmV-4基因片段的PCR扩增及重组质粒鉴定Fig. 1 PCR amplification of BbPmV-4 gene fragment and the identification of the recombinant plasmid
2.2 目的蛋白表达形式鉴定
将测序验证正确的重组表达载体转化至表达菌株E. coli BL21(DE3)中进行IPTG诱导表达后,SDS‑PAGE结果(图2)显示,在相对分子质量约为30 kD处有蛋白大量表达,均存在于细胞破碎上清液及沉淀液中。
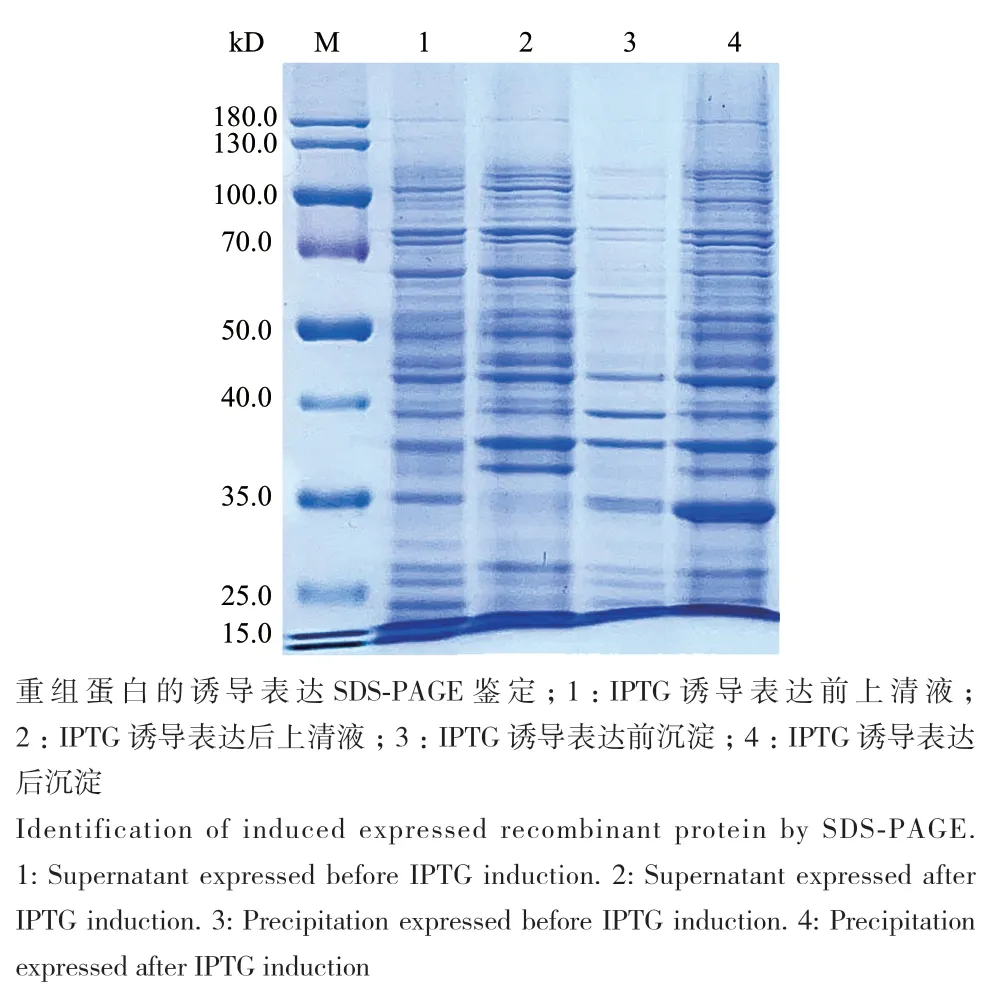
图2 目的蛋白BbPmV-4-CP表达鉴定Fig. 2 Expression and identification of target protein BbPmV-4-CP
2.3 BbPmV‑4‑CP蛋白纯化
SDS‑PAGE分析Ni‑NTA镍柱纯化后带有His标签的BbPmV‑4蛋白(图3‑A),进行6×His标签Western blot检测(图3‑B),及在蛋白作为抗原进行动物免疫前,采用超滤管进行浓缩以及脱盐处理SDS‑PAGE检测(图3‑C),分子量均符合预期大小。BCA浓度测定得到BbPmV‑4‑CP蛋白浓度为4.04 mg/mL。
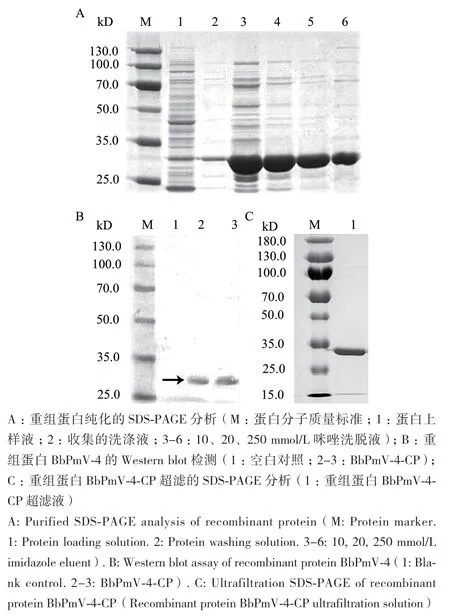
图3 重组蛋白BbPmV-4-CP的纯化与鉴定Fig. 3 Purification and identification of the recombinant protein BbPmV-4-CP
结果显示,纯化后的多抗效价达到1∶256 000以上,表明纯化后的BbPmV‑4‑CP蛋白作为抗原免疫日本大耳兔获得的多克隆抗体具有较高灵敏度(图4)。
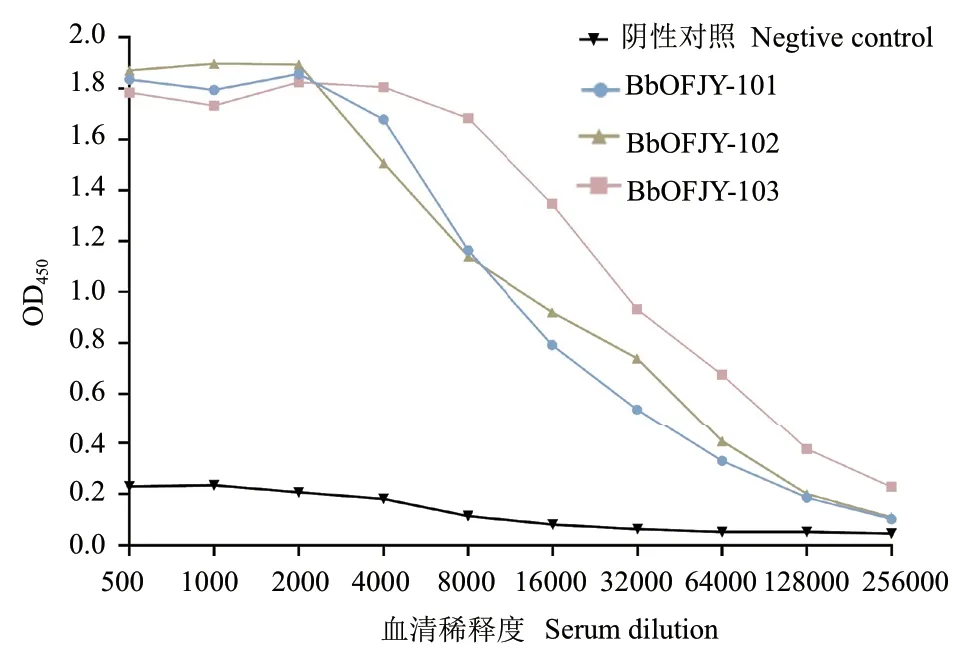
图4 间接ELISA法检测效价Fig. 4 Titer detected by indirect ELISA
2.4 抗体特异性检测
Western blot检测BbPmV‑4‑CP蛋白及含病毒BbPmV‑4的球孢白僵菌,在膜上25 kD附近呈现清晰的特异性结合条带,表明制备的BbPmV‑4‑CP多克隆抗体能够特异性识别BbPmV‑4‑CP蛋白及寄主球孢白僵菌,且具有较好的免疫活性及特异性,可用于感染BbPmV‑4病毒球孢白僵菌的血清学鉴定(图5)。
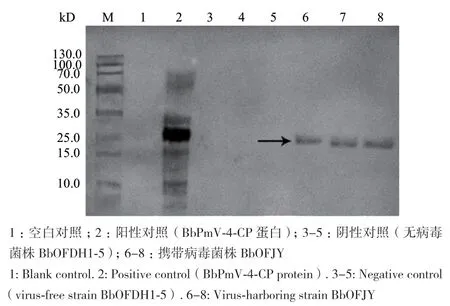
图5 BbPmV-4-CP抗体特异性检测结果Fig. 5 Specificity detection of for the antibody of BbPmV-4-CP
2.5 间接ELISA病毒检测
使用间接ELISA方法对含有BbPmV‑4病毒的菌株进行病毒含量检测。菌液上清及沉淀的间接ELISA检测结果均为阳性(P≥2.1)(图6‑A),表明在菌液病毒BbPmV‑4上清及沉淀中均存在,且可复制表达并游离至菌液上清中(图6‑B)。
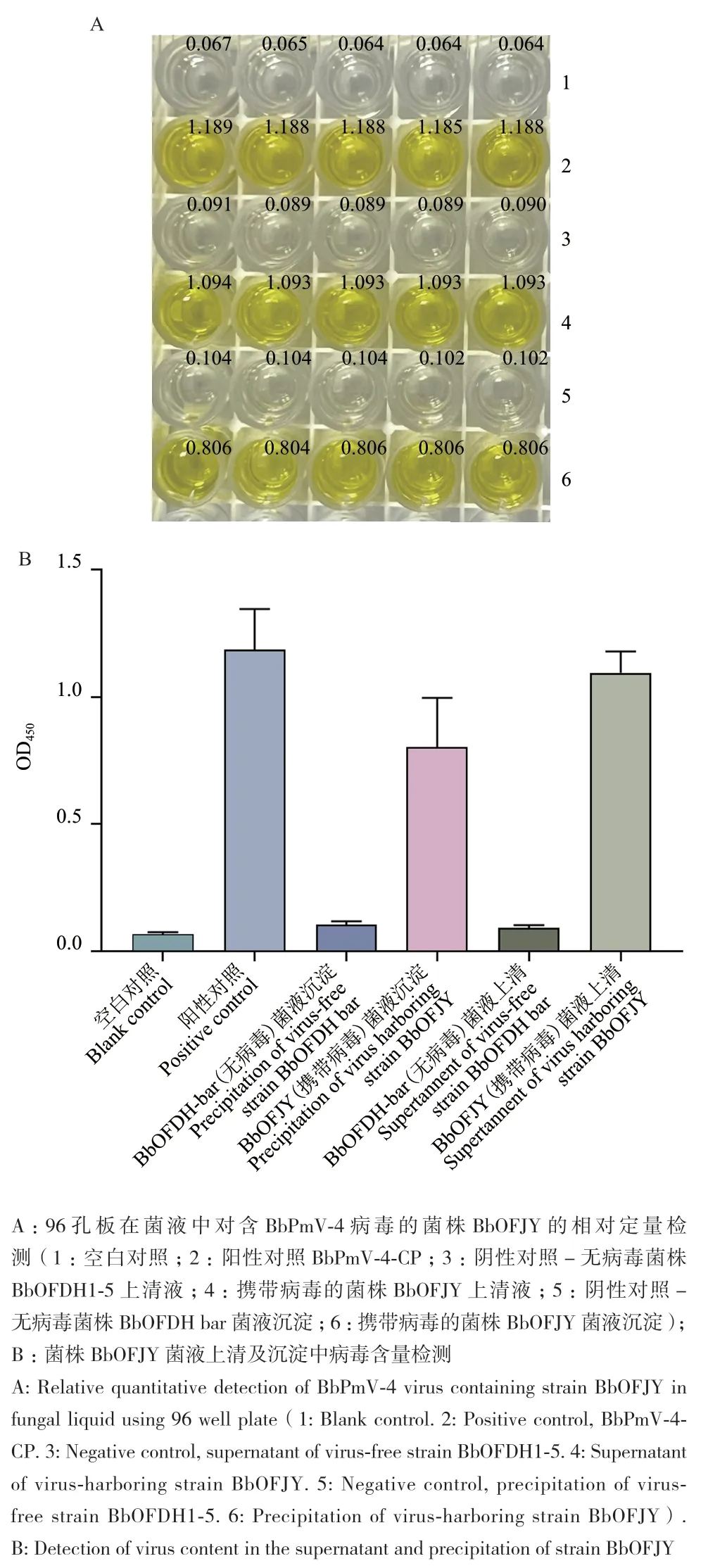
图6 间接ELISA检测BbPmV-4病毒含量结果Fig. 6 Indirect ELISA detection results of BbPmV-4 virus contents
2.6 间接免疫荧光检测——病毒细胞定位
制备的多抗可对含病毒BbPmV‑4的BbOFJY菌株产生特异性黄色荧光信号,而阴性血清及无病毒球孢白僵菌菌株处理无信号反应(图7),表明制备的兔源多抗可特异性识别病毒BbPmV‑4寄主球孢白僵菌,该病毒定位于球孢白僵菌细胞核中。

图7 间接免疫荧光检测(×60)Fig. 7 Indirect immunofluorescence assay(×60)
3 讨论
3.1 真菌病毒血清学检测技术
真菌病毒的血清学检测方法尚未见报道。目前,对各类真菌病毒的检测主要依靠常规的RT‑PCR和分子生物学方法,工作量大、检测周期长,且无法对检测菌株进行定量检测。本研究所建立的针对真菌病毒BbPmV‑4的血清学检测方法检测效率高,特异性强,且可对菌株中的病毒进行定量检测。该检测体系同样适用于其他真菌病毒的检测。
3.2 为真菌病毒BbPmV‑4与寄主在蛋白水平的互作机理研究提供材料
真菌病毒能够改变寄主真菌的生物学性状、毒力及致病力,已被广泛应用于植物病原真菌的生物防治研究[23-24]。真菌病毒与寄主真菌的互作机理研究,对深入了解和利用病毒具有重要意义。目前主要用转录组学方法鉴定和分析受病毒调控的寄主真菌关键通路和基因。作者前期研究发现,真菌病毒BbPmV‑4能够显著提高球孢白僵菌对害虫的毒力,并且提高其菌丝生长速度。转录组分析结果表明,病毒感染显著提高编码丝裂原活化蛋白激酶(MAPK)、细胞色素P450(CYP450)和PKS‑NRPS表达水平。这些寄主真菌关键通路和基因需要在蛋白质水平上进一步验证,例如pull‑down[25]和免疫共沉淀(co‑immunoprecipitation)[26-27]等技术。本研究制备了效价高且特异性好的真菌病毒外壳蛋白多抗,可以用于与病毒互作的寄主真菌蛋白筛选和鉴定,为开展BbPmV‑4与寄主球孢白僵菌的互作研究提供材料。
3.3 真菌BbPmV‑4定位与寄主细胞核
细胞核是病毒完成自我复制和翻译的重要细胞器,大部分RNA病毒可在宿主细胞质中完成自身蛋白的合成过程,但其重要蛋白的合成仍需要在宿主细胞核内完成,这些蛋白质在影响病毒的毒力、复制能力以及致病力方面往往发挥关键作用[28],且近年研究发现,宿主细胞核中也存在发挥着位点选择、免疫逃逸等功能的病毒衣壳[29]。免疫共沉淀等免疫学方法是病毒与寄主互作研究的重要手段[30],相关研究在植物及动物病毒中细胞定位机制研究体系较为成熟[31-32]。然而真菌病毒感染寄主后,如何在寄主体内复制以及与寄主互作机制目前尚不明确。本研究利用间接免疫荧光方法检测到BbPmV‑4定位于寄主球孢白僵菌的细胞核,说明真菌病毒与其他病毒可能具有相似或者相同的复制和翻译功能。
3.4 真菌病毒BbPmV‑4能被分泌到寄主体外进行传播
球孢白僵菌高毒力菌株的创制主要以野生菌株筛选和基因工程菌株为主。野生高毒力菌株筛选周期长、菌种易退化,造成了高毒力菌株获取难度高。而基因工程菌株涉及环境安全问题,目前尚无法应用。真菌病毒能够在寄主种内和种间传播[33-34],作者前期研究发现,BbPmV‑4不仅能够通过共培养实现球孢白僵菌种内进行高效地的水平传播和垂直传播,还可以在不同种白僵菌的种间进行传播,并能够通过共侵染昆虫实现上述传播。但病毒是通过菌丝在培养基或昆虫体内产生融合而实现传播,还是病毒粒子可以游离到菌株体外后传播至另一菌株尚不清楚。本研究在寄主球孢白僵菌菌体内部和培养基中均检测到该病毒,说明BbPmV‑4可能从原寄主分泌至体外,并感染新的寄主,形成传播。该结果不仅为真菌病毒的流行学研究提供了理论支持,还为通过BbPmV‑4病毒感染从而快捷高效地获得高毒力菌株提供了理论依据。
4 结论
本研究制备出特异性好且高效价的球孢白僵菌真菌病毒多克隆抗体BbPmV‑4‑CP。在真菌胞内及胞外ELISA检测中,检测到该病毒可在寄主体内复制表达,并游离到菌液上清中实现病毒传播。通过免疫荧光发现真菌病毒BbPmV‑4定位于寄主球孢白僵菌真菌细胞核上,该病毒可能在细胞核内完成复制和翻译。该研究为利用真菌病毒创制高毒力菌株提供理论支持。

