体轴抑制因子1 敲除及过表达对ACT-1 人未分化甲状腺癌细胞中B 细胞淋巴瘤-2 表达影响的初步研究
文 丹,胥正敏,林师宇,黄 蓉
(1.川北医学院附属医院核医学科,四川 南充 637000;2.川北医学院药学院,四川 南充 637000)
未分化甲状腺癌(anaplastic thyroid cancer,ATC)是起源于甲状腺滤泡上皮细胞的高度侵袭性肿瘤,由于其具有失分化、恶性程度高、易发生远处转移等特点,该类患者往往预后较差、生存期不超过半年[1]。关于ATC 发病的分子机制目前仍不清楚。AXIN1 基因在多种肿瘤中表达降低并在肿瘤的发病过程中扮演着抑癌基因的角色,该基因表达异常可以导致非小细胞肺癌[2]、肝细胞癌[3]、结直肠癌[4]和胃肠道癌[5]等多种肿瘤发生。且研究发现[6],采用重组AXIN1 过表达载体(pcDNA3.1-AXIN1)转染人胚胎肿瘤衍生细胞系NTera2 后,与对照组相比,AXIN1表达量增加,Bcl-2 表达降低。另有研究发现[7],运用牙龈卟啉单胞菌-脂多糖(LPS-Pg)处理大鼠成骨细胞后可抑制Bcl-2 表达,而在此基础上敲低AXIN1基因后,可逆转Pg-LPS 诱导的促凋亡作用。这些研究都暗示AXIN1 和Bcl-2 基因在疾病发生过程中可能存在着某种关联,但关于二者在ATC 肿瘤中的相关性尚需研究证实。本课题组前期研究采用CRISPR-Cas9 基因编辑技术成功构建出AXIN1 基因敲除的ACT-1 单克隆细胞系[8]。基于此,本研究构建了AXIN1 基因过表达的ACT-1 肿瘤细胞系,以期在构建成功的两种工具细胞中探讨敲除及过表达AXIN1 基因对ACT-1 中Bcl-2 的影响,现报道如下。
1 材料与方法
1.1 材料 Nthy-ori-3-1 及ACT-1 细胞系均购自ATCC 细胞库,嘌呤霉素购自Boster 公司,兔抗Bcl-2 单克隆抗体购自CST 公司,DMEM 高糖培养基购自invitrogen 公司;胎牛血清购自NTC 公司;胰蛋白酶、二甲基亚砜、无菌PBS 及青霉素、链霉素均购自Boster 公司;总RNA 提取试剂TRIzol、焦碳酸二乙酯(diethyl pyrocarbonate,DEPC)处理水均购自ABI 公司;逆转录试剂盒购自Thermo 公司;PowerUpTMSYBRTMGreen Master Mix 购自Applied Biosystem 公司;兔抗β-肌动蛋白(β-actin)抗体、HRP 标记的山羊抗兔IgG 购自Boster 公司;兔抗AXIN1 及Bcl-2 单克隆抗体均购自CST 公司;二辛可宁酸(bicinchoninic acid,BCA)蛋白定量试剂盒购自博士德公司;台式高速低温离心机购自上海力申;IX50 荧光显微镜购自Olympus 公司;流式细胞仪购自BD Bioscience 公司。
1.2 方法
1.2.1 构建AXIN1 基因过表达病毒载体 将AXIN1的cDNA 序列克隆到MLPIC 病毒载体中,采用核酸内切酶酶切鉴定出AXIN1 基因过表达的病毒载体MLPIC-AXIN1,从插入序列两端及cDNA 序列中段测全序列的cDNA。
1.2.2 构建AXIN1 基因过表达的ACT-1 肿瘤细胞系首先,采用HEK293T 细胞包装病毒,24 h 后荧光显微镜观察293T 转染效率,收集48~72 h 病毒过滤后感染ACT-1 细胞,其阴性对照组及实验组分别设置3 个生物学复孔。流式检测24 h 病毒感染效率在10%左右,因转染后的细胞含有嘌呤霉素抗性,随即采用嘌呤霉素进行细胞筛选,当加药后细胞无明显死亡,可再次行流式检测红色荧光细胞比率,若比率达90%左右,则获得稳定过表达AXIN1 的携带红色荧光并含嘌呤霉素抗性基因稳定肿瘤细胞株。
1.2.3 实时荧光定量PCR 法检测细胞中AXIN1 和Bcl-2 mRNA 表达情况 收取细胞,加入TRIzol 裂解液,反复吹打细胞至其完全裂解,按比例加入氯仿静置分层,低温离心机高速离心;吸取上清加入等体积异丙醇,室温静置,低温离心机高速离心;弃上清,加入750 ml/L 酒精,低温离心机离心;甩干酒精,加入RNA 无酶水使其充分溶解;按照逆转录试剂盒行反转录过程;取cDNA 产物进行实时荧光定量PCR 扩增;观察每孔对应样品融解曲线及扩增曲线图,采用2△△CT法处理及分析数据并记录。PCR 引物为:β-actin正向序列为5’-TTCTTTGAGCTCCTTCGTT-3’,反向序列为5’-ATGGAGGGGAATACAGCCC-3’;AXIN1 正向序列为5’-CCTCCTGGCATCTGTAAG-3’,反向序列为5’-CCGCTCCTTCTGTCTATG-3’;Bcl-2 正向序列为5’-GTGGATGACTGAGTACCTGAAC-3’,反向序列为5’-GAGACAGCCAGGAGAAATCAA-3’。PCR 反应体系(20 μl):稀释后的cDNA 8 μl,正反向引物各1 μl,SYBR®Green 10 μl。PCR 扩增程序如下:50 ℃2 min,95 ℃2 min;95 ℃解链15 s,55 ℃~60 ℃退火15 s,72 ℃延伸1 min,共循环40 次。
1.2.4 蛋白质免疫印迹法检测细胞中AXIN1 和Bcl-2 蛋白表达情况 收取细胞于冰上,离心后弃上清,向细胞内加入蛋白裂解液,枪尖充分吹打,冰上静置裂解细胞,按比例加入上样缓冲液,高温变性后高速离心收取上清;BCA 蛋白定量试剂盒检测所提取细胞蛋白样品浓度。按每孔30 μg 总量上样至SDS-PAGE 胶使其分离,将分离好的蛋白样品转移至PVDF 膜上,50 g/L 脱脂牛奶室温封闭,分别加入β-actin 抗体(1∶5000)、兔抗AXIN1 单克隆抗体(1∶1000)及兔抗Bcl-2 单克隆抗体(1∶1000),4 ℃孵育过夜;PBS 清洗5 次,加入HRP 标记的兔抗二抗(1∶5000),室温孵育1.5 h;PBST 清洗后,采用化学发光法加入Western blot 曝光液显影;导出数据,采用Image J 软件进行图像吸光度(A)值分析,用AAXIN1/Aβ-actin或ABcl-2/Aβ-actin的比值分析AXIN1 及Bcl-2 的相对表达水平。
1.3 统计学方法 采用SPSS 22.0 统计软件进行数据分析,正态分布的计量资料以(±s)表示,比较采用t检验。以P<0.05 为差异有统计学意义。
2 结果
2.1 Nthy-ori-3-1 及ACT-1 中AXIN1、Bcl-2 mRNA表达水平比较 与正常甲状腺细胞Nthy-ori-3-1相比,肿瘤细胞ACT-1 中AXIN1 及Bcl-2 mRNA表达水平均降低,差异有统计学意义(P<0.05),见图1。

图1 ACT-1 中AXIN1 及Bcl-2 基因mRNA 表达量
2.2 过表达AXIN1 的cDNA 病毒载体的构建与验证与阴性对照组MLPIC 相比,实验组质粒MLPICAXIN1 在进行酶切鉴定后可见除载体外的小条带,大小约4000 bp,见图2、图3。
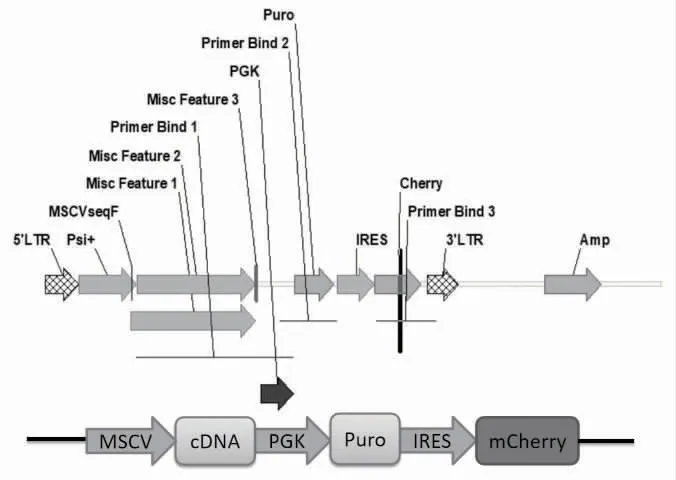
图2 MLPIC 质粒工作结构图

图3 质粒酶切鉴定结果
2.3 AXIN1 基因过表达细胞系的构建 在过表达质粒构建成功的基础上,采用HEK293T 细胞分别包装MLPIC 及MLPIC-AXIN1 病毒,转染后24 h 荧光显微镜下可见细胞内有明显mCherry 红色荧光表达,见图4。流式细胞检测结果显示,ACT-1 细胞感染后24 h mCherry 阳性比率分别为(5.87±0.21)%、(4.97±0.13)%及(5.23±0.15)%,(8.61±0.32)%、(7.30±0.21)%及(7.49±0.42)%,见图5。感染后的ACT-1 经嘌呤霉素筛选后可获得稳定过表达AXIN1 的肿瘤细胞系,流式分析mCherry 阳性比率可达(92.31±0.42)%、(96.32±0.71)%、(92.21±0.61)%及(95.03±0.82)%、(94.12±0.31)%及(89.61±0.52)%,见图6。与阴性对照组ACT-1-MLPIC 相比,实验组ACT-1-MLPIC-AXIN1 中AXIN1 mRNA 和蛋白质表达水平均增加,差异有统计学意义(P<0.05),见图7。

图4 HEK293T 细胞包病毒后24h 细胞形态及mCherry 表达

图5 ACT-1 感染后24h 流式分析mCherry 阳性细胞比率

图6 新霉素筛选后流式分析ACT-1 mCherry 阳性细胞比率

图7 ACT-1 过表达细胞中AXIN1 表达量检测
2.4 敲除及过表达AXIN1 的ACT-1 细胞中Bcl-2表达水平比较 与阴性对照组ACT-1-scramble 相比,实验组ACT-1-sgAXIN1.Cr5-17 中Bcl-2 mRNA及蛋白表达增加,差异有统计学意义(P<0.05);与阴性对照组ACT-1-MLPIC 相比,实验组ACT-1-MLPIC-AXIN1 中Bcl-2 mRNA 及蛋白表达水平降低,差异有统计学意义(P<0.05),见图8。

图8 ACT-1 敲除及过表达细胞中Bcl-2 表达量检测
3 讨论
Wnt 信号通路对于细胞增殖、细胞分化和组织稳态的调节十分重要。其中,该通路组成成分或关键负调控因子突变诱导的通路激活是肿瘤发生的重要原因,持续的Wnt 通路异常激活往往与肿瘤细胞的异常增殖及耐药性相关[9,10]。AXIN1 基因作为Wnt通路重要的负调节因子,可在多种因子的介导下调控Wnt 通路而参与肿瘤细胞的增殖、凋亡过程[11]。Huang T 等[12]研究发现,泛素特异性蛋白酶44(USP44)可通过Axin1 去泛素化作用使Wnt/β-catenin 途径失活,从而抑制结直肠癌细胞增殖,促进其凋亡发生。Zhang Y 等[13]研究发现,E3 泛素连接酶(UBE3C)过表达可通过促进AXIN1 泛素化来上调β-catenin信号传导,从而促进胃癌细胞增殖并抑制细胞凋亡。Biechele TL 等[14]研究发现,Wnt/β-catenin 信号通路和AXIN1 可以在人黑色素瘤中调节由突变激酶BRAFV600E 的抑制引发的细胞凋亡。
细胞凋亡是参与个体胚胎发育、组织稳态和免疫的重要生物学过程,主要包括2 种途径,即内在凋亡途径和外在凋亡途径[15]。靶向凋亡途径的成分,尤其是内在途径中的Bcl-2 家族,已被证明是改善血液系统恶性肿瘤患者预后的有效治疗方法[16]。Bcl-2基因作为抗凋亡基因家族重要的成员之一,可以通过抑制促凋亡蛋白(如BAX 和BAK)的激活来抑制细胞凋亡,从而促进癌细胞存活[17]。通常情况下,抗凋亡因子Bcl-2 蛋白家族可能通过破坏凋亡与抗凋亡之间的平衡,在滤泡上皮细胞起源的甲状腺肿瘤病理类型转化中发挥重要作用[18]。Gupta A 等[19]、Fourati A 等[20]对不同病理类型的甲状腺癌进行免疫组化发现,与分化良好的甲状腺肿瘤相比,ATC 肿瘤中Bcl-2 表达明显降低。本研究结果发现,ACT-1细胞系中Bcl-2 表达同样降低,与上述研究[19,20]基本一致。在AXIN1 敲除的单克隆细胞系中,Bcl-2 表达增加;在ACT-1 过表达的细胞系中,Bcl-2 表达降低,提示ATC 肿瘤发生过程中Bcl-2 与AXIN1 之间的关联性,AXIN1 的低表达可能参与了ATC 肿瘤失分化过程,并且当抑癌基因AXIN1 发生突变时,可能通过上调Bcl-2 的表达来调控细胞的凋亡过程,因此Bcl-2 有望成为ATC 治疗的另一个靶标。
综上所述,在未分化甲状腺癌细胞中,AXIN1基因在ATC 细胞中起着重要的抑癌作用,Wnt 通路中AXIN1 基因的突变可能通过上调凋亡抑制基因Bcl-2 的表达参与ATC 肿瘤发生、发展过程,后期可以在前期研究的基础上,利用小分子抑制剂对ATC中Bcl-2 分子作用机制进行更深入研究。

