NLRP3/caspase-1途径在电针联合高频重复经颅刺激改善局灶脑梗死大鼠认知和运动功能中的作用
李传金 姜波 王德利 刘经星 唐小莉
中风(Stroke)一种常见的急性脑血管病,发病率、复发率和死亡率都较高[1,2]。缺血性中风约占所有中风病例的80%。这是由于大脑供血的局部或全身减少,导致缺血或梗死,神经功能丧失或脑卒中[3]。中风导致的脑缺血导致ATP水平降低、乳酸积累和炎症级联反应的激活,从而导致脑组织缺血和坏死[4]。脑缺血损伤的临床治疗包括恢复血流和脑再灌注,从而减少中风引起的梗死面积和神经功能缺损。然而,脑再灌注在恢复过程中导致损伤增加,称为脑缺血再灌注损伤(CIRI)[5]。最近的研究表明,线粒体功能障碍、氨基酸释放、钙超载、活性氧(ROS)的产生、氮的形成、环状RNA(circRNAs)、炎症和细胞凋亡与CIRI的发病机制有关[6,7]。电针(Electroacupuncture ,EA)具有双重治疗效果,是一种简单、方便和成本效益高的治疗方案,已广泛用于治疗脑缺血后的认知障碍[8,9]。如百会(GV 20)和大椎(GV 14)穴位的电针导致CIRI大鼠大脑皮层的超微结构改变[10];GV 20和神庭(GV24)穴位的EA刺激可以显著改善MCAO/R诱导的认知缺陷和行为功能障碍[11,13]。研究表明,细胞焦亡在神经认知障碍的形成和发展中发挥重要作用[14]。炎症体的激活是调控细胞焦亡的经典途径。NLRP3通过包含CARD的凋亡相关斑点样蛋白(ASC)等连接蛋白募集caspase-1,并诱导其前体蛋白酶(pro-caspase-1)发生自水反应。活化的caspase-1可有效触发下游因子引起细胞焦亡[15,16]。NLRP3作为脑缺血后中枢神经系统无菌性炎性反应的启动因子,诱导细胞焦亡,导致神经细胞损伤,在脑缺血/再灌注后炎症级联效应中起关键作用[17,18]。如EA通过α7nAChR介导的NLRP3炎症小体抑制减轻脑卒中大鼠脑缺血损伤和神经炎症[19]。另外,介导细胞焦亡的经典caspase-1信号通路在中风后被激活,并加剧脑损伤,而抑制caspase-1激活可减少中风损伤并发挥保护作用[20,21]。本研究的目的是通过NLRP3/caspase-1途径信号通路研究联合高频重复经颅刺激GV20和GV24穴位是否能改善大鼠大脑中动脉闭塞(middle cerebral artery occlusio,MCAO)后的学习和记忆障碍。
1 材料与方法
1.1 实验动物 从北京维通利华实验动物技术有限公司获得36只无特异性病原体的雄性 Sprague-Dawley 大鼠[10~12周龄,体重(260±20) g]。大鼠在22℃度和湿度50% 的环境中,以12 h/12 h的光照/黑暗周期饲养。对于安乐死,使用2% 的戊巴比妥。将36只大鼠随机分为假手术组、 MCAO 组和 MCAO + 电针组,每组12只。本实验获得十堰市人民医院动物伦理委员会批准。
1.2 MCAO模型建立 MCAO模型使用Longa方法建立[22]。基于改良的fornylon缝合法,通过颈部切口仔细暴露左侧颈总动脉、左侧颈外动脉和颈内动脉并解剖。将约18~22 mm的尼龙单丝插入颈内动脉并推进,直至大脑中动脉的起点被阻断。闭塞120 min后,提取尼龙单丝以恢复血流。对于假手术组,单纯分离颈总动脉、颈内动脉和颈外动脉。在手术期间和之后,使用加热垫将动物的内部温度保持在37℃。神经功能缺损评分用于评估MCAO的成功。
1.3 EA治疗 MCAO手术后2 h,MCAO+EA组的大鼠使用EA装置在百会(GV20,位于顶骨中心)和神庭(GV24,位于前中线)穴位接受EA治疗。将针刺针以45°角插入头部GV20和GV24穴位2~3 mm的深度。刺激参数如下:扩张波频率,1~20 Hz;6 V峰值电压;2 mA强度,30 min/d,连续8 d。
1.4 神经功能缺损评分 再灌注后2 h和电针治疗第8天,使用Longa评分量表评估神经功能[22]:0表示无神经功能缺损,1表示轻度缺损(未能完全伸展右前爪),2表示向右绕圈,3表示向右跌倒,提示中度缺损,4个代表严重缺陷(完全丧失行走能力)。得分在1~3表明MCAO建模成功,并被纳入后续实验。
1.5 水迷宫试验 为了评估学习和记忆能力,如先前的研究方法所述[23,24],在手术后第4天开始使用Morris水迷宫测试大鼠。从第4天到第8天对大鼠进行训练,并在第9天进行测试。Morris水迷宫测试由两部分组成:地点导航测试和空间探针测试。水迷宫装置由直径150 cm、高度60 cm的圆形水池组成。摄像机记录并观察老鼠的活动。在位置导航测试中,大鼠被随机分配到四个象限中的一个,并被允许找到一个隐藏的平台。然后,记录大鼠爬上平台所需的时间,上限为90 s。如果大鼠在90 s内爬上平台并停留超过3 s,则认为大鼠找到了平台,时间记录为潜伏期。如果大鼠在90 s内无法定位平台,则将其手动引导至平台,并让其在10 s内熟悉平台位置。对于必须被引导到平台的大鼠,潜伏期记录为90 s。每天上午10∶00开始训练,大鼠每天训练4次,每次训练间隔10 min,连续5 d。延迟被记录为到达平台所需的时间,并在4次训练中取平均值。为了进行空间探测测试,在第6天移除隐藏平台,并测试大鼠记住隐藏平台位置的能力。让大鼠自由游泳90 s,并记录在90 s的试验中,大鼠游到平台先前位置的次数。
1.6 2,3,5-三苯基氯化四唑染色 如前研究方法所述[25],使用2,3,5-三苯基四氮唑氯化物染色在形态学水平上评估脑梗死。简而言之,在Morris迷宫试验后,通过心脏向大鼠灌注0.9%氯化钠溶液,然后迅速取出大脑并在-20℃下冷冻30 min。将脑组织切成5个2 mm冠状切片,立即在37℃的2%2,3,5-三苯基四氮唑氯化物溶液中培养20 min,然后在黑暗中固定在4%聚甲醛中24 h。用相机拍摄染色部分。计算脑梗死体积百分比。
1.7 透射电子显微镜 透射电子显微镜用于观察神经元凋亡和自噬的变化[26]。麻醉后,用3%戊二醛和1.5%多聚甲醛的混合物在4℃下固定皮层缺血周围区域8 d,然后用1%四氧化锇在碳酸钙缓冲液中固定2 h。在室温下用0.1%磷酸盐缓冲液洗涤切片。用磷酸盐缓冲盐水(PBS)洗涤后,将样品用30%~100%乙醇丙酮梯度脱水,加入Epon Araldite 618混合物中2 h,然后切成80 nm的模块化超薄切片,并用电子显微镜观察。
1.8 Western blot 蛋白质提取以及Western Blot检验的相关步骤参考Wang等[27]的方法进行。一抗主要有兔抗β-actin NLRP3、caspase-1(Abcam)。二抗山羊抗兔IgG(Thermo Fisher Scientific,USA)。
1.9 HE染色 脑组织切片分别用二甲苯和无水乙醇脱蜡2次,并水合。清洁后,使用苏木精染色10 min。用1%盐酸乙醇进行区分,用1/400氨水进行发蓝。清洗后,用伊红染色5 min。乙醇逐渐脱水。二甲苯透明2次,并用中性树脂密封。在显微镜下观察海马神经细胞的形态,以判断神经细胞损伤的程度。
1.10 免疫荧光 冷冻切片在乙二胺四乙酸(EDTA)抗原修复溶液(Servicebio,China)中煮沸用于抗原提取,并在室温下用3%牛血清白蛋白封闭30 min。然后,将切片在4℃下与一抗抗caspase-1(和NLRP3的孵育过夜。然后,将切片与相应的二级抗体在室温下孵育90 min。将切片在PBS中洗涤3次(5 min/次),并使用DAPI对干燥切片染色10 min。通过荧光素(FITC)TUNEL细胞凋亡检测试剂盒检测细胞凋亡。在显微镜下观察脑组织的形态学变化。随机选择海马CA1区的2个90×视野进行摄影。阳性细胞数按以下公式计算:双染色细胞/总细胞×100%。
2 结果
2.1 EA减轻局灶性脑缺血/再灌注损伤大鼠的神经功能缺损和梗死体积 在本研究中,神经评分用于评估应用于GV20和GV24穴位的电针是否能改善MCAO后的神经功能。神经评分降低表明神经功能改善。假手术组的大鼠没有表现出任何神经缺陷的迹象。然而,MCAO后4~8 d,与MCAO组相比,MCAO+EA组的神经评分显著降低(P<0.05)。使用2,3,5-三苯基四氮唑氯化物染色测量梗死体积。MCAO组和MCAO+EA组的脑梗死体积显著大于假手术组,表明MCAO模型成功建立。术后8 d,MCAO+EA组的脑梗死体积相较于与MCAO组显著减少,表明EA对预防局灶性脑损伤具有显著疗效。见表1、2,图1。

图1 EA减轻局灶性脑缺血/再灌注损伤大鼠的神经功能缺损和梗死体积
表1 3组大鼠脑梗死体积的定量结果 %,
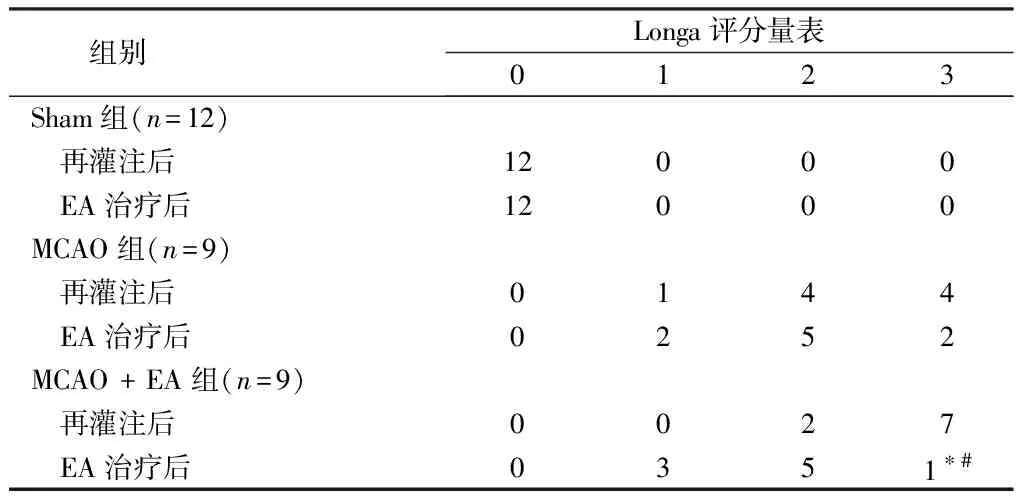
表2 EA对脑缺血再灌注损伤大鼠神经评分的影响 只
2.2 EA治疗抑制局灶性脑缺血/再灌注损伤大鼠缺血周围皮质细胞凋亡 在透射电子显微镜下,假手术组可以观察到丰富的线粒体、完整的线粒体嵴、有序的溶酶体和完整的细胞核仁。观察到大轴突,染色质均匀分布。在MCAO组中,线粒体肿胀,线粒体嵴被破坏,溶酶体出现紊乱,细胞在缺血周围皮质出现结构紊乱,在神经元细胞核边缘观察到常染色质。所有这些观察结果与早期凋亡信号一致。MCAO+EA组细胞膜部分破裂,线粒体轻度受损。MCAO+EA组未观察到粗面内质网和染色质的变化,细胞核仁完整,染色质均匀分布。接着探究了EA对局灶性脑缺血/再灌注损伤大鼠缺血周围皮质NLRP3/caspase-1信号通路的影响。 Western blot分析结果显示,与假手术组相比,MCAO组缺血周围皮质中NLRP3、caspase-1的水平显著升高;与MCAO组相比,MCAO+EA组显示缺血周围皮质中NLRP3、caspase-1的水平显著降低。这些结果表明,EA可以抑制NLRP3/caspase-1信号通路的活性。见图2,表3。
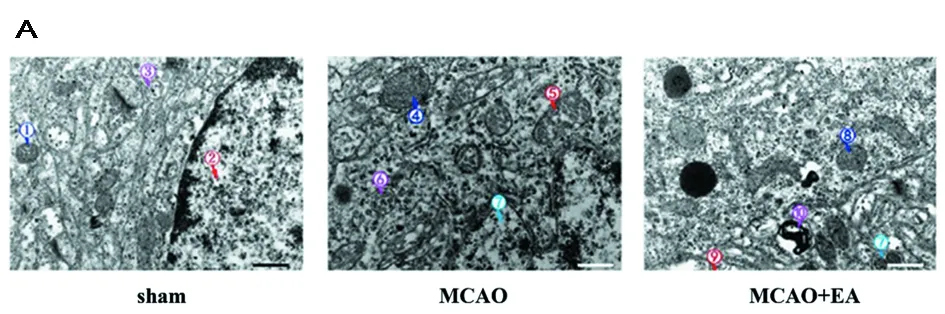
图2 EA治疗抑制局灶性脑缺血/再灌注损伤大鼠缺血周围皮质细胞凋亡;A 透射电子显微镜细胞形态;B 检测NLRP3、caspase-1的水平
表3 3组大鼠缺血周围皮质NLRP3/caspase-1信号通路相关蛋白的检测结果
2.3 EA对脑缺血/再灌注损伤后海马神经元损伤的形态学观察 既往研究表明EA治疗对脑缺血/再灌注损伤海马神经元具有细胞保护作用。HE染色显示,MCAO组海马神经元数量减少,排列松散,可见空泡样改变和不规则的核形态。MCAO+EA组海马神经元的病理变化减少,神经元变性或坏死减少。TUNEL染色结果显示,MCAO组中观察到观察到大量TUNEL和caspase-1双染色神经元,MCAO+EA组的TUNEL和caspase-1阳性率显著降低。此外,MCAO大鼠海马神经元中caspase-1和NLRP3共定位的表达。EA治疗可有效减少MCAO大鼠神经元中caspase-1和NLRP3共定位表达。见图3,表4。
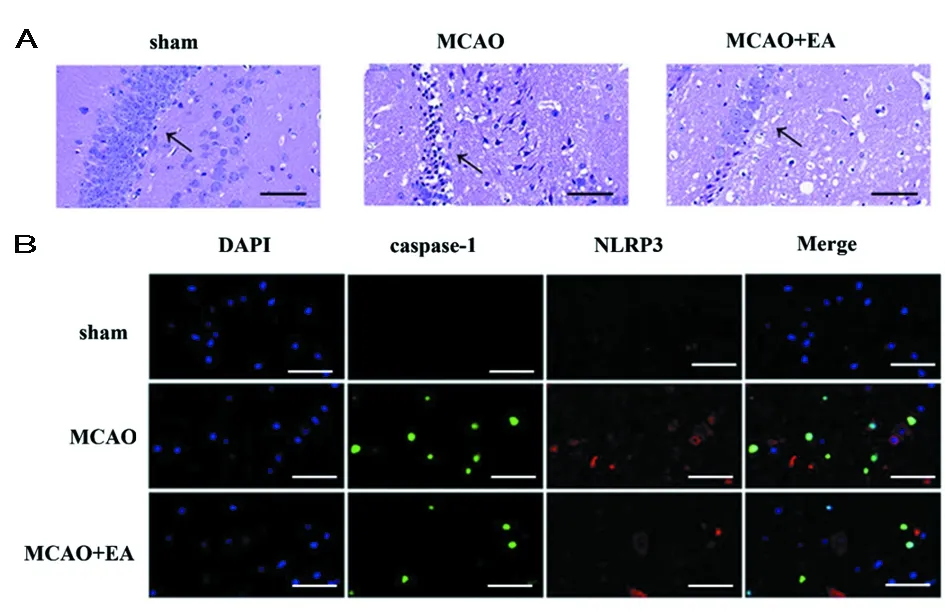
图3 EA对脑缺血/再灌注损伤后海马神经元损伤的形态学观察;A HE染色;B TUNEL染色
表4 3组大鼠缺血周围皮质NLRP3/caspase-1信号通路相关蛋白的检测结果
2.4 EA减轻局灶性脑缺血/再灌注损伤大鼠的学习和记忆损伤 Morris水迷宫试验用于评估大鼠的认知能力。在位置导航试验中,MCAO组大鼠的平均潜伏期比假手术组大鼠长。与MCAO组的潜伏期相比,MCAO+EA组的潜伏期显著降低。在空间探针测试期间,MCAO组穿过目标象限的频率低于假手术组。然而,与MCAO组相比,MCAO+EA组更频繁地穿过目标象限。这些结果表明,EA治疗显著改善了MCAO大鼠的学习和记忆能力。见表5、6。
表5 3组大鼠在空间探针试验中穿过目标象限的次数
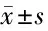
表6 EA对局灶性脑缺血/再灌注损伤大鼠位置导航试验潜伏期的影响
3 讨论
大量临床研究证实,EA刺激穴位可促进中风症状和瘫痪肢体功能的恢复,并可显著改善缺血性中风患者的认知水平和运动功能[28,29]。然而,这种影响的潜在作用机制尚未完全阐明。
许多研究表明,脑缺血后,神经功能损伤和细胞死亡在第一天达到峰值,然后逐渐减少并稳定[30]。脑缺血后早期的EA治疗可以增加脑血流,降低脑缺血/再灌注损伤的程度,并扩大治疗时间窗[31,32]。这表明针灸治疗的最佳时间是缺血后3 h内。因此,我们选择脑缺血损伤后1.5 h和脑缺血后1 d的EA作为观察时间。既往研究表明,EA可以改善肢体运动功能,并对脑缺血/再灌注损伤具有一定的神经保护作用[33,34]。这项研究的结果表明,EA可以显著改善脑缺血/再灌注后的神经功能缺损症状。
具有异常外观的线粒体,如肿胀或无组织的线粒体,被认为是诱导缺血周围区域凋亡的主要因素[35,36],导致神经元代谢和发育异常[37,38]。本研究发现EA治疗的脑缺血/再灌注大鼠神经元变性或坏死减少。细胞焦亡最明显的特征是迅速形成质膜孔、细胞肿胀和渗透性坏死,释放大量细胞内容物和促炎介质,形成过度的炎性反应[39]。在MCAO组中,HE染色显示细胞死亡、脑组织结构疏松、间质水肿、神经细胞紊乱和肿胀、固缩和细胞核碎裂的典型特征,神经细胞数量显著减少。然而,在EA组中,这种现象的发生减少,仅在缺血病灶的周围区域观察到少量神经细胞变性和坏死。在TUNEL荧光染色中,发现在凋亡和局灶性细胞核中可以形成绿色或棕黄色颗粒沉淀,而正常细胞中没有断裂的DNA片段,不会与标记物反应,因此正常细胞核是蓝色的[40]。此外,我们在TUNEL的基础上添加了caspase-1染色,以鉴定caspase-1介导的神经元焦亡。在MCAO组大鼠种观察到TUNEL和caspase-1双染色神经元的阳性率显著增加,这表明细胞焦亡与脑缺血/再灌注损伤有关。EA治疗后大鼠的阳性率显著降低,表明电针可以减少脑缺血/再灌注损伤后海马CA1区神经元的焦亡,这可能是通过抑制caspase-1的表达实现的。先前的研究还表明,EA可以抑制脑缺血大鼠海马中的神经元凋亡,并可以促进脑缺血/再灌注损伤后神经细胞的恢复[41]。此外,双标记免疫荧光显示,MCAO组大鼠神经元中NLRP3和caspase-1显著共表达,这与之前报道结果[42,43]相似。EA组大鼠共表达神经元的数量减少,这表明EA治疗可能抑制神经元焦亡。
总之,EA联合高频重复经颅刺激可以显著改善脑缺血/再灌注损伤小鼠的神经损伤症状和脑细胞形态学变化,减少梗死面积,保护脑组织免受缺血损伤。这种治疗减少了NLRP3、caspase-1的表达,减少了细胞凋亡和炎症反应的发生,表明EA对脑缺血/再灌注损伤的保护作用可能是通过抑制NLRP3/caspase-1途径发挥的。

