心外膜脂肪组织体积和密度与冠状动脉斑块及狭窄的相关性
冯晓阳 高志红 孟园园 魏炜 高子梅
冠心病(coronary heart disease, CHD)是冠状动脉粥样硬化斑块积聚和冠脉循环功能改变导致血管狭窄或阻塞而引起心肌缺血、缺氧或梗死的心脏病,疾病不同阶段病情严重程度不同,患者远期预后或再发不良心血管时间风险存在差异。而冠状动脉粥样硬化的病理过程是冠状动脉壁炎症的发生发展[1],冠状动脉壁炎症与其周围脂肪组织表型改变密切相关。心外膜脂肪组织(epicardial adipose tissue,EAT)作为一种具有独特的转录组特征[2]的异位内脏脂肪库,由于与心肌间没有筋膜结构将其分开,通过内分泌或旁分泌信号影响冠状动脉壁炎症状态[3],EAT肥大的脂肪细胞诱发巨噬细胞的浸润导致更高炎症状态[4]。EAT与冠状动脉斑块负荷、CHD及不良心血管事件预后有关[5,6]。EAT功能障碍在CHD发病机制中起着重要的作用,但是EAT形态及功能改变对冠状动脉斑块及疾病严重程度的关系尚不清楚,本研究旨在通过量化EAT体积及密度,探讨其与CHD患者冠状动脉斑块特征及疾病严重程度之间的关系,促进疾病稳定或好转。
1 资料与方法
1.1 一般资料 收集河北医科大学第二医院于2018年9月至2019年9月连续收治确诊为CHD患者240例,其中男134例,女106例;年龄41~88岁,平均(62.01±7.45)岁。吸烟史57例(23.75%),糖尿病史159例(63.4%),冠心病家族史78例(32.50%),高血压病史59例(27.13%)。根据患者冠状动脉CT血管成像(coronary computed tomography angiography,CCTA)检查结果,将受试者分为高危斑块组(n=133)和非高危斑块组(n=107例)。该研究符合《赫尔辛基宣言》,并得到河北医科大学第二医院伦理委员会的批准,所有患者签署知情同意书。
1.2 纳入与排除标准
1.2.1 纳入标准:①根据2019年欧洲心脏病学会指南[7]确诊为冠心病患者;②临床资料完整,意识清醒,自愿参加本研究;③所有受试者行经皮冠状动脉造影术及CCTA检查,既往无心肌梗死、无卒中病史。
1.2.2 排除标准:①碘对比剂过敏及严重肝肾功能不全者;②行冠状动脉旁路移植术及冠状动脉支架植入术者或心脏其他手术及恶性肿瘤患者;③严重心包积液及心脏瓣膜关闭不全或狭窄者;④患有自身免疫性疾病、内分泌及血液系统相关疾病;⑤近1个月患有严重感染或外伤手术者;⑥CCTA检查冠状动脉无斑块及图像质量不佳不能判断斑块性质者。
1.3 方法
1.3.1 基本资料记录:登记所有患者基本资料,性别、年龄、身高、体重、收缩压和舒张压、吸烟史、家族史、糖尿病史、高脂血症、高血压等病史,计算体重指数(Body mass index,BMI)。同时记录研究对象空腹静脉血总胆固醇(Total cholesterol TG)、三酰甘油(triglyceride,TG)、高密度脂蛋白胆固醇(high-density lipoprotein cholesterol,HDL-C)、低密度脂蛋白胆固醇(low-density lipoprotein cholesterol,LDL-C)、空腹血糖(fasting blood glucose,FBG)。
1.3.2 冠状动脉CT血管造影(CCTA)扫描设备:应用德国西门子炫速双源CT(Somatom Definition FLASH, Siemens Healthcare, Forchheim, Germany)扫描仪行CCTA检查,机架旋转时间0.33 s,管电压均为120 kV。要求患者心率<60次/min,心率>60次/min的患者扫描前1 h口服25~75 mg倍他乐克(阿斯利康制药有限公司,上海)。所有患者扫描前均舌下含服硝酸甘油。患者取仰卧位,扫描范围自气管隆突下至心尖部,先行冠脉钙化积分扫描,然后,根据患者的体重计算所需对比剂量,以速率5.0~5.5 ml/s静脉注射非离子型对比剂碘帕醇(370 mgI/ml)后以相同速率注入0.9%氯化钠溶液40 ml进行冠脉CTA检查。采用前瞻性心电门控或回顾性心电门控扫描序列,扫描触发阈值100 Hu。
1.3.3 心外膜脂肪组织(EAT)体积及密度测量方法:CCTA扫描原始数据传送至西门子Syngo MMWP(VE32B)工作站(德国,西门子公司),两名具有5年以上中级职称的医师通过双盲方法评估EAT体积及密度。应用Volume 半自动测量软件定量分析EAT体积及密度。EAT测量范围:前界为胸骨后,后界为降主动脉前壁,上界为左肺动脉起始的下表面,下界至左心室心尖部,脂肪阈值设定为-190~-30 Hu,每间隔3~4 mm层厚逐层手动勾勒EAT范围,Volume软件自动识别符合阈值的所有体素内的脂肪组织并计算EAT体积及整体EAT平均密度,然后记录。见图1~3。
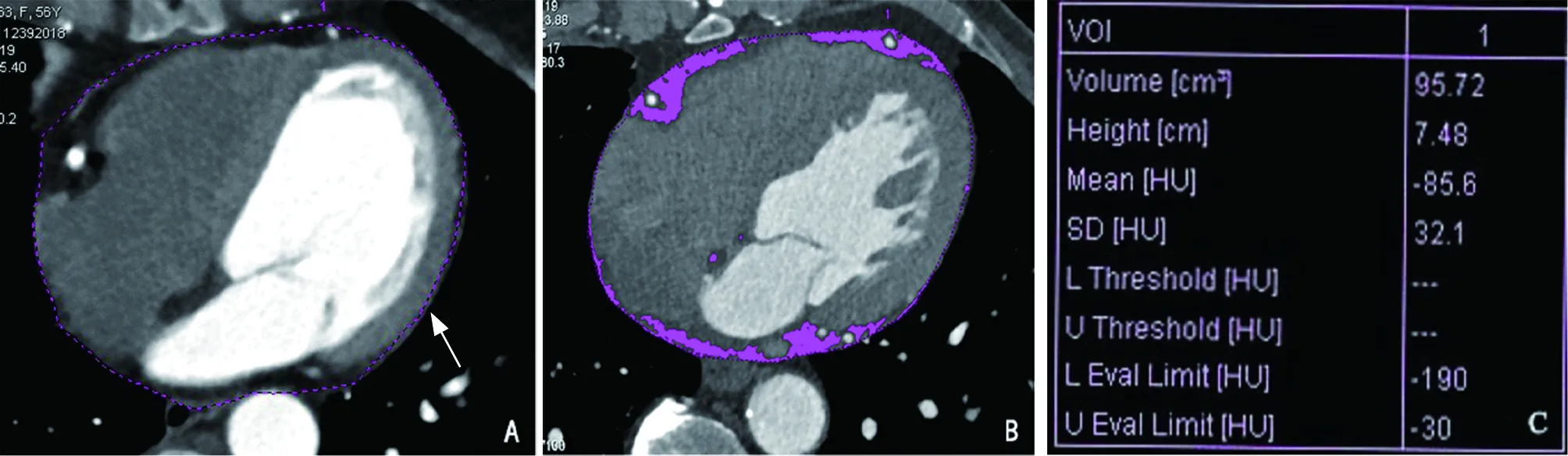
图1 白色虚线显示心外膜轮廓 图2 粉色区域显示符合脂肪阈值的心外膜脂肪组织 图3 粉色区域内心外膜脂肪组织的体积及密度值
1.3.4 斑块特征评估:将冠状动脉直径≥2 mm的节段行斑块评估,通过双盲方法,由两位观察者通过曲面重建和垂直于血管中心线的横断面图像进行评估。动脉硬化斑块分为非高危斑块、高危斑块,高危斑块特征评估如下:①正性重构:重构指数定义为病变最大血管直径除以近端和远端节段直径的平均值,正性重构定义为重构指数≥1.1[8];②低密度衰减:冠状动脉斑块中心位置密度值30 Hu[9];③斑点状钙化:病变内钙化斑块长度<3 mm,病变周长小于管径的1/4[8];④napkin-ring征:斑块核心具有较低的CT密度衰减,周围环绕着较高密度衰减[10]。有以上4种特征之一归为高危斑块,没有归为非高危斑块。见图4。
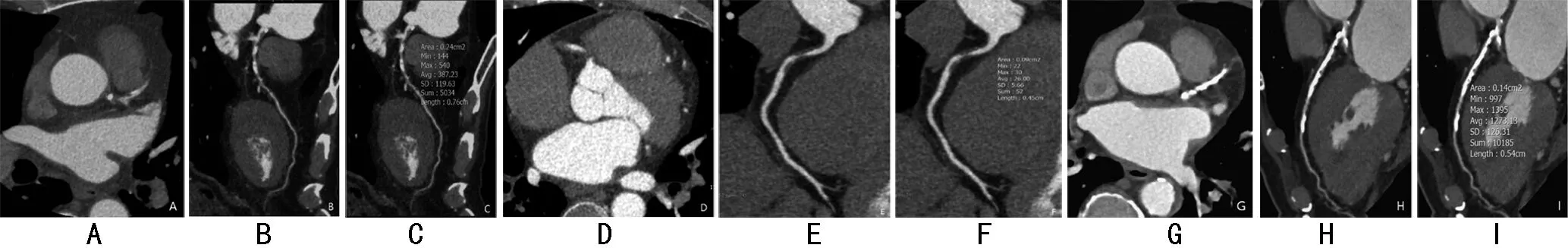
图4 HRP和NHRP图像:图A~C显示点状钙化斑块;A、B分别为横轴位及曲面重建图像;C 点状钙化平均CT值为387.23 Hu;D、F为低密度衰减斑块;D、E为横轴位及曲面重建图像; F 斑块CT值为26 Hu;图A、F均属于高危斑块;G、I为钙化斑块;G、H是横轴位和曲面重建图;I钙化斑块平均CT值约为1 273.13 Hu,属于非高危斑块
1.3.5 冠状动脉脉狭窄程度评分:根据美国心脏学会冠状动脉分段法,采用Gensini积分法分析血管狭窄。狭窄程度以每支血管病变最严重处为评定标准,狭窄直径在1%~25%计1分、26%~50%计2分、51%~75%记4分、76%~90% 计8分、91%~99%计16分、血管完全闭塞计32分。根据冠脉分支的不同分段将以上所得分值乘以以下系数:左主干×5;左前降支近段、左回旋支近段病变×2.5;左前降支中段×1.5;右冠近、中、远段、右冠后降支、左前降支远端、第一对角支、钝缘支、左回旋支远段及后降支均×1,其他分段×0.5。最终Gensini积分是所有病变评分的总和[11]。
2 结果
2.1 NHRP组与HRP组基本资料及EAT参数比较 EAT定量测量由两名熟悉冠脉CTA影像诊断的主治医师进行独立勾画并测量,两名测量者冠脉CTA定量测量结果ICC均>0.75,P<0.001。提示两名测量者测量结果一致性良好。NHRP组年龄、EAT体积、EAT密度低于HRP组,而在HRP组吸烟史、家族史及糖尿病史发病率高。差异均有统计学意义(P<0.05)。见表1、2。

表1 2名测量者间EAT体积和密度测量指标一致性检验
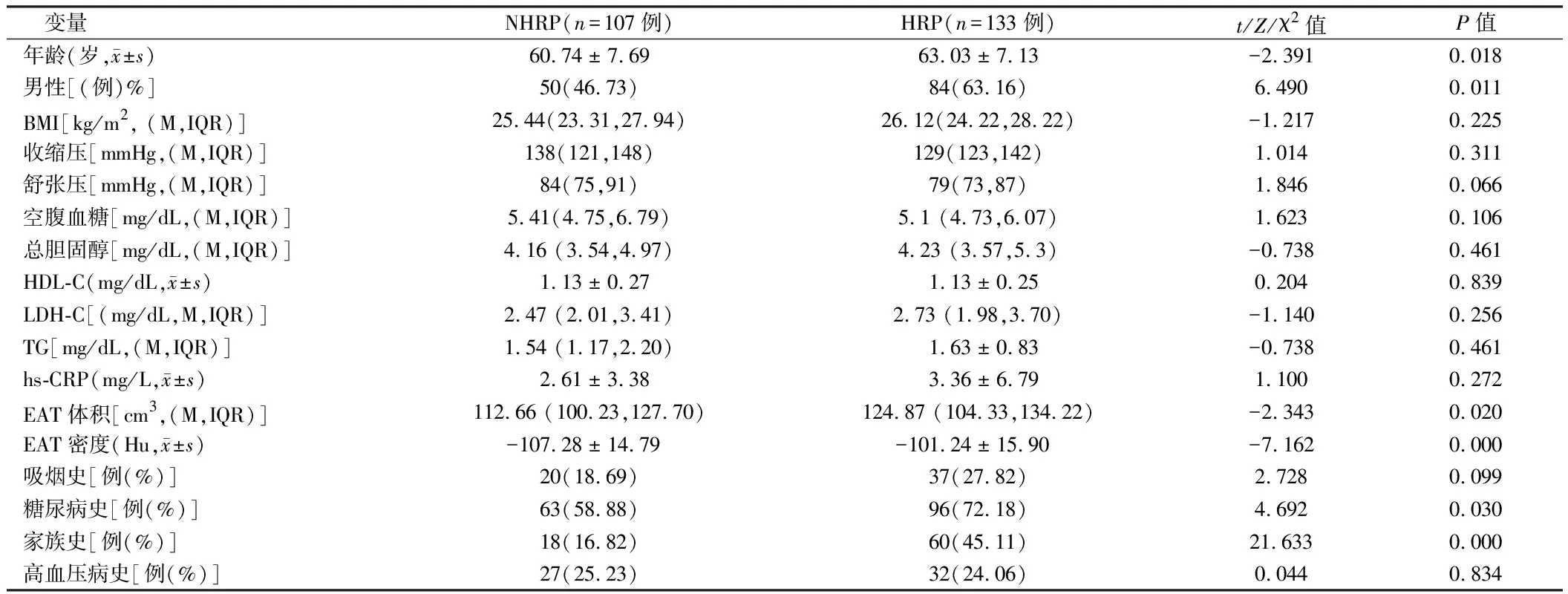
表2 2组患者基本资料、EAT参数比较
2.2 EAT体积及密度与冠脉Gensini积分的相关性分析 所有受试者EAT体积及Gensini积分呈正相关(r=0.667,P=0.0000.05);EATD与Gensini积分无相关性(r=0.060,P=0.3530.05)。见图5、6。
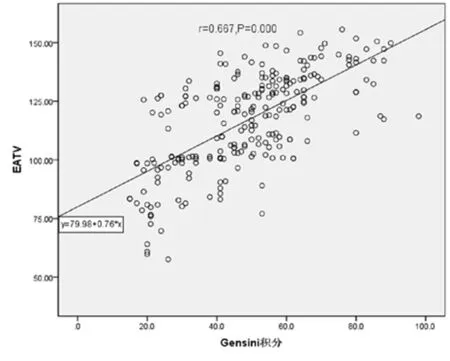
图5 所有受试者EATV与Gensini积分相关性
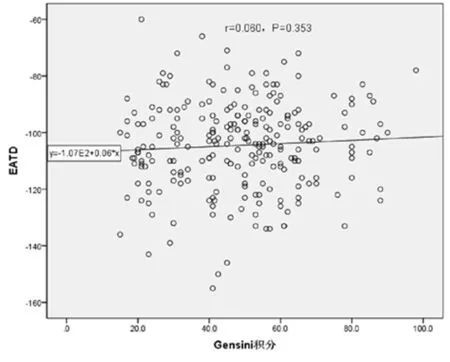
图6 所有受试者EATD及Gensini积分相关性
2.3 HRP影响因素的多变量Logistic回归分析 将是否高危斑块做为因变量,将表1单因素分析中2组间差异有统计学意义(P<0.05)的年龄、EAT体积、EAT密度、性别、家族史、糖尿病史作为自变量,建立多因素回归模型(α入=0.05,α出=0.05),变量筛选应用输入法。在校正了年龄、性别、家族史、糖尿病史后EAT体积(OR:1.018,95%CI:1.003~1.033,P<
0.05)及EAT密度(OR:1.076,95%CI:1.050~1.102,P<0.001)依然是冠心病患者高危斑块独立预测因子。见表3。
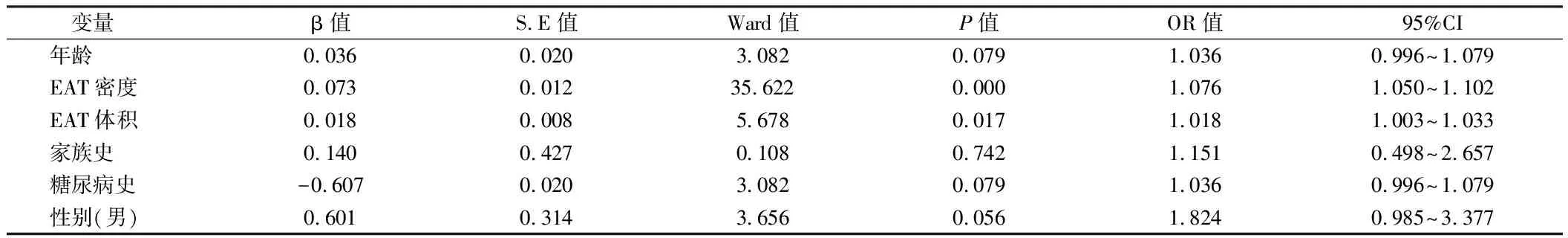
表3 多变量Logistic回归分析高危斑块影响因素
2.4 EAT密度、EAT体积对高危斑块预测价值比较 应用ROC曲线对EAT体积、EAT密度进行高危斑块预测价值分析,结果显示与EATV比较,EATD对高危斑块预测能力较高,EAT密度预测高危斑块的AUC为0.761,截止值为-100 Hu,敏感性62.4%,特异性为84.1%, EATV 预测高危斑块AUC为0.606,其截止值为118.58 cm3、敏感性 63.9%、特异性57.0%。见图7,表4。
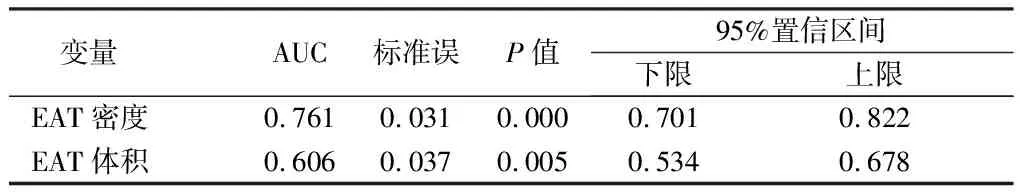
表4 EAT体积、EAT密度曲线下面积比较
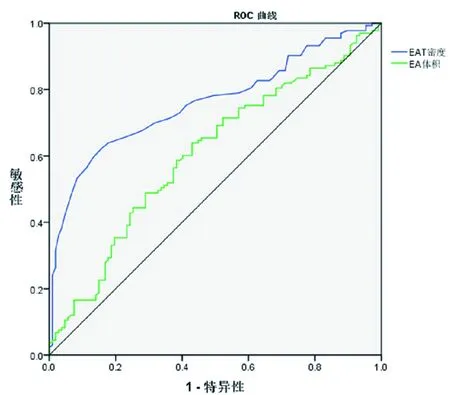
图7 EAT体积、EAT密度预测高危斑块风险的ROC曲线
3 讨论
研究证明,EAT体积增加不仅促进动脉粥样硬化发展并与不良冠心病预后呈正相关[12-14]。Nerlekar等[15]指出EAT体积与高危斑块显著相关,与无高危斑块组相比,高危斑块组患者EAT体积更高。马爱珍等[16]研究发现EAT为冠心病发生的独立危险因素,并与冠心病严重程度及病变支数存在正相关。周吉等[17]研究发现,EATV越大,冠状动脉狭窄程度越严重,斑块不稳定发生率越高。在我们的研究中,EAT体积的增加与高风险斑块及冠状动脉狭窄程度存在一致性。其机制可能为EAT通过内分泌、旁分泌功能,影响血管平滑肌细胞功能,引起细胞凋亡和新生血管形成加剧血管壁炎症及内膜斑块不稳定性[18],即EAT周围炎症环境引起血管外膜炎症向内发展,斑块形成,这正好也印证了血管周围脂肪组织“由外至内”的信号传递[19]。除了EAT体积外,EAT密度也越来越受到关注,放射密度反应了组织的物理和生化特性,EAT的密度随着脂肪细胞的肥大、增生而降低,随着脂肪组织血管化、纤维化、线粒体浓聚而增高[20,21]。本研究发现EAT密度在高危斑块组显著增高,其机制可能是因为在高危斑块组,斑块内炎性细胞增多。局部代谢增强,局部脂质消耗增多。另外冠状动脉壁的炎症信号也可通过“由内到外”血管分泌机制影响周围脂肪组织表型改变[19,22],阻止前脂肪细胞分化并触发其增殖,导致其CT值增高[23]。Kitagawa等[24]研究发现高危斑块周围脂肪密度的增高与18F-NaF的摄取有关。另外一项关于PET的研究发现激活的棕色脂肪存在高摄取,由于其丰富的血管、线粒体和脂质消耗增大,脂质含量的降低从而增加了放射密度[25,26],这些研究均与本研究结论相一致。
EAT与冠状动脉壁双向反馈回路引起心脏不良代谢反应,加速了冠状动脉炎症及斑块破裂。本研究在去除了年龄、性别、家族史、糖尿病史传统危险因素后EAT密度及体积依然是高危斑块的独立预测因子,EAT密度>-100 Hu时,冠状动脉壁可能处于更高的炎症状态及斑块破裂风险[27],在预测高危斑块层面,EAT密度可能是一个比EAT体积更敏感的标记物。最新研究表明易损斑块周围脂肪密度及心肌梗死急性期周围脂肪密度均显著增高[25],易损斑块的破裂被认为是ACS的主要原因,高危斑块的早期识别能有效降低ACS的发生。Oikonomou等[26]在CRISP-CT研究中证明了血管周围脂肪衰减指数对心脏死亡率有较高风险预测能力,指出更高的脂肪衰减值是心脏死亡和全因死亡增加的标志,所以通过EAT密度的测量可间接反应冠状动脉炎症状态,帮助评估冠状动脉斑块的易损性及冠心病危险分层。
此外,研究发现EAT体积与冠状动脉血管狭窄正相关,这与国内外学者研究[16,17,28]一致。EAT密度与Gensini积分之间无显著线性相关,这可能和所选受试者疾病状态有关,CHD是一个动态的过程,在疾病不同阶段,心外膜脂肪组织经历肥大、增生、分化受阻、炎性细胞(主要是巨噬细胞)浸润、纤维化不同病理状态,不同阶段可能伴随不同的周围脂肪组织表型[29-30],心外膜脂肪组织密度与冠脉狭窄程度之间有可能呈非线性关系,尚需进一步研究。
总之,EAT的生物学活性与冠状动脉斑块及狭窄之间关系复杂,目前,还没有一种成像工具能可视化功能异常的EAT,尽管EAT与高危斑块存在、冠脉狭窄密切相关[5],可帮助早期识别急性冠状动脉事件的高风险人群,但是尚需要进一步研究来比较CHD不同阶段EAT表型变化及生物学活性,进一步评估EAT是否成为CHD患者高危斑块新型药物潜在治疗靶点。

