“物质结构与性质”试题赏析
强玉荣
(扬州大学附属中学,江苏 扬州 225009)
“物质结构与性质”是高考的考查内容.现以2022年高考“物质结构与性质”试题为例,说明其考查方式与解题思路,仅供参考.
例1 (全国理综乙卷,节选)回答下列问题:
(1)下列选项中关于氟原子激发态的电子排布式正确的是____,其中能量较高的是____.(填标号)
①1s22s22p43d2②1s22s22p43s1
③1s22s22p33p2④1s22s12p5
(2)已知卤化物CsICl2在受热的条件下会发生非氧化还原反应,生成物为X、Y,其中Y为红棕色液体,X为无色晶体.则X为____.为什么X比Y的熔点高?
(3)已知NA为阿伏加德罗常数,α-AgI晶胞如图1所示,求α-AgI晶体的摩尔体积Vm=____m3·mol-1(列出算式).

图1 AgI晶胞
解析(1)F的原子序数为9,其基态原子电子排布式为1s22s22p5.①项,1s22s22p43d2,核外共10个电子,不是氟原子,①项错误;④项,1s22s12p5,核外共8个电子,不是氟原子,④项错误;②项,1s22s22p43s1,基态氟原子2p能级上的1个电子跃迁到3s能级上,属于氟原子的激发态,②项正确;③项,1s22s22p33p2,基态氟原子2p能级上的2个电子跃迁到3p能级上,属于氟原子的激发态,③项正确.而同一原子3p能级的能量比3s能级的能量高,因此能量最高的是1s22s22p33p2.
(2)在受热的条件下,CsICl2会发生非氧化还原反应,依据试题信息中给出的生成物颜色和状态,可以判断X为CsCl,Y为ICl,而CsCl为离子晶体,熔化时克服的是离子键,ICl为分子晶体,熔化时克服的是分子间作用力,因此CsCl的熔点比ICl高.


点评此题考查了激发态原子电子排布式与能量高低的判断、杂化轨道类型与共价键类型的判断、不同化合物分子中相同化学键键长长短的判断与其原因分析、晶体化学式的推断与晶体熔点高低的原因分析、晶体摩尔体积计算、晶体在电池中作用等方面的知识,综合性比较强,体现了“物质结构与性质”的主干知识[1].解题此题的关键为:一是要弄清电子排布式的意义;二是要掌握有机物分子中碳原子杂化方式与σ键、π键的判断方法;三是要掌握不同有机物分子中相同化学键键长长短的判断方法及其原因;四是能够判断出晶体的化学式和晶体类型;五是能够根据题意判断出α-AgI晶体在电池中的作用,并掌握晶胞粒子数与晶体摩尔体积的计算方法.
例2 (湖南化学卷,节选)铁、硒(Se)是人体所必需的微量元素,同时铁和硒被广泛地应用在材料、催化、医药等领域,回答下列问题:
(1)乙烷硒啉(Ethaselen)是一种抗癌新药,其结构式如下:

①基态Se原子的核外电子排布式为[Ar]____.
②该新药分子中有____种不同化学环境的C原子.
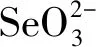
(2)富马酸亚铁(FeC4H2O4)是一种补铁剂.富马酸分子的结构模型如图2所示:

图2 结构模型
①富马酸分子中σ键与π键的数目比为____.
②富马酸亚铁中各元素的电负性由大到小的顺序为____.

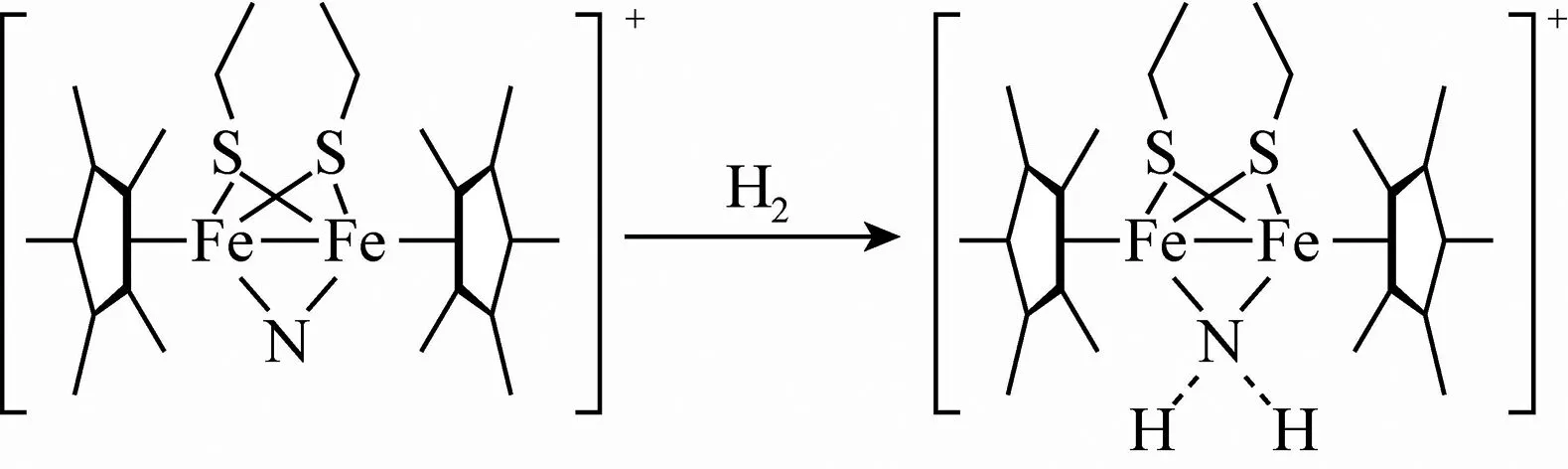
图3 反应过程
①在反应的产物中,N原子的杂化轨道类型为____.

(4)已知一种由铁、钾、硒形成晶胞在xy平面、xz平面、yz平面的投影如图4所示.

图4 投影图
阿伏加德罗常数的值为NA,图4中a=0.4 nm、b=0.4 nm、c=1.4 nm.则由铁、钾、硒形成晶胞的密度为____g·cm-3,并列出计算式.
解析(1)①硒元素的原子序数为34,则基态原子的电子排布式为[Ar]3d104s24p4.
②由结构简式可知,乙烷硒啉的分子结构对称,分子中含有8种化学环境不同的C原子.


②金属元素的电负性小于非金属元素,则铁元素的电负性最小,非金属元素的非金属性越强,电负性越大,氢、碳、氧的非金属性依次增强,电负性依次增大,则富马酸亚铁中四种元素的电负性由大到小的顺序为O>C>H>Fe.
(3)①由产物的结构简式可知,产物中氮原子的价层电子对数为4,则氮原子的杂化方式为sp3杂化.



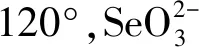
(2)①11∶3;②O>C>H>Fe;
(3)①sp3杂化;②H2O.
点评此题考查了基态原子价电子排布式的书写、分子中不同化学环境碳原子数的判断、键角大小的比较、分子中σ键与π键的数目比的计算、元素电负性大小的比较、中心原子杂化类型的判断、等电子体化学式的书写、配位数的判断、晶体化学式与晶体密度的计算等[2].解题的要领为:一是要掌握基态原子价电子排布式的写法;二是明确在分子中不同化学环境碳原子数的判断方法;三是要掌握键角大小的比较方法(首先计算出中心原子的价层电子对数,然后判断出粒子的空间构型,再根据空间构型比较键角的大小);四是要掌握σ键与π键的判断方法;五是要掌握元素电负性大小的比较方法;六要掌握中心原子杂化类型的判断方法;七是要掌握等电子体的书写方法;八是要能够根据晶体的平面投影图判断出各种原子在晶体中所处位置,从而判断出配位数,并要掌握晶体化学式和晶体密度的计算方法.
总之,新高考背景下,“物质结构与性质”试题常常将化学知识融入具体的情境中,要求学生能够依据新材料或是试题给出的物质反应等信息,结合“物质结构与性质”的主干知识,对实际的问题进行分析,并综合运用“物质结构与性质”知识解决问题,体现高考对学生核心素养的考查要求.

