富硒蛹虫草多糖的结构表征及体外免疫调节活性
姚艳婷,杨小兵,陈旭洁,陈忠正,林晓蓉,张媛媛,向 杰,陈少丹,焦春伟,李 斌,*,高 雄,*
(1.华南农业大学食品学院,广东 广州 510642;2.广东省科学院微生物研究所,华南应用微生物国家重点实验室,广东省微生物安全与健康重点实验室,广东 广州 510070;3.广东粤微食用菌技术有限公司,广东 广州 510663;4.广东粤微生物科技有限公司,广东 肇庆 526000)
蛹虫草(Cordyceps militaris)又称北冬虫夏草、北虫草,属于真菌界、子囊菌门、肉座菌目、麦角菌科,为虫草属的模式种[1]。据报道,蛹虫草含有虫草多糖、虫草素、虫草酸等多种活性成分[2],其中,多糖是蛹虫草的重要活性成分之一,具有免疫调节、抗肿瘤、抗氧化以及降血糖等功能活性,备受研究者的关注[3-6]。多糖的结构是其生物活性的基础,但因结构或理化性质等原因,有些多糖的生物学活性难以发挥,因此,采取一些方法对蛹虫草多糖结构适当修饰,改变多糖理化特性,增加其生物活性。
硒(Se)是人体必需的微量元素之一,参与维持机体的健康与生长发育,具有抗氧化、抗癌、免疫调节、预防克山病等生理功能[7]。但硒不能在人体内合成,必须从食物中获取,而全球多个地区属于缺硒区,至少有1亿人缺硒[8-9]。且亚硒酸钠等传统硒补充剂的安全剂量范围较窄(60~400 μg/d)[10],摄入过量容易引起神经系统和心血管等方面的疾病[11],因此,开发安全健康的富硒产品对人体营养健康等具有重要意义。
前人研究证明,利用灰树花、平菇等食用菌,通过生物转化的方式富集硒,可获得有生物价值的富硒多糖[12-14]。富硒蛹虫草已实现人工培育,且开展了富硒蛹虫草多糖的提取分离、结构特性、生物活性等研究[15-17],但对其免疫调节活性的研究仍鲜有报道,活性作用的机制更有待阐明。为此,本研究从富硒蛹虫草子实体中分离纯化出一种多糖组分SeCMP0.2,对其结构特性表征,并利用小鼠单核巨噬细胞RAW264.7模型探究其体外免疫调节活性,以期为富硒蛹虫草多糖资源的综合利用和新型健康的硒源产品开发,提供前期的研究基础。
1 材料与方法
1.1 材料与试剂
富硒蛹虫草子实体 广东粤微食用菌技术有限公司;小鼠单核巨噬细胞RAW264.7 美国典型培养物保藏中心;杜氏改良高糖培养基(Dulbecco’s modified eagle medium,DMEM)美国HyClone公司;胎牛血清 美国Gibco公司。
BCA蛋白定量试剂盒、RIPA缓冲液、Bis-Tris预制胶、增强化学发光试剂 美国Thermo Fisher Scientific公司;刚果红 北京索莱宝科技有限公司;MOPS电泳缓冲液(20×)、5×蛋白上样缓冲液、10×Tris含吐温-20缓冲盐溶液(tris buffered saline with Tween-20,TBST)生工生物工程(上海)股份有限公司;N,N-二羟乙基甘氨酸、二(2-羟乙基)亚氨基三(羟甲基)甲烷、乙二胺四乙酸 上海麦克林生化科技有限公司;CCK-8试剂盒、蛋白酶抑制剂、磷酸化蛋白酶抑制剂美国MedChemExpress公司;抗体p-NF-κB p65、NF-κB p65、IκBα、p-p38、p38、GAPDH 美国Cell Signaling Technology公司;抗体p-ERK、ERK 美国Affinity Biosciences公司;抗体p-JNK、JNK 美国Abcam公司;单糖标准品(岩藻糖、盐酸氨基半乳糖、鼠李糖、阿拉伯糖、盐酸氨基葡萄糖、半乳糖、葡萄糖、N-乙酰-D-氨基葡萄糖、木糖、甘露糖、果糖、核糖、半乳糖醛酸、古罗糖醛酸、葡萄糖醛酸、甘露糖醛酸)扬州市博睿糖生物科技有限公司;台盼蓝、磺胺、牛血清蛋白、N-(1-萘基)乙二胺二盐碱、脂多糖(lipopolysaccharides,LPS)、乙酸酐、硼氘化钠 美国Sigma公司。
1.2 仪器与设备
BT 25s电子天平 瑞士Mettler Toledo公司;Alpha 1-2 LD plus冷冻干燥机 德国Martin Christ公司;5804R冷冻离心机 德国Eppendorf公司;OmegaLum G化学发光仪 美国Aplegen公司;7890A-5977B气相色谱-质谱(gas chromatography-mass spectrometry,GCMS)联用仪 美国Agilent公司;BG-Power 600电泳仪北京百晶生物技术有限公司;VersaMax酶标仪 美国Molecular Devices公司;UV-2102C紫外-可见分光光度计尤尼柯(上海)有限公司;HERAcell 150i CO2培养箱美国Thermo Scientific公司;Vertex 70红外光谱仪、Avance II 600 MHz核磁共振波谱仪 德国Bruck公司;Milipore-Q超纯水机 德国Milipore公司;100 kDa截留分子质量超滤膜 德国Sartorius公司。
1.3 方法
1.3.1 富硒蛹虫草多糖的制备
参考Gao Xiong等[18]的方法,并略作修改。将富硒蛹虫草子实体粉碎过40 目筛,按料液比(1∶20,g/mL)加入体积分数95%乙醇溶液,75 ℃水浴提取2 h,重复2 次。滤渣干燥后,加入超纯水(1∶20,g/mL),80 ℃水浴提取3 h,重复2 次。合并2 次滤液,使用旋转蒸发仪在60 ℃条件下减压浓缩,浓缩液用4 倍体积的无水乙醇溶液混匀,4 ℃静置16 h,6 000 r/min、25 ℃离心10 min,沉淀用超纯水复溶,Sevag试剂(三氯甲烷∶正丁醇,4∶1)除蛋白,将上层多糖溶液用3 500 Da透析袋透析72 h,冷冻干燥,获得富硒蛹虫草粗多糖。
1.3.2 富硒蛹虫草多糖的分离纯化
将富硒蛹虫草粗多糖重新溶解于超纯水中,经100 kDa截留分子质量超滤膜处理,获得分子质量大于100 kDa的超滤组分。取180 mg分子质量大于100 kDa的超滤组分溶解于6 mL超纯水,过DEAE-52离子交换柱(3.5 cm×30 cm),采用0~0.5 mol/L NaCl溶液梯度洗脱,流速为2.5 mL/min,苯酚-硫酸法检测洗脱液多糖含量。将0.2 mol/L NaCl溶液洗脱得到的多糖组分透析、冻干,得到富硒蛹虫草纯化单一多糖组分,命名为SeCMP0.2。
1.3.3 富硒蛹虫草多糖的结构表征
1.3.3.1 重均分子质量(mw)测定
参考Zhou Ning等[19]的方法,稍作修改。利用高效渗透凝胶色谱(high performance gel filtration chromato graphy,HPGPC)仪测定SeCMP0.2的重均分子质量。利用Waters ACQUITY APC AQ 900和ACQUITY AQ 450柱(4.6 mm×150 mm,2.5 μm),柱温为35 ℃,流速为0.4 mL/min,流动相为100 mmol/L NaNO3溶液。将SeCMP0.2与葡聚糖系列标准品(5.2、11.6、23.8、48.6、148.0、273.0、410.0 kDa和668.0 kDa)用100 mmol/L NaNO3溶液溶解,过膜进样,根据标准曲线计算SeCMP0.2的mw。
1.3.3.2 硒含量测定
准确吸取1 mL SeCMP0.2(质量浓度2 mg/mL)水溶液于消解管中,加入0.5 mL硝酸和0.5 mL盐酸,室温放置约15 min,将样品消解管放入电热消解仪中加热消解,样品完全消解后,冷却至室温,用超纯水定容至10 mL,采用电感耦合等离子体质谱仪测定硒含量。
1.3.3.3 紫外-可见光谱分析
将富硒多糖粉末用超纯水配成质量浓度为0.25 mg/mL的溶液。在紫外-可见光分光度计190~400 nm波长范围内扫描,记录紫外-可见光谱图。
1.3.3.4 单糖组成分析
参考Wang Shiqiang等[20]的方法,取5 mg富硒多糖,加入2 mL的3 mol/L三氟乙酸溶液,120 ℃水解3 h,转移至氮吹管中吹干,加入5 mL超纯水涡旋混匀,取50 μL用超纯水稀释20 倍,12 000 r/min离心5 min。取上清液检测单糖组成。
采用离子色谱系统(ICS 5000),DionexTMCarboPacTMPA20(150 mm×3.0 mm)液相色谱柱,流动相A:水;流动相B:15 mmol/L NaOH、100 mmol/L NaOAc;进样体积为5 μL;流速为0.3 mL/min;柱温为30 ℃,用电化学检测器分析检测。
1.3.3.5 红外光谱分析
取适量富硒多糖冻干粉与溴化钾粉末混合研磨压片,在Vertex 70红外光谱仪中进行扫描,扫描范围为4 000~400 cm-1。
1.3.3.6 甲基化分析
参考Zhu Minqian等[21]的方法,取3 mg富硒多糖,加入二甲基亚砜和氢氧化钠粉末,孵育30 min,避光加入1 mL碘甲烷,甲基化反应1 h,121 ℃用2 mol/L三氟乙酸水解1.5 h,经硼氘化钠还原,并用乙酸酐乙酰化。将乙酰化产物溶解在二氯甲烷中,GC-MS上机检测。
采用气相色谱系统,BPX70(30 m×0.25 mm,0.25 μm)色谱柱。进样量1 μL,分流比10∶1,载气为氦气,流速1.5 mL/min;柱温箱的初始温度为140 ℃保持2 min,以3 ℃/min程序升温至230 ℃,保持3 min。采用四极杆质谱检测系统,用电子电离源,在全扫描模式下分析检测,质量扫描范围m/z50~350。
1.3.3.7 核磁共振波谱分析
取50 mg富硒多糖溶解于0.5 mL氘代水中,充分溶解后冻干,重复1 次,使用核磁共振(nuclear magnetic resonance,NMR)光谱仪扫描记录一维图谱(1H-NMR和13C-NMR)。
1.3.3.8 三螺旋结构分析
参考Xiong Feng等[22]的方法,取0.25 mL富硒多糖溶液(质量浓度1 mg/mL)与0.5 mL刚果红试剂(浓度80 μmol/L)混合,逐滴加入NaOH溶液,使其终浓度依次为0~0.5 mol/L,反应体系避光放置10 min后,用分光光度计扫描反应溶液在450~550 nm范围内的最大吸收波长λmax,对照组以超纯水替代富硒多糖溶液。
1.3.3.9 原子力显微镜(atomic force microscope,AFM)观察分子形貌
将富硒多糖溶于超纯水中,配制成质量浓度为5 μg/mL溶液,吸取5 μL样液滴入云母片,用玻璃瓶固定,风干1.5 h,在AFM下观察形貌。
1.3.4 SeCMP0.2免疫调节活性评价
1.3.4.1 细胞存活率测定
取对数生长期的RAW264.7细胞,以5×105个/mL的浓度接种到96 孔板中,每孔200 μL,在37 ℃、含有5% CO2的恒温培养箱中培养24 h后,弃去上清液,加入不同浓度的富硒多糖样品或阳性对照LPS,以正常培养基作为空白对照,培养24 h,弃去上清液,每孔加入含有1.5% CCK-8的无血清DMEM培养基200 μL,继续培养1.5 h,用酶标仪测定450 nm波长处的吸光度,细胞存活率按下式计算:
式中:Ai为实验组的吸光度;A0为对照组的吸光度。
1.3.4.2 NO含量测定
RAW264.7细胞培养、接种、加样方式同1.3.4.1节,处理24 h后,采用Griess试剂测定NO含量。步骤如下:样品处理24 h后,每孔取100 μL细胞上清液转移至新96 孔板中,加入等体积的Griess试剂,混匀,避光静置10 min,使用酶标仪测定在542 nm波长处的吸光度,以NaNO2制作标准曲线(6.25~100 μmol/L)。
1.3.4.3 mRNA表达量测定
以5×105个/mL的浓度接种RAW264.7细胞到60 mm2的培养皿中,每皿4 mL,在37 ℃、含有5% CO2的恒温培养箱中培养24 h后,弃去上清液,加入不同浓度的富硒多糖样品或阳性对照LPS,以正常培养基作为空白对照,培养24 h后,吸去上清液,4 ℃加入杜氏磷酸缓冲液(Dulbecco’s phosphate buffered saline,DPBS)洗细胞2 遍,加入1 mL Trizol试剂。使用逆转录酶将RNA反转录成cDNA。采用实时聚合酶链式反应(real-time polymerase chain reaction,real-time PCR)测定诱导型一氧化氮合成酶(inducible nitric oxide synthase,iNOS)、肿瘤坏死因子-α(tumor necrosis factor-α,TNF-α)、白细胞介素-6(interleukin-6,IL-6)、白细胞介素-1β(interleukin-1β,IL-1β)的mRNA表达情况,以β-actin为内参基因,引物序列见表1。反转录及real-time PCR参数设置参照试剂盒说明书进行。

表1 基因引物序列Table 1 Primer sequences used in this study
1.3.4.4 Western blot检测激活丝裂原活化蛋白激酶(mitogen-activated protein kinases,MAPKs)、核因子-κB(nuclear facter-κB,NF-κB)信号通路相关蛋白
以5×105个/mL的浓度接种RAW264.7细胞到60 mm2的培养皿中,每皿6 mL,在37 ℃、含有5% CO2的恒温培养箱中培养24 h,弃去上清液,加入不同浓度的富硒多糖样品或阳性对照LPS,以正常培养基作为空白对照,继续孵育30 min,加入2 mL预冷的DPBS洗2 遍培养皿,然后每皿加入300 μL RIPA裂解液(含蛋白酶抑制剂和磷酸酶抑制剂),充分裂解后,4 ℃、16 000×g离心1 min,吸取上清液,即为细胞总蛋白,蛋白含量采用BCA蛋白质分析试剂盒进行测定。将细胞总蛋白与上样缓冲液按4∶1体积比混合,95 ℃金属浴5 min。冷却后,取40 μg蛋白进行十二烷基硫酸钠-聚丙烯酰胺凝胶电泳后,将凝胶上蛋白转印至PVDF膜,TBST溶液洗膜3 次,每次5 min,将PVDF膜置于5%脱脂奶粉(TBST溶液配制)中室温封闭1 h,一抗(p-ERK、ERK、p-JNK、JNK、p-p38、p38、p-NF-κB p65、NF-κB p65、IκBα、GAPDH)4 ℃孵育过夜;洗膜4 次,每次5 min后,加入辣根过氧化物酶标记的二抗,室温孵育1 h,洗膜4 次,每次5 min后,以化学发光试剂盒进行显影,在OmegaLum G化学发光凝胶成像系统中观察并拍照记录结果。
1.4 数据处理
2 结果与分析
2.1 SeCMP0.2结构特性分析
2.1.1 SeCMP0.2分子质量及纯度分析
通过水提醇沉、除蛋白,结合阴离子交换层析柱法分离纯化,从富硒蛹虫草子实体中获得多糖组分SeCMP0.2,经HPGPC仪测得的分子质量分布如图1所示。SeCMP0.2的mw为440.7 kDa,分子质量分散指数为1.4,表明SeCMP0.2为均一多糖。由电感耦合等离子体质谱仪分析测定可知,SeCMP0.2的硒含量为49.1 μg/g。由图2可知,SeCMP0.2在260 nm和280 nm波长处均无明显特征吸收峰,说明其几乎不含核酸和蛋白质类物质,纯度较高。

图1 SeCMP0.2的HPGPC图Fig.1 HPGPC chromatogram of SeCMP0.2

图2 SeCMP0.2的紫外-可见吸收光谱图Fig.2 UV-visible spectrum of SeCMP0.2
2.1.2 SeCMP0.2的单糖组成分析
采用离子色谱分析SeCMP0.2的单糖组成,结果如图3所示。SeCMP0.2主要由半乳糖、葡萄糖、甘露糖组成,这3 种单糖的含量依次为53.1%、8.2%、37.1%。另外,SeCMP0.2的半乳糖醛酸和古罗糖醛酸含量分别为1.1%和0.5%,表明该糖为杂多糖。

图3 单糖标准品和SeCMP0.2的离子交换色谱图Fig.3 Ion exchange chromatograms of monosaccharide standards and SeCMP0.2
2.1.3 SeCMP0.2的红外光谱分析
如图4 所示,SeCMP 0.2 在3370.61 cm-1处的特征吸收峰为O—H伸缩振动,2 923.67 cm-1和2 853.18 cm-1处的吸收峰分别由—CH2的对称伸缩振动和C—H的伸缩振动所致[23],这是糖类物质的2 个特征吸收峰[24]。进一步分析发现,1 656.36 cm-1处是C=O伸缩振动吸收峰,1 541.35 cm-1处可能为N—H弯曲振动吸收峰[25],1 457.46 cm-1处为C—H变角振动吸收峰[26],1 412.46 cm-1处为C—H弯曲振动吸收峰[27],1 221.23 cm-1处由C—O不对称伸缩振动引起[28],1 000~1 200 cm-1范围内为C—O—C和C—O—H伸缩振动的特征吸收峰,表明SeCMP0.2存在吡喃糖环结构[29],在892.51 cm-1处的吸收峰说明存在β-糖苷键和呋喃糖环结构,在814.60 cm-1和577.91 cm-1处的吸收峰说明存在α-糖苷键[30],表明SeCMP0.2同时含有α和β构型糖基。

图4 SeCMP0.2的红外光谱图Fig.4 Infrared spectrum of SeCMP0.2
2.1.4 SeCMP0.2的甲基化分析
为进一步获得SeCMP0.2的结构信息,采用GC-MS分析SeCMP0.2的糖苷键类型,结果如表2所示。SeCMP0.2中末端残基、分支残基和线性残基的种类分别有3、6 种和6 种。SeCMP0.2的优势残基T-Galp-(1→、→2)-Galp-(1→、→6)-Manp-(1→分别占16.6%、29.4%、26.9%。其他残基占比较小,均低于10%。说明SeCMP0.2主要以半乳糖和甘露糖糖苷键连接,少量以葡萄糖糖苷键连接,与单糖组成的分析结果一致。

表2 SeCMP0.2的甲基化分析数据Table 2 Methylation analysis data of SeCMP0.2
2.1.5 SeCMP0.2的NMR波谱分析
SeCMP0.2的1H-NMR和13C-NMR波谱分析结果如图5所示。化学位移主要集中在δ(H)3.0~5.3和δ(C)50.0~110.0,属于多糖信号峰。在δ(H)4.3~5.3和δ(C)98.0~108.0出现的异头信号表明,SeCMP0.2存在α和β构型糖基[31-32]。一般异头氢信号高于5.0,在α构型中有化学置换,而异头氢信号低于5.0,在β构型中有化学置换[33]。从图5A可以看出,SeCMP0.2在δ(H)5.0~5.3处的异头氢信号较强,而在δ(H)4.3~5.0处的异头氢信号相对较弱,说明SeCMP0.2以α构型糖基为主。从图5B可见,SeCMP0.2的糖苷键异头碳信号出现在δ(C)98.3~108.1,δ(C)170.0~175.0范围内有2 个微弱的糖醛酸特征信号吸收峰,说明SeCMP0.2是酸性多糖[34]。这些结果与上述红外光谱、单糖组成的分析结果一致。

图5 SeCMP0.2的核磁共振波谱图Fig.5 NMR spectra of SeCMP0.2
2.1.6 SeCMP0.2的三螺旋结构分析
刚果红是一种酸性试剂,在一定NaOH浓度范围内,可与具有三螺旋结构的多糖形成络合物,其最大吸收波长λmax与刚果红对照组相比发生红移,以此鉴定多糖中是否存在三螺旋结构[35]。如图6所示,与刚果红对照组相比,SeCMP0.2-刚果红溶液在NaOH浓度0.05~0.4 mol/L范围内发生红移,在NaOH浓度为0.3 mol/L时,其λmax发生位移最大,达到7.5 nm。已有研究表明,食用菌来源的香菇多糖[36]、灵芝多糖[37]及猴头菇多糖[38]也具有三螺旋结构,在刚果红溶液中发生类似的红移现象。由此说明,SeCMP0.2存在三螺旋结构。

图6 不同浓度NaOH下刚果红及其多糖复合物的最大吸收波长Fig.6 Maximum absorption wavelengths of Congo red-polysaccharide complex and Congo red at different concentrations of NaOH
2.1.7 SeCMP0.2的分子形貌观察
采用AFM观测SeCMP0.2在水溶液中的糖链形貌和尺寸。从图7A平面图可见,SeCMP0.2在水溶液中呈现大量不规则球形颗粒。图7B显示出许多山状突起,部分糖链高度在1.0~2.5 nm之间,而单个糖链高度介于0.1~1.0 nm之间[39],表明SeCMP0.2在水溶液中会发生聚集,并不是都以单个糖链分子存在。类似现象在蛹虫草多糖[40]、白肉灵芝多糖[18]中也有发现,可能是由于多糖通过分子间氢键及范德华力发生相互缠绕[32],形成不规则的聚集体所致。

图7 SeCMP0.2的AFM图Fig.7 AFM spectra of SeCMP0.2
2.2 SeCMP0.2的免疫调节活性
2.2.1 SeCMP0.2对RAW264.7细胞增殖和NO产生的影响
由图8A可知,与对照组相比,SeCMP0.2质量浓度为100 μg/mL和200 μg/mL时,细胞存活率分别为104.5%和102.8%,对细胞有一定的促进增殖作用;当质量浓度为400 μg/mL和800 μg/mL时,细胞存活率分别为95.4%和94.8%,但与对照组均无显著差异。NO作为一种重要的信号传导介质,参与免疫应答相关的生理过程[41],因此本研究进而采用Griess试剂法测定细胞培养上清液中的NO2-含量,以反映NO产生量,结果如图8B所示。与对照组(2.7 μmol/L)相比,SeCMP0.2质量浓度在200、400、800 μg/mL时,可显著促进RAW264.7细胞产生NO,产生量依次为6.9、12.4、15.9 μmol/L,而在100 μg/mL时无显著促进作用。因此,为更好地研究SeCMP0.2的免疫活性机理,选择400~800 μg/mL开展后续实验。

图8 SeCMP0.2对RAW264.7细胞存活率和NO产生的影响Fig.8 Effect of SeCMP0.2 on cell viability and NO production in RAW264.7 cells
2.2.2 SeCMP0.2对RAW264.7细胞炎症因子mRNA表达水平的影响
为探究SeCMP0.2对RAW264.7细胞炎症因子转录的调控作用,本研究采用real-time PCR检测iNOS、TNF-α、IL-6、IL-1βmRNA的表达水平,结果如图9所示。与对照组相比,用400 μg/mL和800 μg/mL的SeCMP0.2处理后,显著提高RAW264.7细胞iNOS、TNF-α、IL-6、IL-1βmRNA的表达水平。在质量浓度为800 μg/mL时,上述4 种细胞炎症因子mRNA的表达量依次为对照组的2.1、2.0、12.8、83.2 倍。巨噬细胞通过产生各种炎症因子,如NO、TNF-α、IL-6、IL-1β等发挥其免疫功能。NO的产生受诱导型iNOS调控,是巨噬细胞被激活的重要标志[42]。TNF-α、IL-6、IL-1β等细胞因子的产生可有效激活其他免疫细胞,刺激先天免疫应答从而发挥免疫调节作用[43]。结果表明,SeCMP0.2可在转录水平上促进RAW264.7细胞中相关炎症因子mRNA表达。

图9 SeCMP0.2对RAW264.7细胞炎症介质mRNA表达水平的影响Fig.9 Effect of SeCMP0.2 on the mRNA expression levels of inflammatory mediators in RAW264.7 cells
2.2.3 SeCMP0.2对RAW264.7细胞MAPKs和NF-κB信号通路的影响
为探究SeCMP0.2的免疫调节活性是否受MAPKs、NF-κB信号通路调控,本研究采用Western blot技术检测信号通路相关蛋白的表达水平。由图10可知,与对照组相比,以400、800 μg/mL的SeCMP0.2处理RAW264.7细胞后,能显著提高JNK、ERK、p38蛋白的磷酸化水平,当质量浓度为800 μg/mL时,p-JNK、p-ERK、p-p38蛋白表达量分别为对照组的2.3、1.6、1.2 倍。由图11可知,与对照组相比,400、800 μg/mL的SeCMP0.2处理能够显著提高NF-κB p65蛋白的磷酸化水平,降低IκBα蛋白的表达量,当质量浓度为800 μg/mL时,p-NF-κB p65和IκBα蛋白表达量分别为对照组的1.6 倍和0.3 倍。NF-κB是巨噬细胞发挥免疫活性的一种关键转录因子,在未激活状态下,其以二聚体的形式存在于细胞质中,与IκB蛋白形成复合物而受到抑制[34]。当巨噬细胞被激活时,NF-κB或IκB蛋白磷酸化而导致复合物解体,IκB蛋白进一步被泛素化而降解,NF-κB从细胞质转移到细胞核中,与相应的炎症相关基因结合,进而启动炎症因子转录[44]。MAPKs是一种具有丝氨酸/苏氨酸特异性的蛋白激酶家族,主要包含JNK、ERK和p38三条信号途径[45]。Ren Daoyuan等[46]研究发现从草本绞股蓝茶中提取得到的酸性多糖GPTP-3可激活巨噬细胞MAPKs信号通路,引起NF-κB蛋白磷酸化而促进其入核表达。Chen Qian等[47]从野生大红菇中分离得到多糖组分PRG1-1可通过MAPKs、NF-κB信号通路激活巨噬细胞而起到免疫增强作用。通过上述结果分析可知,SeCMP0.2可通过激活MAPKs和NF-κB信号途径,促进炎症因子的转录,从而发挥免疫调节作用。

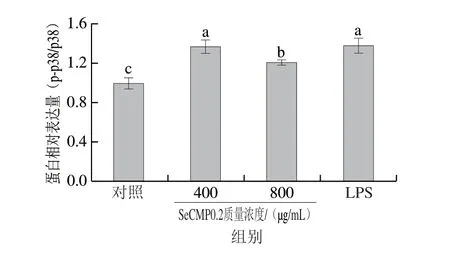
图10 SeCMP0.2对RAW264.7细胞MAPKs信号通路相关蛋白表达水平的影响Fig.10 Effect of SeCMP0.2 on the expression levels of proteins associated with the MAPK signaling pathway in RAW264.7 cells

图11 SeCMP0.2对RAW264.7细胞NF-κB信号通路相关蛋白表达水平的影响Fig.11 Effect of SeCMP0.2 on the expression levels of proteins associated with the NF-κB signaling pathway in RAW264.7 cells
3 结论
本研究从富硒蛹虫草子实体中成功分离出纯度高、均一性好的多糖组分SeCMP0.2,其重均分子质量为440.7 kDa,分子质量分散指数为1.4,硒含量为49.1 μg/g,具有典型的多糖官能团和三螺旋结构,在水溶液中会发生聚集。SeCMP0.2是一种以半乳糖(53.1%)、葡萄糖(8.2%)、甘露糖(37.1%)为主的杂多糖,其优势残基为T-Galp-(1→、→2)-Galp-(1→、→6)-Manp-(1→,且同时含有α和β构型糖基,且以α构型糖基为主。免疫活性研究表明,SeCMP0.2可激活RAW264.7细胞中的MAPKs、NF-κB信号途径,促进iNOS、TNF-α、IL-6、IL-1βmRNA等炎症因子表达,从而发挥免疫调节作用。本研究为富硒蛹虫草资源开发成功能性食品,作为缺硒和免疫力低下人群的免疫调节剂,拓展健康硒源产品提供一定的科学依据。

