不同碳氮比对生物絮凝技术(BFT)养殖水体中土腥味物质积累量的影响
崔佳勤,章海鑫,2,罗国芝,3,4,谭洪新,3,4
(1 上海海洋大学上海水产养殖工程技术研究中心,上海 201306;2 江西省水产科学研究所,江西 南昌 330039;3 上海市水产动物良种创制与绿色养殖协同创新中心,上海 201306;4 上海海洋大学水产科学国家级实验教学示范中心,上海 201306)
土腥味物质包括多种化学物质,组成复杂,其中二甲基异莰醇(2-Methylisoborneol,2-MIB)和土臭素(Geosmin,GSM)是主要组成成分[1]。2-MIB和GSM在水中的人体嗅觉阈值分别是5~10 ng/L和1~10 ng/L[2],在鱼肉中的嗅觉阈值分别为0.6 μg/kg和0.9 μg/kg[3-4],因此,即使较低浓度的土腥味物质也会对水产品品质造成巨大的影响。研究表明,2-MIB和GSM主要是由放线菌和以蓝藻为首的浮游藻类分泌并传播到水中的[5-8],鱼虾养殖过程中的残饲、排泄物促进了养殖水体中蓝藻和细菌的生长,需要控制鱼虾养殖过程中土腥味物质的浓度。
生物絮凝技术(Biofloc technology,BFT)具有净化水质,促进养殖动物生长和增强机体免疫的作用[9-10]。由于放线菌是生物絮团结构的重要组成部分[10],且在零换水的BFT养殖模式下,更易导致土腥味物质的产生和积累。有研究表明BFT养殖斑点叉尾鮰试验结束时水体中的GSM质量浓度高达396 ng/L[11]。因此,BFT养殖过程中的土腥味问题也需要引起高度重视。目前的研究主要集中在去除水体和鱼体中已经积累的GSM和2-MIB[12-14]。而调控BFT养殖中的环境因子,可以对这两种物质的产生源头进行控制,有效改善水产品土腥味问题,碳氮比在生物絮团的形成和改善水质的过程中是比较重要的影响因素。
本研究通过改变碳源的添加量,设置不同的初始DOC/DIN(Dissolved Organic Carbon,DOC;Dissolved Inorganic Nitrogen,DIN)梯度,探究BFT水体中的C/N对GSM和2-MIB这两种物质积累量的影响,对土腥味物质发生源头进行适当的抑制和有效的防控,为提高BFT养殖的水产品品质提供参考。
1 材料与方法
1.1 生物絮团装置
本试验选用9个10 L聚乙烯透明桶作为试验反应器,每个桶工作容积为8 L,用透明硅胶软管(内径5 mm、外径7 mm)一端连接罗茨鼓风机(型号HG-750,森森集团股份有限公司),另一端接入石英曝气石沉于桶底正中央曝气,控制溶氧(Dissolved Oxygen,DO)>8 mg/L。分别以葡萄糖(C6H12O6,国药集团化学试剂有限公司)作为有机碳源和鱼用膨化饲料磨成粉作为氮源,饲料由南昌湘大骆驼饲料有限公司加工制作,含36.25%粗蛋白、8.12%粗脂肪、10.26%粗灰分及9.31%水分,并添加碳酸氢钠(NaHCO3)控制碱度为200~230 mg/L。每个桶放入加热棒(型号CN-008-50 W,中山市日宝电器有限公司)设置温度(Temperature,T)为25℃。
1.2 试验设计

试验分为A、B和C共3个组,每组设置3个平行(n=3),每组投入30 g饲料,其中A组为对照组,不添加葡萄糖;B、C组添加葡萄糖调节C/N分别为10和20,试验设置为7 d。该试验周期参考Man等[13]研究使用BFT-SGRs去除养殖水中的GSM和2-MIB试验与魏继红等[15]研究不同C/N对生物絮凝硝化作用强度的影响试验。
2 试验指标与检测方法
2.1 水质理化指标

2.2 絮团营养指标
取试验开始和结束时的絮团,粗灰分测定采用高温灼烧法[17],粗蛋白测定采用杜马斯燃烧定氮法[18],粗脂肪的测定采用索氏抽提法使用石油醚提取[19]。
2.3 BFT水体中GSM和2-MIB含量测定
GSM和2-MIB的标准曲线如图1所示。
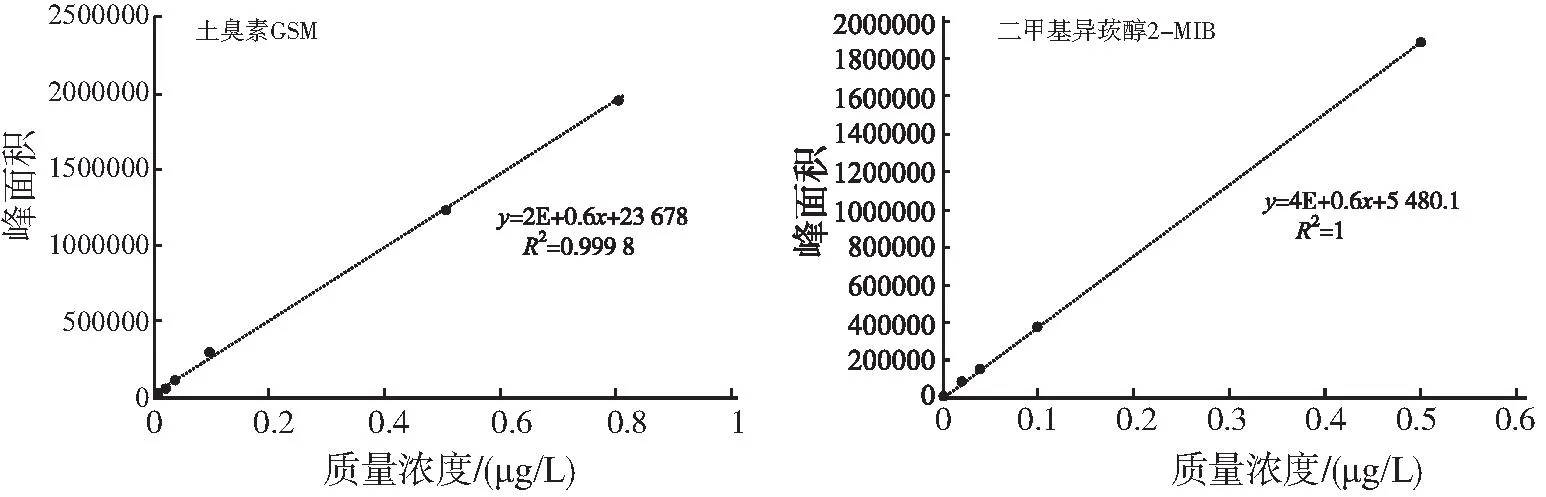
图1 GSM和2-MIB的标准曲线Fig.1 GSM and 2-MIB standard curves
取试验开始和结束时的水样,检测初始和结束时水体中的GSM和2-MIB含量,计算试验期间GSM和2-MIB的积累量。用0.45 μm滤膜分别抽滤50 mL生物絮团,取滤液5 mL装入顶空萃取瓶中,送往上海交通大学进行气相色谱-质谱联(GC-MS)分析测定GSM和2-MIB含量。具体操作参考闫莉等[20]。
将 GSM和2-MIB这2种标准品母液(色谱纯,Supleco,USA)用超纯水分别稀释至质量浓度为20、10 、4、2、0.8、0.4、0.2、0.05、0.02 μg/L,进行上机检测。分别以GSM和2-MIB质量浓度比为横坐标,以其峰面积响应值为纵坐标,绘制这2种物质的标准曲线。GSM和2-MIB标准曲线的R2分别为0.999 8和1,线性良好(图1)。
2.4 数据统计分析
试验数据采用Excel 2022软件进行结果统计,采用Origin 8.5软件进行图表绘制。试验数值采用平均值±标准差(Mean±SD)形式表示,采用SPSS 22.0软件进行ANOVA单因素方差分析,P<0.05表示差异性显著。
3 结果与分析
3.1 试验期间水质的变化
试验期间溶氧为8.14±0.03 mg/L, pH为8.68±0.02,水温为24.84±0.10℃,碱度为223±2.64 mg/L,TSS为1 076.92±16.72 mg/L,各组间均无显著性差异(P>0.05,表1)。

表1 试验期间各组水质指标的平均值Tab.1 Average values of water quality indexes in different group during the test period


注:A组(C/N为6)、B组(C/N为10)、C组(C/N为20),下同图2 试验期间各组水质指标动态变化图Fig.2 Dynamic changes of water quality indexes in each group during the test period
3.2 试验前后生物絮团营养成分的变化
相较于接种的初始絮团,试验后各组C/N、絮团粗蛋白含量均出现了下降,A、B组絮团粗灰分和B、C组絮团粗脂肪的含量上升。比较试验后各组,A、B和C组絮团粗蛋白、粗灰分含量均存在显著差异(P<0.05),粗灰分含量为A组>B组>C组,粗蛋白含量为B组>C组>A组;A组与B、C组絮团C/N、粗脂肪含量分别呈显著性差异(P<0.05),B、C组之间差异不显著(P>0.05),粗脂肪含量为B组>C组>A组,絮团C/N为A组>B组>C组(表2)。

表2 试验结束时絮团营养成分含量Tab.2 Nutrient content of bioflocs at the end of the test
3.3 试验前后水体中土腥味物质含量的变化
试验结束时,GSM和2-MIB在3个组中均被检出,质量浓度范围分别为33.32~87.30 ng/L和13.22~17.84 ng/L。A、B、C组GSM浓度较初始值显著升高(P<0.05),GSM质量浓度在A组最高为87.31±2.83 ng/L,B组最低为33.32±1.37 ng/L;A、C组2-MIB浓度较初始值显著升高(P<0.05),B组2-MIB浓度较初始值无显著性差异,2-MIB质量浓度在A组最高为17.84±1.28 ng/L,B组最低13.22±0.91 ng/L。对比各组试验开始与结束时的GSM和2-MIB含量,发现B组GSM和2-MIB的积累量最低,分别为22.41 ng/L和-0.19 ng/L,显著低于A组(76.4 ng/L和4.43 ng/L)和C组(50.98 ng/L和3.52 ng/L,P<0.05)(图3和图4)。各组中GSM浓度均高于2-MIB浓度,可见在本研究中BFT水体中主要土腥味物质是GSM。

图3 试验开始前、后各组GSM的质量浓度Fig.3 Geosmin in each group before and after experiment

图4 试验开始前、后各组2-MIB的质量浓度Fig.4 2-MIB in each group before and after experiment
4 讨论
4.1 不同C/N对水质的影响

4.2 不同C/N对生物絮团营养成分的影响
研究发现生物絮团干物质中粗蛋白含量一般为25 %~50 %,粗脂肪为0.5 %~15 %[30],吴盛凯等[31]发现在BFT养殖过程中,絮团的粗灰分含量会逐渐升高至30%左右。本试验絮团营养成分含量均在以上水平范围内。试验结束时不添加葡萄糖的对照组絮团粗蛋白和粗脂肪含量显著低于添加葡萄糖的两个组。这与Rajkumar等[32]、谭竟宏等[33]研究得出的结果相同。有研究表明添加碳源能促使水体中的异养微生物大量繁殖,生长速率为自养细菌的10倍,这些异养细菌将水中氨氮转化为自身的菌体蛋白,因此提高了絮团中的粗蛋白含量[34-36],虽然添加葡萄糖提高了絮团中的粗蛋白含量,但本试验结果表明碳氮比为20∶1的絮团粗蛋白含量显著低于碳氮比为10∶1的组,王广军等[37]也发现碳氮比越高,絮团的粗蛋白含量越低。与本试验结果相似,徐金祥等[28]、杨章武等[38]在研究中也发现添加碳源能提高絮团中粗脂肪含量。与粗蛋白和粗脂肪的结果相反,试验结束时添加葡萄糖的两个组絮团粗灰分含量显著低于不添加葡萄糖的对照组,这与徐金祥等[28]、谭竟宏等[33]、吴霞等[39]试验结果相符。有研究指出因为水体中的碳氮比会影响絮团中的微生物群落结构,而絮团的营养组成又与其微生物群落组成相关,从而C/N导致了絮团粗蛋白、粗脂肪及粗灰分含量上的差异[30]。
4.3 不同C/N对土腥味物质积累量的影响
水中的2-MIB 和 GSM 嗅觉阈值是5~10 ng/L和1~10 ng/L,本试验结束时各组的GSM和2-MIB浓度均超出嗅觉阈值,其中试验后的GSM浓度更是显著高于试验前,由此说明BFT的水体环境易致使GSM和2-MIB(尤其是GSM)的积累。相比不额外添加葡萄糖的组,添加葡萄糖会抑制土臭素和二甲基异莰醇的生成,不同碳氮比下的土腥味物质积累存在显著差异,C/N为10组试验结束时BFT水体中GSM和2-MIB浓度显著低于C/N为20组。有研究表明放线菌容易利用葡萄糖作为生长碳源,抑制次级代谢[40]。Sivonen等[41]研究表明,葡萄糖、果糖和甘露醇是芬兰天然水域中分离出来的18个放线菌菌株生长中最广泛使用的碳源。Schrader等[42]发现甘油作为碳源比葡萄糖更有利于链霉菌生成GSM。因此,试验中添加葡萄糖抑制了GSM和2-MIB的生成,但碳源添加过多会引起微生物大量繁殖,分解GSM和2-MIB的放线菌的生物量也迅速增加,致使C/N为20组的BFT水体中的GSM和2-MIB含量高于C/N为10的组。汪世山等[43]、汪鹰[44]通过固定碳源改变氮源以及比例,固定氮源改变碳源以及比例和改变培养链霉菌的碳氮比等策略皆表明了C/N对链霉菌的生物量及其生成GSM和2-MIB有着不同的影响。本试验研究结果表明,当添加葡萄糖控制碳氮比为10∶1时,试验结束时GSM和2-MIB的积累量比不添加葡萄糖,以及添加葡萄糖控制碳氮比为20∶1时少,后续可以缩小碳氮比的范围进一步研究抑制GSM和2-MIB生成的最佳碳氮比条件及最佳碳源。
5 结论
本试验通过对不同碳氮比(C/N为6、10和20)水质指标的监测、絮团营养成分的测定以及对水体中两种主要土腥味物质的检测,结果表明:在BFT中,向水体添加葡萄糖可以减少GSM和2-MIB的生成积累量,同时可降低水体中氨氮、亚硝酸盐、硝酸盐和磷的含量,净化水质;当碳氮比为10∶1时,水体中GSM和2-MIB的生成积累量最少,同时试验后絮团的粗蛋白含量最高。因此在BFT中添加葡萄糖能影响水体中土腥味物质的积累,同时有改良水质和提高絮团粗蛋白含量的效果。

