基于NLRP3/Caspase-1和Wnt/β-catenin信号通路探讨桃核承气汤延缓慢性肾衰竭大鼠肾纤维化的机制
朱为坤,张喜奎,宋昱娇,苏明星,李灵辉
(1.福建中医药大学中医学院,福建 福州 350122;2.福建中医药大学附属第二人民医院,福建 福州 350003;3.福建中医药大学图书馆,福建 福州 350122)
慢性肾衰竭(chronic renal failure,CRF)是慢性肾脏疾病(chronic kidney disease,CKD)及肾脏相关性疾病的恶化趋势[1]。肾纤维化是各种肾脏疾病发展至终末期肾衰竭的共同病理表现,包括肾小球硬化和肾间质纤维化(renal interstitial fibrosis,RIF)[2]。细胞焦亡是近年新发现的一种促炎性程序性细胞死亡方式,参与肾纤维化过程[3]。NOD 样受体热蛋白结构域相关蛋白3(NLRP3)寡聚,可诱导半胱氨酸蛋白酶-1(Caspase-1)活化,激活细胞焦亡途径,促进促炎细胞因子白细胞介素(IL)-18 和IL-1β 的活化[4]。Wnt/β-连环蛋白(β-catenin)信号通路可通过调控基质金属蛋白酶-7(matrix metalloproteinase-7,MMP-7)引发肾纤维化[5]。肾纤维化的中医病机是“本虚标实”,本虚在于肾、脾,标实在于瘀、浊毒、痰湿,而“瘀”贯穿始终[6]。前期研究发现:桃核承气汤能减轻CRF 大鼠肾微炎症状态,改善肾纤维化,延缓CRF 发展进程[7],其机制可能与调控肾的转化生长因子-β1(TGF-β1)/Smad和Wnt/β-catenin 信号通路有关[8-12],但该方是否对NLRP3/Caspase-1细胞焦亡通路有影响,尚不明确。本研究以5/6 肾切除大鼠CRF 模型为载体,研究桃核承气汤对CRF 大鼠NLRP3/Caspase-1 细胞焦亡通路及Wnt/β-catenin 信号通路的影响,探讨该方治疗CRF 肾纤维化的可能机制。
1 实验材料
1.1 实验动物 SPF级雄性7周龄Wistar大鼠80只,体质量180~220 g,购自上海斯莱克实验动物有限责任公司,实验动物生产许可证号:SCXK(沪)2017-0005,饲养于福建中医药大学实验动物中心,实验动物使用许可证:SYXK(闽)2020-0002。大鼠自由进食与饮水,饲养环境的温度为(22±1)℃,湿度为50%,每天光照时间12 h。
1.2 实验药物 桃核承气汤由桃仁12 g,生大黄(后下)12 g,桂枝6 g,炙甘草6 g,芒硝(冲服)6 g 组成,由福建中医药大学附属第二人民医院提供中药饮片,煎煮并浓缩成生药量为42 g/100 mL 的桃核承气汤药液。
1.3 实验试剂 注射用青霉素钠(江西科达动物药业有限公司);水合氯醛(青岛宇龙海藻有限公司);NLRP3 抗体(批号:A00034-2)、IL-1β 抗体(批号:A00101-1)均购自武汉博士德生物技术公司;Caspase-1 抗体(批号:22915-1-AP)、IL-18 抗体(批号:1063-1-AP)、Wnt4 抗体(批号:14371-1-AP)、β-catenin 抗体(批号:66379-1-lg)、MMP-7 抗体(批号:10374-2-AP)均购自武汉三鹰生物技术有限公司;GAPDH 抗体(美国proteintech 公司,批号:60004-1-ig);逆转录试剂盒(货号:R123-01)、qPCR 试剂盒(货号:Q311-02)均购自南京诺唯赞生物科技股份有限公司。
1.4 实验仪器 pocH-100i 血液分析仪(日本Sysmex 公司);JXFTPRP-48 研磨机(上海净信实业发展有限公司);DYCP-31DN 琼脂糖水平电泳仪(北京六一生物科技有限公司);凝胶成像系统(美国Alpha 公司);ND-100c 超微量紫外可见分光光度计、MV-C155-ov71 梯度PCR 仪均购自杭州米欧仪器有限公司;UC-6 超薄切片机(德国Leica 公司);正置光学显微镜(日本Olympus 公司);H-7650 透射电子显微镜(日本Hitachi 公司);VELETA 电镜图像采集分析系统(德国EMSIS 公司)。
2 实验方法
2.1 分组与造模 将80 只Wistar 大鼠适应性饲养1周,采用随机数字表法分为正常组、假手术组、模型组和治疗组,每组20 只。模型组与治疗组均行5/6 肾切除手术[13],用10%水合氯醛于大鼠腹腔内注射,麻醉后俯卧位固定在鼠台上,手术切除2/3的左肾组织,术后注射青霉素3 d;1 周后进行第2 次手术,切除全右肾,同样予青霉素注射3 d。假手术组手术过程同模型组,但不切除肾组织,仅做双肾被膜剥离;正常组不予任何处理。术后3 周进行眼底静脉丛采血检测肌酐(Scr),若Scr 水平明显增高,提示造模成功。造模过程中,共12 只大鼠死亡,其中假手术组2 只(麻醉过量)、模型组5 只(麻醉过量2 只、大出血2 只、伤口感染1 只)、治疗组5 只(麻醉过量1 只、大出血2 只、伤口感染2 只)。
2.2 给药干预 术后4 周开始进行干预,治疗组按10 mL/(kg·d)给予42 g/100 mL 桃核承气汤药液灌胃,正常组、假手术组和模型组分别给予等体积生理盐水灌胃,每日1 次,均连续灌胃8 周。每周对大鼠进行称重,并根据最新体质量调整药量。假手术组因灌胃不当死亡1 只;模型组因肾衰竭死亡3 只。
2.3 取材 灌胃8周后,用10%水合氯醛于大鼠腹腔内注射,麻醉后采集腹主动脉血液,取3 mL血样置于不加任何抗凝剂的试管中静置,在4 ℃、3 000 r/min下离心10 min,吸取上层血清,置于-80 ℃冰箱中保存。采血后,取出大鼠左肾(模型组和治疗组为左残余肾,正常组和假手术组取左肾并切取相对应的部位),将其置于冰上沿肾长轴切割为2 份,用生理盐水冲洗后,一部分放入冻存管并储存在-80 ℃冰箱,用于Western blot 和qPCR 检测;另一部分切成1.0 cm×1.0 cm×0.5 cm 大小的组织块,置于10%中性福尔马林溶液中固定,用于光镜和透射电镜观察。
2.4 观察指标
2.4.1 一般情况 开始给药起每天观察并记录4 组大鼠的一般情况,包括精神活动情况、反应性、被毛颜色及光泽度、饮食及二便情况等,每周称量大鼠体质量。
2.4.2 肾功能指标检测 从冰箱中取出血清,采用全自动生化分析仪按照试剂说明书检测Scr、尿素氮(BUN)含量。
2.4.3 光镜观察 将大鼠肾组织修剪后置入脱水机脱水,石蜡包埋,而后切成每片厚2 µm 的薄片,置于载玻片上,于60 ℃恒温箱烤片1 h,进行HE 染色,中性树胶封片,光镜下观察肾组织形态。
2.4.4 透射电镜观察 将大鼠肾组织切成1 mm×1 mm×1 mm 的组织块,投入2.5%戊二醛及1%锇酸中双重固定,乙醇、丙酮梯度脱水,Epon812 环氧树脂包埋,LKB 超薄切片机切片,醋酸铀、柠檬酸铝双重染色,透射电镜下观察肾组织超微结构。
2.4.5 Western blot 检测肾组织通路相关蛋白表达量 提取各组肾组织总蛋白,BCA 法测定蛋白浓度,经蛋白变性、电泳、转膜后TBST 溶液清洗,室温封闭1 h,置于NLRP3(1∶1 000)、Caspase-1(1∶1 000)、IL-1β(1∶1 000)、IL-18(1∶1 000)、Wnt4(1∶1 000)、β-catenin(1∶1 000)、MMP-7(1∶1 000)和GAPDH(1∶10 000)抗体中4 ℃摇床孵育过夜。TBST 溶液清洗,加入相应HRP 标记的二抗(1∶2 000),摇床室温孵育1 h。TBST 溶液清洗,暗室中滴加ECL 发光剂于膜上,经曝光、显影、定影,采用Quantity One 图像分析系统检测各目的蛋白光密度值,以GAPDH 为内参,对比分析各目的蛋白表达量。
2.4.6 qPCR 检测肾组织通路相关mRNA 相对表达水平 提取肾脏组织总RNA,检测RNA 浓度。配制逆转录反应液、试剂进行逆转录合成cDNA。相关基因引物序列由上海铂尚生物工程有限公司设计,见表1。各取2 µL PCR 产物于实时荧光定量基因扩增仪进行qPCR 反应,检测各组样本的mRNA含量。计算并分析各组样本及内参的2-ΔΔCT值。

表1 相关基因引物序列
2.5 统计学方法 采用SPSS 26.0 软件分析数据。计量资料符合正态分布以(±s)表示,组间比较采用单因素方差分析,两两比较方差齐采用LSD-t法,方差不齐采用Games-Howell法。检验水平α=0.05。
3 结 果
3.1 4 组一般情况观察 正常组和假手术组大鼠精神状态良好,反应灵敏,皮毛有光泽,能正常进食、饮水,二便正常;模型组大鼠精神较为萎靡,反应迟钝,体质量增长缓慢,体毛干枯、无光泽且易脱落;治疗组大鼠各项情况介于正常组和模型组之间。
3.2 4 组血清Scr、BUN 含量比较 见表2。
表2 4 组血清Scr、BUN 含量比较(±s)

表2 4 组血清Scr、BUN 含量比较(±s)
注:与正常组比较,1) P<0.05;与假手术组比较,2) P<0.05;与模型组比较,3) P<0.05。
BUN/(mmol/L)7.42±0.91 7.87±1.28 25.84±8.431)2)11.84±1.943)组别正常组假手术组模型组治疗组n 20 17 12 15 Scr/(µmol/L)42.96±5.77 42.43±5.57 132.29±17.551)2)71.05±10.773)
3.3 4 组大鼠肾组织组织形态比较 正常组和假手术组肾组织形态及结构完整,均未见肾小球、肾小管及间质的病理改变。模型组肾小球数量减少,肾组织结构紊乱,可见大量炎症细胞浸润,肾小球结构固缩,基膜增厚,肾小管扩张,肾间质纤维增生严重。治疗组病理改变程度介于正常组和模型组之间。见图1。
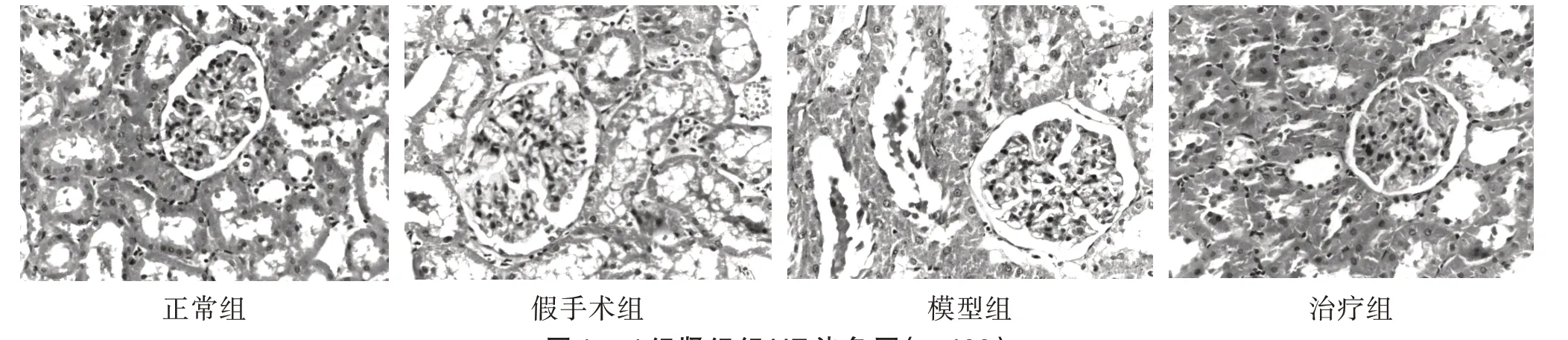
图1 4 组肾组织HE 染色图(×400)
3.4 4 组大鼠肾组织超微结构比较 正常组和假手术组肾小球内皮细胞及各级足突细胞排列整齐,未见系膜及基底膜增生,未见沉积物,足突未见融合;细胞核完整,线粒体嵴明显,且分布均匀;肾小管上皮细胞完整,微绒毛均匀分布。模型组肾小球内皮细胞水肿,足突广泛融合,系膜及基底膜增生肥厚,可见沉淀物沉积;细胞核变形固缩,线粒体嵴模糊,结构不完整;肾小管上皮细胞水肿,细胞形态排列紊乱,微绒毛分布不均或脱落,大量炎症细胞浸润。与模型组比较,治疗组肾小球内皮细胞水肿减轻,足突融合减少,系膜及基底膜轻度增生,有少量沉淀物;大部分细胞核完整,线粒体嵴轻度模糊。见图2。
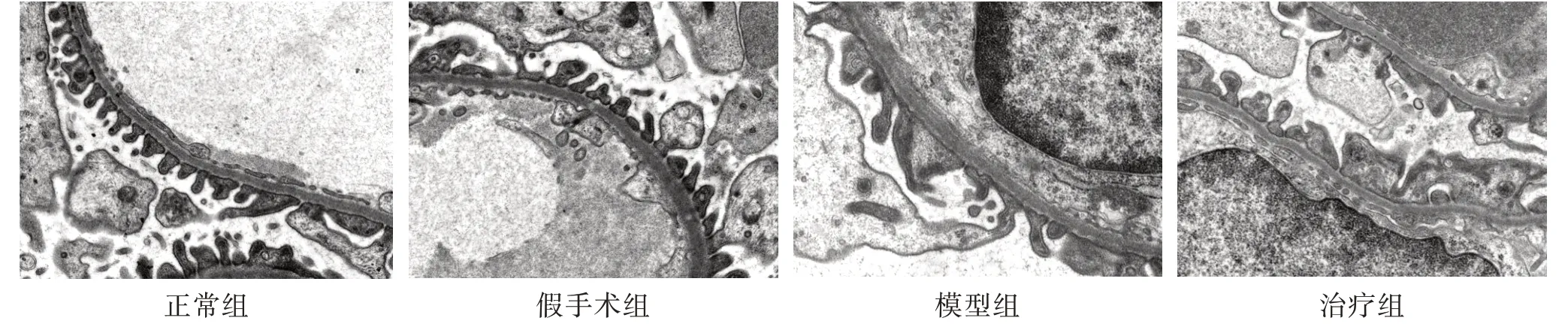
图2 4 组肾组织双重染色电镜图(×10 000)
3.5 4 组大鼠肾组织通路相关蛋白表达量比较 与正常组和假手术组比较,模型组肾组织NLRP3、Caspase-1、IL-1β、IL-18、Wnt4、β-catenin 和MMP-7 蛋白表达量均明显升高(P<0.05);与模型组比较,治疗组肾组织NLRP3、Caspase-1、IL-1β、IL-18、Wnt4、β-catenin 和MMP-7 蛋白表达量均明显降低(P<0.05)。见表3、图3。
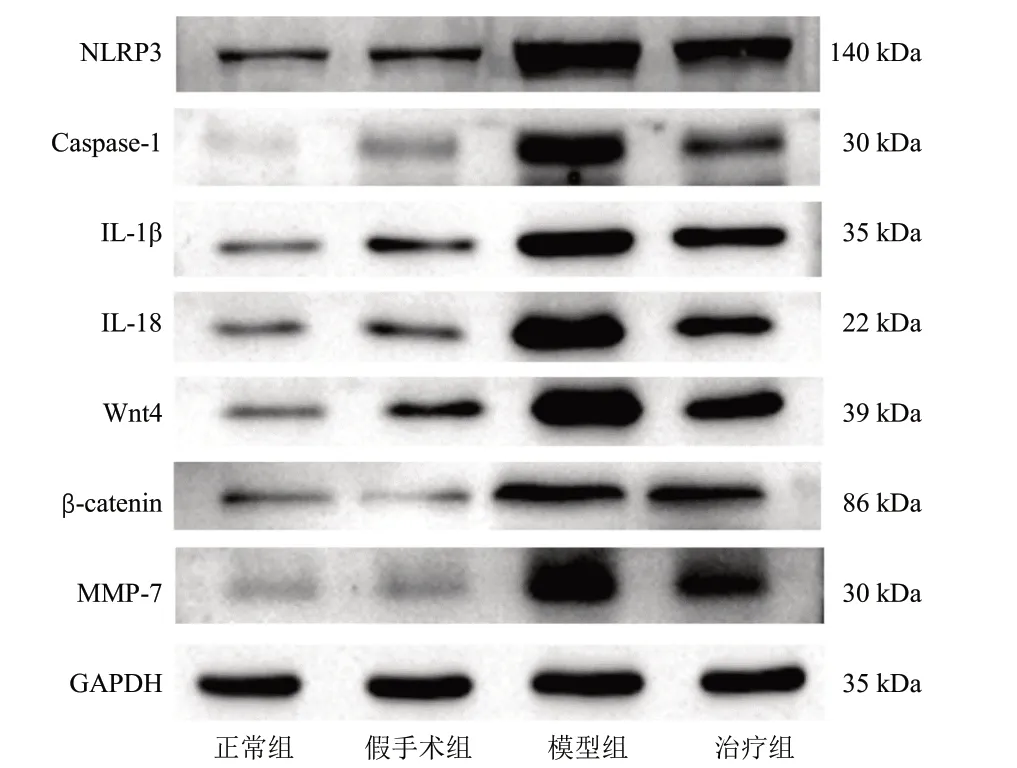
图3 4 组大鼠肾组织通路相关蛋白条带图
表3 4 组大鼠肾组织通路相关蛋白表达量比较(±s)
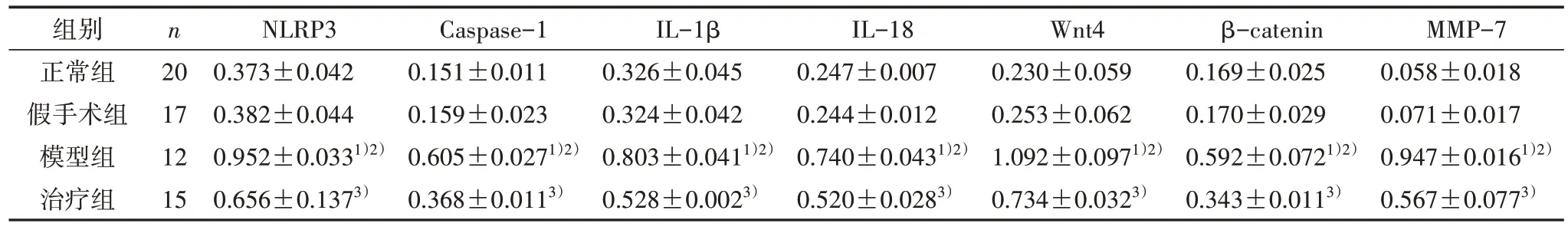
表3 4 组大鼠肾组织通路相关蛋白表达量比较(±s)
注:与正常组比较,1) P<0.05;与假手术组比较,2) P<0.05;与模型组比较,3) P<0.05。
组别正常组假手术组模型组治疗组MMP-7 0.058±0.018 0.071±0.017 0.947±0.0161)2)0.567±0.0773)n 20 17 12 15 NLRP3 0.373±0.042 0.382±0.044 0.952±0.0331)2)0.656±0.1373)Caspase-1 0.151±0.011 0.159±0.023 0.605±0.0271)2)0.368±0.0113)IL-1β 0.326±0.045 0.324±0.042 0.803±0.0411)2)0.528±0.0023)IL-18 0.247±0.007 0.244±0.012 0.740±0.0431)2)0.520±0.0283)Wnt4 0.230±0.059 0.253±0.062 1.092±0.0971)2)0.734±0.0323)β-catenin 0.169±0.025 0.170±0.029 0.592±0.0721)2)0.343±0.0113)
3.6 4 组大鼠肾组织通路相关mRNA 相对表达水平比较 与正常组和假手术组比较,模型组NLRP3、Caspase-1、IL-1β、IL-18、Wnt4、β-catenin 和MMP-7mRNA 相对表达水平均明显升高(P<0.05);与模型组比较,治疗组NLRP3、Caspase-1、IL-1β、IL-18、Wnt4、β-catenin 和MMP-7 mRNA相对表达水平均明显降低(P<0.05)。见表4。
表4 4 组大鼠肾组织通路相关mRNA 相对表达水平比较(±s)

表4 4 组大鼠肾组织通路相关mRNA 相对表达水平比较(±s)
注:与正常组比较,1) P<0.05;与假手术组比较,2) P<0.05;与模型组比较,3) P<0.05。
MMP-7 1.00±0.09 1.03±0.18 2.33±0.311)2)1.36±0.133)组别正常组假手术组模型组治疗组n 20 17 12 15 NLRP3 1.00±0.05 1.04±0.17 3.52±0.371)2)1.68±0.213)Caspase-1 1.00±0.07 1.04±0.16 3.50±0.411)2)1.99±0.223)IL-1β 1.00±0.10 0.96±0.15 3.61±0.391)2)1.69±0.143)IL-18 1.00±0.06 1.03±0.14 3.22±0.421)2)1.89±0.203)Wnt4 1.01±0.10 1.00±0.19 2.19±0.221)2)1.57±0.123)β-catenin 1.00±0.08 1.03±0.12 2.59±0.281)2)1.78±0.143)
4 讨 论
CRF 的病理过程存在高凝状态,与凝血因子水平异常和血管内皮细胞、血小板、抗凝系统等功能异常相关,“瘀”贯穿肾纤维化的全过程[6]。桃核承气汤出自《伤寒论》,主治瘀热结于下焦证,临床上可见少腹疼痛、胀满、拘急和烦躁不安、如狂等症状。方中桃仁活血祛瘀、润肠通便;大黄泻下攻积、清热泻火解毒、化瘀止血,二者合用,气血通行,使瘀热从下而走,共为君药;芒硝可助大黄泄热通便;桂枝可助桃仁活血化瘀、通利血脉,又防大黄、芒硝苦寒太过,二者为臣;炙甘草为佐使,既可调和诸药,又能补中护中。全方共奏活血化瘀、通腑泄浊之功。临床研究发现:桃核承气汤联合西医常规疗法辅助治疗早中期CRF 能改善中医症状和肾功能,较单纯应用西医常规治疗的疗效更好[14]。
细胞焦亡主要依赖Caspase 蛋白酶、细胞肿胀破裂、炎性因子(如IL-1β、IL-18)外释引起炎症级联反应等,造成细胞的损伤。研究表明:在肾脏非免疫性实质细胞中,小管上皮细胞可通过激活NLRP3 炎性体表达和释放IL-18[15],导致炎性反应和焦亡。在缺血再灌注大鼠模型中,焦亡相关蛋白Caspase-1 和IL-1β 显著上调,证实了焦亡发生于肾小管上皮细胞[16],NLRP3/Caspase-1 通路的激活,会引起肾细胞焦亡。本研究结果显示:桃核承气汤能降低CRF 大鼠Scr、BUN 水平,改善肾组织形态结构,保护肾小球内皮细胞及其细胞核、线粒体,保护肾小管上皮细胞及其微绒毛,减少炎症细胞浸润,减轻肾小球硬化及RIF;治疗组肾组织NLRP3、Caspase-1、IL-1β 和IL-18 蛋白表达量及其mRNA相对表达水平较模型组均明显降低,提示桃核承气汤可能通过调控NLRP3/Caspase-1 通路来阻断细胞焦亡,延缓肾纤维化。
肾纤维化的关键环节是上皮细胞-间充质转化(EMT),Wnt/β-catenin 信号通路影响EMT 的过程[17]。Wnt 蛋白通过激活下游的各种因子促进目的基因转录表达,引起β-catenin 降解减少,产生大量的细胞外基质成分,促进EMT 的发生与发展,触发管状上皮细胞向间充质过渡或衰老,并促进肾纤维化[18-19]。β-catenin 蛋白可调节细胞增殖、分化和凋亡[20-21],促进RIF。Wnt/β-catenin 途径可通过调节MMP-7 的表达而破坏肾小管上皮细胞基底膜,推进细胞迁移,促使肾小管间质纤维化进展[22]。肾纤维化的中医病机为“虚、湿、瘀、毒”,其形成的中医微型癥积与Wnt/β-catenin 信号通路激活后导致细胞外基质沉积引起肾纤维化形成的病理过程极其相似[23]。本研究结果发现:与模型组比较,治疗组肾组织中Wnt4、β-catenin 和MMP-7 蛋白表达量及其mRNA 相对表达水平均明显降低,提示桃核承气汤还可能通过抑制Wnt4、β-catenin 和MMP-7等因子来调控Wnt/β-catenin 通路,减轻肾纤维化。
综上,桃核承气汤可减轻CRF 大鼠肾脏炎症,改善肾功能和肾纤维化,其机制可能与调控NLRP3/Caspase-1 细胞焦亡通路和Wnt/β-catenin 信号通路有关。

