Cu2O粉末纳米材料的制备及其光催化甲基橙的研究*
罗润桐,卢宇航,叶碧莲,周明瑜,叶雨欣,陈乐乐,蒋辽川
(广东第二师范学院化学与材料科学学院,广东 广州 510730)
在诸多环境问题中,水体污染问题是目前亟需解决的重要问题之一。水体污染不仅对环境存在危害,也对我们人体有着不可逆转的伤害[1]。同时,半导体光催化材料作为一种绿色环保的材料,在降解水体污染物方面具有重要的研究意义[2-4]。
目前,已有大量关于TiO2光催化剂的报道。由于成本低、效率高等优点TiO2被广泛且深入地研究,但因为其能带间隙较大,所以只能吸收和利用短波长的紫外光[5]。尽管掺杂不同金属离子之后,TiO2的光催化活性有了一定的提升[6],但在实际应用上还存在着一定的限制[7]。而与传统光催化材料相比,Cu2O纳米材料的禁带宽度较窄,具有很好的可见光光催化活性和约18%的光电转换效率[8],因此受到了国内外很多学者的研究[9-11]。
近年来,已有诸多文献报道合成各种形貌的Cu2O无机纳米晶体,但是由于其高温的条件[12-13],使其形貌控制尤为困难。Huang等[14]制备出菱形十二面体的Cu2O纳米晶体,在可见光照射下,该材料在90 min时对甲基橙的降解率达到97%。Deng等[14]在较为温和条件下合成了Cu2O纳米线,由于比表面积的增大和导电性的提高,rGO-Cu2O介晶在室温下对NO2有较高的灵敏度,超过了单晶体Cu2O纳米线网络和rGO薄膜体系。Zhang等[15]通过比较立方体纳米晶、八面体纳米晶和混合18~26面Cu2O纳米晶的光催化活性,证明具有较多{100}晶面的混合18~26面纳米晶具有较高的光催化活性。此外,电沉积方法是另外一种合成纳米材料的重要方法。Haynes等[16]首先将合成的ZnO纳米棒薄膜刻蚀除去并电沉积Cu2O,用有机溶剂溶解聚合物后合成Cu2O纳米棒阵列。
本研究通过反应条件来调控Cu2O纳米材料的形貌和活性晶面,以提高材料的光催化降解性能,并为实际应用提供一定的研究价值。
1 实 验
1.1 仪器与试剂
场发射扫描电镜(FE-SEM,MIRA 3 LMU),TESCAN公司;粉末X射线衍射仪(PXRD,D8 ADVANCES),Bruker公司;CS350电化学工作站,武汉科斯特仪器股份有限公司。
氯化铜,上海展云化工有限公司;盐酸羟胺,国药集团化学试剂有限公司;十二烷基硫酸钠,天津市大茂化学试剂厂;Nafion溶液,杜邦(美国)试剂有限公司。所有试剂均为分析纯。
1.2 实验方法
1.2.1 菱形十二面体Cu2O纳米材料的合成
分别称取0.067 2 g CuCl2、0.870 g SDS(十二烷基硫酸钠)、0.072 g NaOH及0.166 7 g NH2OH·HCl。将上述试剂加入100 mL水中并恒温34 ℃,在剧烈搅拌下,加入SDS(十二烷基硫酸钠),待充分溶解后,加入NaOH,并在5 s内加入NH2OH·HCl,磁力搅拌20 s,恒温水浴1 h。反应完成后,以4 000 rpm离心3 min。随后加入30 mL乙醇水溶液(体积比为1∶1)离心3 min,重复上述步骤,以除去未反应的物质以及表面活性剂。得到砖红色粉末固体以进行后续光催化降解实验和电化学测试实验。
1.2.2 不同形貌Cu2O纳米材料的合成
本实验通过改变表面活性剂的种类,对Cu2O的形貌进行调控。将SDS(十二烷基硫酸钠)改为相同摩尔的SDBS(十二烷基苯磺酸钠),其余步骤同上。
此外,本实验还通过改变还原剂NH2OH·HCl的量对Cu2O纳米材料进行调控,加入的量分别为:0.027 7 g、0.041 6 g、0.063 9 g、0.068 0 g、0.083 3 g。
1.2.3 光催化降解实验
以50 mL 50 mg/L 的甲基橙溶液为目标污染物,测试的光催化材料的量为60 mg(即一次制备实验的量)。将甲基橙溶液和光催化材料置于50 mL的双层玻璃套杯中并充分混合。在进行光催化降解期间,间隔10 min取1 mL溶液,光催化降解实验持续1.5 h。采用紫外可见分光光度计对反应溶液进行吸光度测试,甲基橙的最大吸收波长为464 nm,根据以下公式(1)计算材料的光催化降解率(degradation rate,DR):
DR=(A0-At)/A0×100%
(1)
式中:A0为暗态处理后即光照0 min时的吸光度;At为光照t min时的吸光度。
1.2.4 电化学测试
称取2 mg Cu2O粉末材料,加入200 μL无水乙醇与5 μL的Nafion溶液,超声1 h。用移液枪移取上述混合液并滴涂在玻碳电极中心后,在红外灯下烘干,重复上述步骤十次。即工作电极制备完成,留待备用。
构建三电极体系,以“L”型的玻碳电极为工作电极,饱和甘汞电极为参比电极,铂片为辅助电极,电解液为0.5 M Na2SO4溶液。
交流阻抗测试:以0.5 M Na2SO4溶液为电解液,相对开路为0 V,测试频率为100 kHz到0.1 Hz。
莫特-肖特基测试:固定频率为5 kHz,电压范围为-0.8~1.2 V,电解液为0.5 M的Na2SO4溶液。
2 结果与讨论
2.1 XRD分析
图1为菱形十二面体Cu2O和立方体Cu2O的XRD图谱,由图可知,2θ在29.582°、36.502°、42.401°、61.518°、73.697°处出现衍射峰,它们分别对应标准卡Cu2O(PDF No.78-2076)中的(110)、(111)、(200)、(220)和(331)晶面,并未出现其他杂峰,而且材料的衍射峰强度较强且峰强之比与标准卡几乎一致,说明Cu2O纳米材料已成功制备。

图1 不同形貌Cu2O的XRD图Fig.1 XRD patterns of Cu2O with different morphologies
2.2 SEM分析
图2中a~f为加入不同物质的量的还原剂的扫描电镜图。图2(a)呈现出大小较为均一的立方体结构的Cu2O,其表面略为粗糙,这可能是由于样品经过喷金处理,表面有较多纳米金颗粒负载。图2(b)是在立方体的基础上,四周棱角消失,形成“四叶草”形貌的Cu2O纳米材料。图2(c)到图2(e)由球型逐渐演变成表面被轻微切削的多面体结构。当加入更多的还原剂时,Cu2O呈现菱形十二面体结构,如图2(f)所示。此外,当加入0.166 7 g NH2OH·HCl时,通过加入SDBS(十二烷基苯磺酸钠)来调控Cu2O形貌,最终得出如图2(g)所示的球型。

图2 加入不同物质的量的还原剂的Cu2O、加入不同表面活性剂的Cu2O SEM图Fig.2 SEM of Cu2O with different amount of reducing agent, Cu2O with different surfactant
2.3 紫外可见漫反射
图3为Cu2O光催化材料的紫外-可见漫反射图谱。由图3可知,Cu2O对可见光有明显的吸收,它的吸收范围为600 nm左右。而在太阳光中,可见光占43%,因此Cu2O光催化材料的光吸收范围在可见光范围内,具有较高的有效光利用率。

图3 Cu2O光催化材料紫外-可见漫反射图谱(a)和能带宽度(b)Fig.3 UV-Vis diffuse reflectance spectra of Cu2O photocatalytic materials(a)and band gap(b)
根据以下公式计算光催化半导体材料的禁带宽度:
(αhv)1/n=A(hv-Eg)
(2)
式中:α为吸光指数;h为普朗克常数;n为常数;v为频率;A为常数;Eg为半导体禁带宽度。当光催化材料为直接带隙半导体材料时,n值取1/2;为间接带隙半导体时,n值取2。根据公式,得到图3(右)的Tauc plot曲线。图3中曲线与横坐标的截距为该材料的禁带宽度,即为2.39 eV,略高于文献报道的2.17 eV,禁带宽度的扩大将越来越光催化降解染料。
2.4 电化学阻抗谱(EIS)
图4为立方体和十二面体Cu2O的电化学交流阻抗测试图谱。由图4可得,立方体的Cu2O在高频区具有较大的容抗弧,在低频区呈现直线,说明受到混合过程控制;而菱形十二面体的Cu2O具有两个小的容抗弧,说明该材料的传荷阻抗较小,这有利于光生电子-空穴对的分离,因而具有更高光催化活性。

图4 不同形貌的Cu2O纳米材料的阻抗图谱Fig.4 Impedance spectra of Cu2O nanomaterials with different morphologies
2.5 光催化性能测试
由图5(a)可知,在光照1.5 h后,形貌为菱形十二面体的Cu2O光催化活性最高,其降解率可达91%,其次是表面具有孔洞的球型Cu2O,其降解率为65%,立方体Cu2O的降解率仅有14%。这可能是由于十二面体具有较大比表面积且暴露了更多的催化活性晶面,导致其光催化性能相对较好。
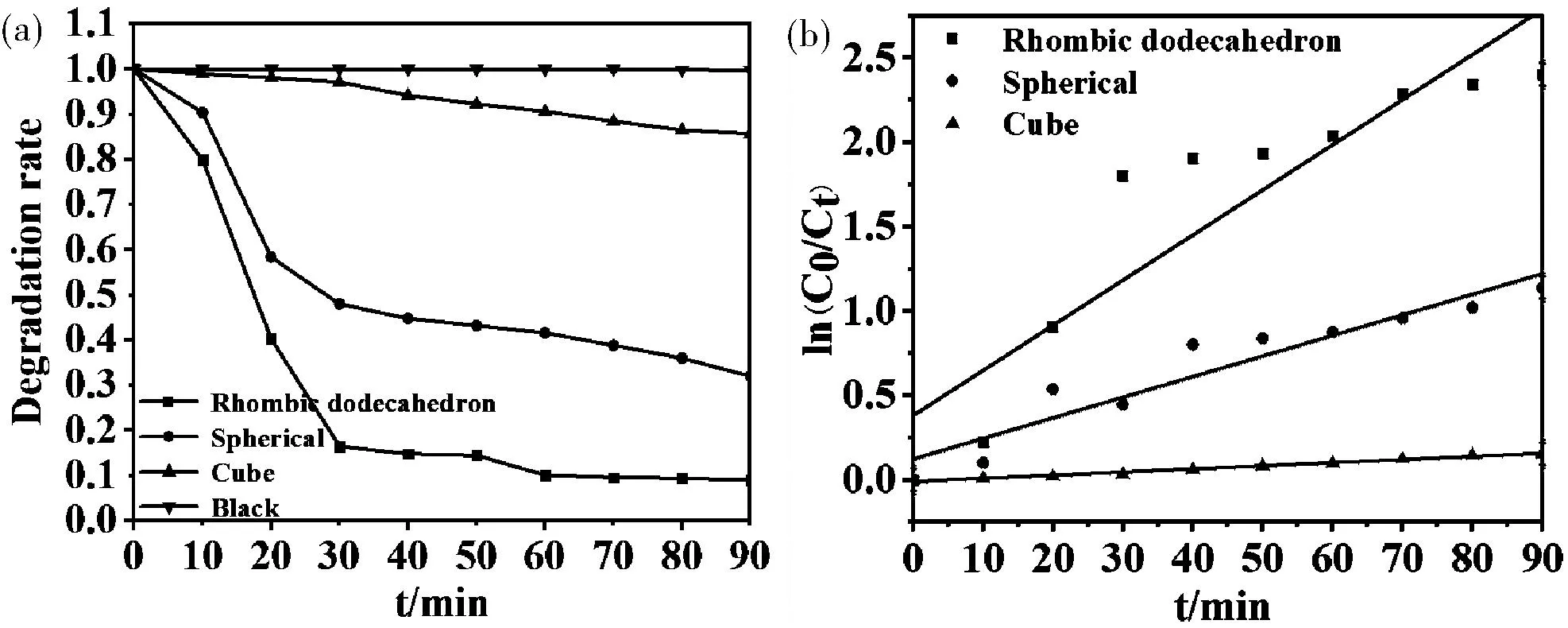
图5 不同形貌Cu2O光催化降解折线图(a)和准一级反应动力学曲线(b)Fig.5 Broken line diagram of photocatalytic degradation of Cu2O with different morphologies(a)and Pseudo first order kinetic equation curve(b)
图5(b)为上述光催化材料的光催化降解动力学曲线。由图可知,所制备的材料光催化降解符合准一级动力学。立方体Cu2O、球形Cu2O和菱形十二面体Cu2O的光催化降解反应速率常数k分别为0.001 86 min-1、0.012 2 min-1和0.026 74 min-1。其中,光催化活性最高的菱形十二面体Cu2O的k值分别为立方体Cu2O和球形Cu2O的14.4倍和2.2倍。
3 结 论
通过简单的化学法制备了不同形貌的氧化亚铜,菱形十二面体的氧化亚铜光照90 min后降解率可达91%,其反应速率常数为0.026 74 min-1,分别为立方体Cu2O和球形Cu2O的14.4倍和2.2倍。交流阻抗测试表明菱形十二面体的氧化亚铜具有更小的传荷阻抗,这有利于光生载流子的分离。

