低温冷害对水稻孕穗期叶片光合特性及抗氧化酶系统的影响
路佳明, 任红茹, 赵 灿, 施 艺, 陈 越, 王维领, 霍中洋
(扬州大学农学院/ 江苏省作物遗传生理重点实验室/ 江苏省粮食作物现代产业技术协同创新中心, 江苏扬州 225009)
水稻是世界主要粮食作物之一,我国约65%以上人口以稻米为主食,在保障我国粮食安全方面发挥着重要作用[1]。在全球气候变暖背景下,气温升高导致作物抗寒性减弱,生育期长、抗寒性弱的作物品种不断推广,一旦作物生长期气温骤变极易影响作物生长发育和产量[2]。研究[3]认为,产量取决于光合产物的积累与分配,水稻籽粒产量80%以上来自抽穗后光合作用碳水化合物的积累和再分配。水稻作为一种喜温作物,低温冷害会严重扰乱水稻生长及生理代谢,导致其发生长育缓慢,抑制有效穗的形成,甚至引起青枯死亡[4]。研究[5]表明,低温胁迫对水稻光合作用相关生理过程的伤害是不可逆的,其通过阻碍叶绿素的正常合成、抑制光合系统中相关酶活性[6], 进而导致叶片光合能力下降[7-9]。
超氧化物歧化酶(superoxide dismutase, SOD)、过氧化物酶(peroxidase, POD)和过氧化氢酶(catalase, CAT)被称为抗氧化酶系统,在植物细胞响应低温胁迫中起协同作用,植物通过增加抗氧化酶活性来使胞内活性氧自由基(reactive oxygen species, ROS)维持在较低的水平,以防ROS对细胞膜及核酸造成伤害。因此抗氧化酶活性可作为衡量植物抗逆性的重要指标。ROS引起膜脂的过氧化,并积累过氧化产物丙二醛(malonic dialdehyde, MDA), 使得细胞膜通透性增加,最终破坏细胞膜的结构与功能[10-11]。
本试验以大面积种植的粳稻(南粳9108)和籼稻(扬两优013)为供试材料,孕穗期分别进行低温胁迫,测定低温胁迫前后水稻叶片的SPAD值、光合特性相关指标、抗氧化酶系统酶活性及MDA含量,探讨水稻在低温胁迫下生理指标的变化,进一步分析水稻叶片光合特性和抗氧化酶系统相关酶活性对低温的响应,明确孕穗期低温胁迫下水稻功能叶片光合特性、抗氧化酶活性和MDA含量的变化规律,为研究孕穗期低温胁迫对水稻生长影响的内在生理机制提供理论参考。
1 材料与方法
1.1 供试材料
供试水稻(OryzasativaL.) 品种为迟熟中粳型‘南粳9108’、迟熟晚籼型‘扬两优013’。试验于2016年在扬州大学农学院实验农场(119°42′E、32°39′N)进行,该地属亚热带季风气候, 5~10月份平均气温24 ℃, 月降水量88 mm, 月日照时数168 h。采用盆栽试验,试验前每个盆钵(高23 cm, 直径35 cm, 装入经3 mm孔径过筛取自水稻田的风干水稻土9 kg)。沙壤土,土壤基本理化性质为pH 6.95、有机质15.0 g·kg-1、全氮1.4 g·kg-1、速效磷35.36 mg·kg-1、速效钾88.23 mg·kg-1。每盆施尿素1.2 g, 磷酸二氢钾0.3 g作为基肥,用稀硫酸调pH值至5.0~5.5。
1.2 试验设计
试验于5月29日播种,采用软盘湿润育秧, 25 d后选取发育进程与长势一致的秧苗(约3叶1心)移栽至盆钵中。每盆8穴, 每穴2苗, 每处理栽插20盆。拔节期每盆追施1.5 g尿素、0.5 g磷酸二氢钾。试验期间按照扬州地区大田水稻常规管理措施进行水分与病虫害管理。
分别设置13、15和17 ℃ 3个温度,每个温度分别持续处理0(对照)、3、5、7、9 d, 人工气候箱内部相对湿度和光照强度模拟试验期间的外界自然条件设定。其中白天(6:00-18:00)开一组补光灯,相对湿度设为70%左右,光量子通量密度设为1 500 μmol·(m2·s)-1; 夜间(18:00-6:00)关闭补光灯,相对湿度设为80%左右。在水稻剑叶与倒2叶的叶枕距为-5~-2 cm时,作为孕穗期低温处理的标准,此时正是花粉母细胞减数分裂期,对外界环境条件反应十分敏感,是颖花能否健全发育或退化及决定谷粒容积大小的关键时期。当达到孕穗期处理标准时选取单株挂牌并移入人工气候室进行低温处理,每处理各10盆。低温处理结束后,将气候室的盆栽水稻移至自然环境中生长。
1.3 测定项目与方法
1.3.1 SPAD值测定
采用SPAD-502型叶绿素仪(日本柯尼卡美能达公司)测定供试样品的SPAD值。于每处理结束后第2天,对各处理主茎剑叶进行SPAD值测定,测量位置为叶片基部、中部和上部,取其平均值作为该叶片的SPAD值,每处理重复5次。
1.3.2 光合特性测定
在每处理结束后,测定不同处理水稻主茎剑叶光合特性,每处理重复5次。于上午9:30-11:30时,采用Li-6400型便携式光合分析仪(美国LI-CDR公司)系统测定水稻主茎剑叶的净光合速率(Pn)、气孔导度(Gs)、蒸腾速率(Gr)、胞间CO2浓度(Ci)和环境CO2浓度(Ca)。测定时固定红蓝光源,光量子通量密度设为1 500 μmol·(m2·s)-1, 空气温度为31℃, 空气中CO2浓度为380 μmol·mol-1左右。
1.3.3 抗氧化相关酶活性和MDA含量测定
处理结束后,选取生长一致的主茎剑叶测定其相关生理指标。SOD活性[U·(g·min)-1]采用氮蓝四唑(NBT)光还原法[12]测定; POD活性[U·(g·min)-1]采用愈创木酚法[13]测定; CAT活性[U·(g·min)-1]采用紫外吸收法[14]测定; MDA含量(μmol·g-1)采用硫代巴比妥酸 (TBA) 法[15]测定 。
1.4 数据计算与统计分析
采用Microsoft Excel 2016整理数据并作图。采用SPSS17.0软件包里Duncan多重比较法(DMRT)进行数据分析。
2 结果分析
2.1 低温对孕穗期剑叶SPAD值的影响
随着低温处理天数的延长,两品种的SPAD值在所有温度处理下均呈下降趋势(图1)。17 ℃条件下,与CK相比,随着处理天数的增加,南粳9108和扬两优013的叶绿素含量分别降低4.90%~14.09%和4.67%~19.09%。15、13 ℃条件下各低温处理天数的叶绿素含量比CK分别降低7.36%~26.69%和8.19%~37.44% (图1)。当两品种冷处理天数相同时,随着冷处理温度的降低,叶绿素含量逐渐降低且处理间差异显著。
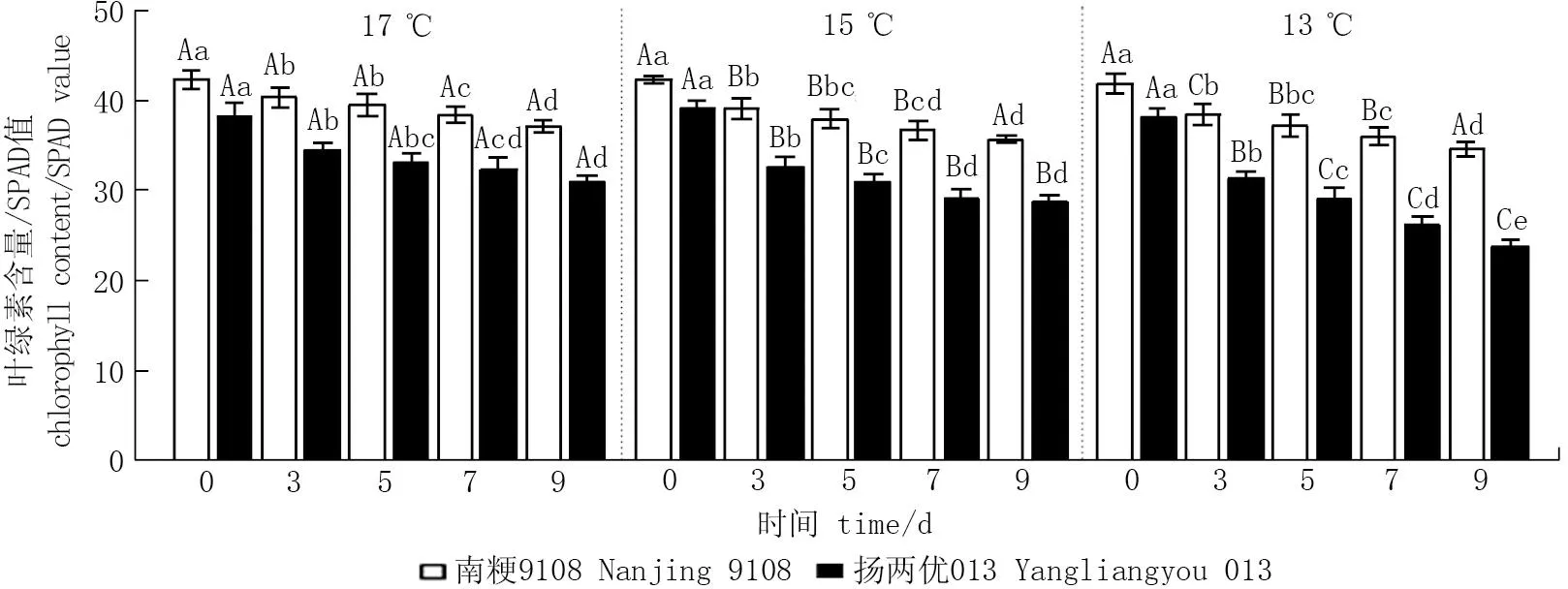
图1 低温对孕穗期对叶绿素含量的影响*Fig.1 Effect of low temperature at booting stage on chlorophyll content* 不同小写字母表示同一品种相同温度下不同处理天数之间差异显著(P<0.05); 不同大写字母表示同一品种相同处理天数下不同处理温度之间差异显著(P<0.05)。* Different lowercase letters indicate significant differences among different treatment days at the same temperature for the same variety; Different uppercase letters indicate significant differences among the different treatment temperatures at the same treatment days for the same variety.
2.2 低温对孕穗期剑叶光合特性的影响
2.2.1 低温对孕穗期水稻剑叶净光合速率的影响
随着低温处理天数的增加,两品种的净光合速率呈先降低后升高再降低的趋势(图2)。除CK外,两品种各温度下持续处理5 d时净光合速率最高,持续处理9 d时净光合速率最低。17 ℃条件下,两品种冷处理9 d较CK净光合速率降低34.23%~58.77%。15、13 ℃条件下,两品种的净光合速率较CK分别降低11.71%~79.24%和26.92%~93.94%。随处理温度的降低,处理3、5、7、9 d时净光合速率均降低,其中与17 ℃处理9 d相比,两品种13 ℃处理9 d时降幅最大,降低48.09%~86.28%。

图2 低温对孕穗期对水稻净光合速率的影响*Fig.2 Effect of low temperature at booting stage on net photosynthetic rate of rice* 不同小写字母表示同一品种相同温度下不同处理天数之间差异显著(P<0.05); 不同大写字母表示同一品种相同处理天数下不同处理温度之间差异显著(P<0.05)。* Different lowercase letters indicate significant differences among different treatment days at the same temperature for the same variety; Different uppercase letters indicate significant differences among the different treatment temperatures at the same treatment days for the same variety.
2.2.2 低温对孕穗期对水稻剑叶气孔导度的影响
除CK外,随着处理时间的延长两品种的气孔导度呈先升高后降低的趋势,且随着温度的降低,各处理天数下气孔导度呈下降的趋势,其中以13 ℃处理9 d时气孔导度下降幅度最大(图3)。在各低温处理下,持续处理3 d时气孔导度均比CK显著降低20.00%~66.13%; 低温持续处理5 d时气孔导度比CK降低4.00%~62.90%; 低温处理持续7、 9 d时气孔导度比CK分别降低 37.93%~88.71%和66.07%~91.94%。与17 ℃处理3 d相比, 15、13 ℃处理3 d时气孔导度分别降低25.00%和3.13%。与17 ℃处理5~9 d相比, 15、13 ℃处理5~9 d时气孔导度降低-33.33%~64.29%。13 ℃处理9 d比17 ℃处理9 d显著降低36.84%~64.29%。
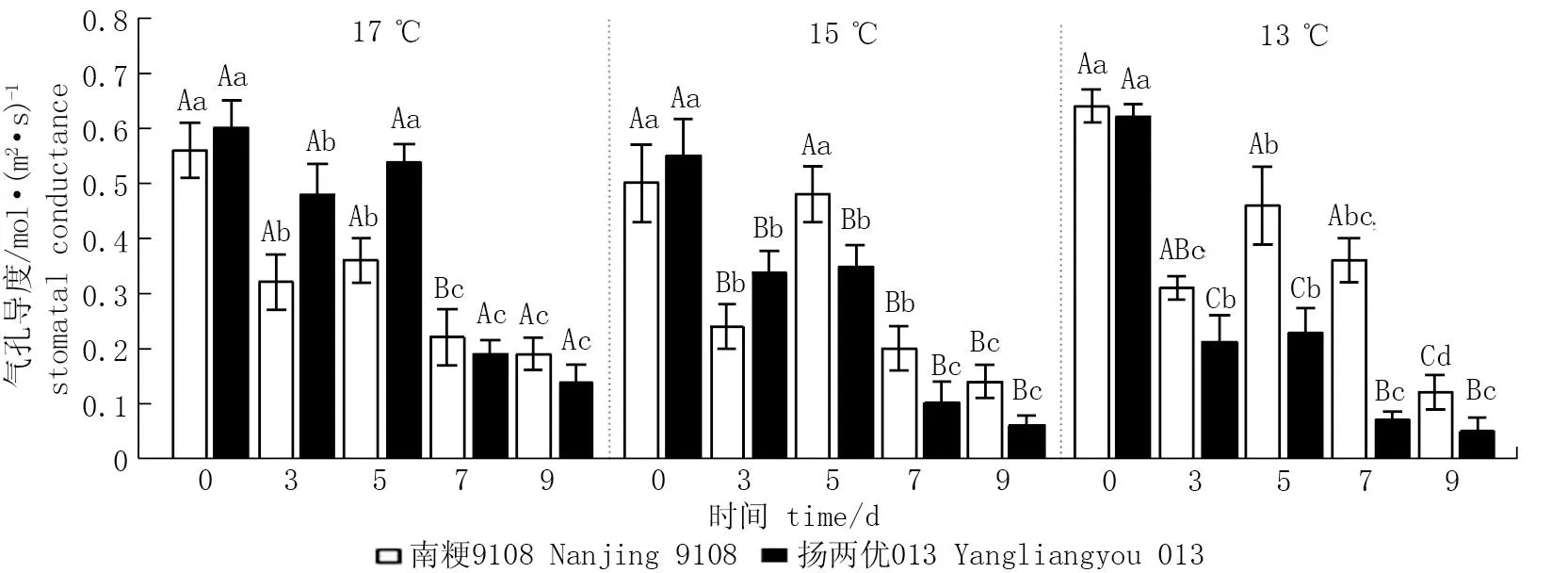
图3 低温对孕穗期水稻气孔导度的影响*Fig.3 Effect of low temperature at booting stage on stomatal conductance of rice* 不同小写字母表示同一品种相同温度下不同处理天数之间差异显著(P<0.05); 不同大写字母表示同一品种相同处理天数下不同处理温度之间差异显著(P<0.05)。* Different lowercase letters indicate significant differences among different treatment days at the same temperature for the same variety; Different uppercase letters indicate significant differences among the different treatment temperatures at the same treatment days for the same variety.
2.2.3 低温对孕穗期水稻剑叶细胞间CO2浓度的影响
与气孔导度对低温响应的规律相似,两品种水稻剑叶叶片细胞间CO2浓度随着低温持续处理时间的延长呈先升高后降低的趋势。与CK相比,各温度下持续处理3 d时胞间CO2浓度显著降低4.98%~26.94%。各温度下持续处理7、9 d时胞间CO2浓度分别较CK降低9.64%~18.96%和10.67%~23.40% (图4)。低温持续处理天数相同时,随处理温度的降低,剑叶叶片细胞间CO2浓度逐渐降低。13 ℃处理3 d分别比17、15 ℃处理3 d时胞间CO2浓度分别降低-2.54 %~22.12 %和8.63%~9.17 % (图4)。
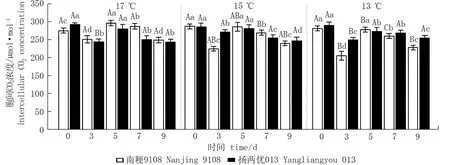
图4 孕穗期低温对水稻剑叶叶片胞间CO2浓度的影响*Fig.4 Effect of low temperature at booting stage on intercellular CO2 concentration of rice* 不同小写字母表示同一品种相同温度下不同处理天数之间差异显著(P<0.05); 不同大写字母表示同一品种相同处理天数下不同处理温度之间差异显著(P<0.05)。* Different lowercase letters indicate significant differences among different treatment days at the same temperature for the same variety; Different uppercase letters indicate significant differences among the different treatment temperatures at the same treatment days for the same variety.
2.2.4 低温对孕穗期水稻剑叶蒸腾速率的影响
随低温处理时间的增加,两品种水稻叶片蒸腾速率呈先升高再降低的趋势。相同处理天数下,随处理温度的降低,叶片蒸腾速率逐渐降低。与CK相比,两品种低温处理持续3 d时叶片蒸腾速率降低28.29%~50.00%; 当低温处理持续7、9 d时,剑叶叶片蒸腾速率较CK降低50.42%~83.77% 。13 ℃低温处理9 d较17 ℃低温处理9 d显著降低49.63%~62.63% (图5)。
2.3 低温对孕穗期抗氧化酶活性和丙二醛含量的影响
在相同温度处理下,随处理时间的延长SOD活性逐渐升高,低温处理5 d时达到最大值,较CK高10.56%~16.25%。相同处理时间下,随着处理温度的降低, SOD活性逐渐升高(图6.A)。相同处理温度下,随着处理天数的增加,南粳9108和扬两优013的叶片POD活性呈先上升后下降的趋势。相同处理温度下随着低温处理天数的增加POD活性逐渐升高,低温持续处理5 d时, POD活性达到最高值,较CK上升10.96%~46.50%; 持续处理5 d后, POD活性又逐渐降低,持续处理9 d时降到最低值,相对最高值降低10.96%~62.80% (图6.B)。相同处理温度下,随着低温处理天数的增加,水稻叶片CAT活性呈现先上升后下降的趋势,持续低温处理5 d时达到最高值,较CK上升10.06%~17.90%; 持续处理5 d后, CAT活性又逐渐降低,持续处理9 d时降到最低值,相对最高值降低5.33%~16.88% (图6.C)。随处理温度的降低和处理时间的延长,两品种剑叶叶片MDA含量逐渐升高,均于13 ℃处理9 d达到最大值。与CK相比,各温度下低温持续处理9 d时MDA含量提高15.76%~22.34%。13 ℃处理9 d时MDA含量分别比17、15 ℃处理9 d时显著高4.77%~11.17%和4.81%~5.16% (图6.D)。

图6 孕穗期低温对SOD、POD、CAT活性及MDA含量的影响*Fig.6 Effect of low temperature at booting stage on SOD, POD, CAT activity and MDA content* 不同小写字母表示同一品种相同温度下不同处理天数之间差异显著(P<0.05); 不同大写字母表示同一品种相同处理天数下不同处理温度之间差异显著(P<0.05)。* Different lowercase letters indicate significant differences among different treatment days at the same temperature for the same variety; Different uppercase letters indicate significant differences among the different treatment temperatures at the same treatment days for the same variety.
3 小结与讨论
3.1 低温冷害对孕穗期SPAD值和光合特性的影响
作为光合作用中能量转换的物质基础,叶绿素对植物的生长发育至关重要,其含量决定叶片光合功能强弱。低温冷害是水稻生长发育过程中经常遭受的逆境胁迫之一,植物叶片叶绿素含量不仅可作为营养水平的指标(如氮素含量), 还可反映作物对逆境胁迫的承受程度等[16]。本研究结果表明,低温胁迫处理后水稻叶片的叶绿素含量均呈下降趋势,且叶绿素含量随温度的降低和处理时间的延长下降幅度更大,但下降幅度在两品种间差异较大,这与前人[17-18]研究结果相一致。本研究还发现籼稻品种扬两优013较粳稻品种南粳9108受低温胁迫的影响大。大部分植物遭遇低温胁迫后,叶绿素含量降低,可能原因是叶绿体色素合成酶活性降低从而导致叶绿体合成受阻。有研究[19]表明,低温胁迫会造成叶绿体功能的紊乱,加速叶绿素的分解和破坏叶绿体形态结构的完整性,使植物叶片内叶绿素含量减少。此外,植物叶片处于低温条件下,其叶片叶绿体代谢会变慢,合成叶绿素的原料供给不足,也会造成叶绿素含量减少[20]。
植物在逆境下会产生复杂的生化和生理学上的响应,光合作用受低温胁迫的影响非常巨大。植物叶片叶绿素含量与光合速率密切相关,逆境胁迫后,细胞内ROS的积累会导致叶绿体结构遭到破坏,叶绿素a发生降解,叶片捕捉和利用光能的能力降低。有研究[21-22]表明,低温胁迫下,孕穗期栽培稻在叶片净光合速率、气孔导度及其蒸腾速率等方面均呈明显的下降趋势,植株最大光合速率、光饱和点及光能初始利用率随胁迫时间延长而下降,光化学淬灭系数、PS II电子传递速率及 PS II最大光能转化效率呈现先降后升趋势。
净光合速率是衡量植株光合系统工作正常与否的指标。气孔是植物与大气进行物质交换的通道,气孔导度直接影响植物的光合与蒸腾。张盛楠[23]研究发现,在冷水胁迫下,水稻叶片光合速率(Pn)、蒸腾速率(Tr)、胞间 CO2浓度(Ci)、气孔导度(Gs)均显著低于对照,且随着冷水胁迫时间的增加,Pn、Tr、Ci、Gs也逐渐下降。徐冲等[24]在分蘖期对水稻进行低温胁迫处理,发现低温条件下耐冷品种Pn、Tr、Gs下降,且下降幅度表现为低抗依次大于中抗、高抗;Ci受低温影响略有提升,高抗品种Ci上升幅度要大于中抗和低抗品种。本研究结果表明,低温胁迫下,孕穗期两品种水稻叶片的Pn、Tr、Ci、Gs均明显下降,随处理时间的延长和温度的降低呈先降低后升高的双峰曲线趋势,与前人研究结果相一致。孕穗期低温处理后,早稻叶绿素含量和光合速率下降,光合同化物减少,且随着温度的降低和处理时间的延长,低温对水稻叶片光合作用的影响越来越明显[25]。究其原因,可能是低温处理使叶绿体的结构发生改变,表现在片层排列方向发生变化,基粒片层堆叠紧密,出现空泡甚至空洞,进一步影响光能在叶绿体中的分配,使植物光合器官光能利用率降低[26]。王国莉等[27]研究发现低温处理水稻幼苗后,水稻叶片的光合速率迅速降低,与耐冷品种相比,冷敏感品种光合速率下降幅度更大,说明不同品种间抗寒能力具有一定的差异性,本研究也得到相似的结果,粳稻南粳9108抗寒能力要高于籼稻扬两优013。
3.2 低温冷害对孕穗期水稻抗氧化酶系统和MDA含量的影响
ROS在植物体细胞内的电子传递过程中,通过电子泄漏或正常代谢途径过程中几乎可在细胞的任何部位产生[28]。低温胁迫下,细胞的自我调节平衡被扰乱,加剧ROS的生成和膜脂的过氧化作用,破坏细胞膜系统结构和功能[29]。SOD、POD和CAT能有效地清除植物体内产生的自由基和过氧化物。低温胁迫导致水稻叶片过氧化氢(H2O2)和超氧阳离子(O2-)含量迅速上升, SOD、POD和CAT活性表现出先上升后下降的变化规律,其中耐冷水稻品种的H2O2和MDA含量明显低于冷敏感品种[30]。李辰彦等[31]研究发现,随着处理时间的延长SOD活性变化规律为单峰曲线,即呈先升高后降低的趋势, POD活性逐渐升高, CAT活性呈先降低后升高的趋势。孕穗期低温处理导致水稻叶片中SOD、POD和CAT活性增加, MDA含量升高[32]。与对照相比,孕穗期冷水胁迫下, SJ10、DN428功能叶片中SOD、POD、CAT活性及H2O2、O2-、MDA含量均显著增加[23]。而李健陵[25]研究发现孕穗期低温使早稻倒2叶SOD和POD活性下降, MDA含量上升。武琦等[33]研究发现, MDA含量在孕穗期遭遇低温冷害后呈现上升趋势,本研究结果与此一致。罗秋红[34]研究发现低温胁迫后,耐冷品种SOD、CAT活性均显著高于对照,剑叶POD活性上升。低温胁迫下,水稻体内ROS含量急剧上升,导致细胞膜脂质过氧化、蛋白质氧化变性、核酸损伤和酶失活[35], 且使 POD、CAT、SOD活性降低,加快细胞衰老,激活细胞程序性死亡[36]。本研究发现孕穗期短时的低温持续处理,抗氧化酶活性增加,但随着时间的延长其活性减弱,耐低温品种南粳9108叶片抗氧化酶清除ROS的能力较强,使得膜脂过氧化减弱,最终MDA含量低于不耐低温型品种,推测可能是粳稻品种源于气温较低地区,对寒冷的适应性较好。
粳稻品种南粳9108在孕穗期低温条件下虽然具有更好的耐寒性,但并不代表其所有耐寒性指标均优于籼稻品种扬两优013。在低温条件下,籼稻品种扬两优013的POD和CAT活性要高于粳稻品种南粳9108, 表明籼稻品种扬两优013具有更强的ROS清除能力,其相关分子水平的调控机制有待于进行更深入的研究。

