益肾通癃颗粒调控Wnt/β-catenin 信号通路对人前列腺癌PC3 细胞荷瘤裸鼠的干预作用
朱文雄,袁轶峰,彭 涛,陈立蔓,陈其华,张 熙*
1.湖南中医药大学第一附属医院,湖南 长沙 410007;2.湖南中医药大学研究生院,湖南 长沙 410208;3.湖南省脑科医院(湖南中医药大学临床医学院),湖南 长沙 410021
前列腺癌(prostate cancer, PCa)是排名第二位的男性恶性肿瘤。有数据显示,2007 年我国PCa 男性发病率为8.31/10 万,到2017 年已上升到17.63/10万,10 年间每年以21.22%的速度递增,提示我国此病发病率正持续快速增长,其中55~80 岁的中老年群体的年均增速高达26.38%[1]。随着老龄化的加剧,饮食习惯的改变,诊疗水平的提高,PCa 的发病率呈现明显的持续增长趋势,已成为严重影响老年男性健康的恶性肿瘤[2]。 PCa 极易引起膀胱出口梗阻、下尿路症状和远处转移,不仅对患者生活质量造成严重影响,由此衍生出的一系列情绪异常,如抑郁、焦虑等,使病人的幸福感更大程度地降低,但在此阶段却没有确切有效的治疗方法[3-4]。 PCa 的发病机制并没有完全明确,目前普遍认可的PCa 发病机制主要与前列腺细胞增殖/凋亡异常、炎症应激、肿瘤细胞免疫耐受、氧化/抗氧化失衡、蛋白酶/抗蛋白酶失衡、组织重构等相关[5-6]。
目前,现代医学治疗PCa 的方法主要有手术、放疗、内分泌治疗、化疗和免疫治疗等,西药主要有黄体生成素释放激素类似物和非类固醇类抗雄激素药物,它们虽然能发挥一定的疗效,但在服药过程中可能会伴随很多不良反应,包括过敏、骨质疏松、心血管系统损害、男性乳房女性化以及性功能障碍等,同时这种疾病在后期往往会发展成去势抵抗型PCa,并出现全身多处转移的情况,导致治疗效果和预后不佳[7-8]。 国家级名老中医陈其华教授结合自身多年的临证经验,将PCa 癥积的本质和病机概括为“肾虚血瘀”,并确定了补肾益气、化瘀散结的治法,创制了益肾通癃汤。前期研究已证实,益肾通癃汤治疗PCa 真实有效[9],其能够下调PC3 细胞中Bcl-2、Cyclin E1 的表达,上调Bax、Cyclin D1 的表达,而这些多为Wnt 信号通路的下游靶基因[10]。 故本课题组设计了动物实验,以益肾通癃汤超微中药饮片(免煎颗粒)为研究对象,探究其调控Wnt/β-catenin 信号通路对人前列腺癌PC3 细胞荷瘤裸鼠的干预作用。
1 材料与方法
1.1 研究材料
1.1.1 实验动物 SPF 级雄性BALB/c-nu 小鼠,体质量20~22 g,购自湖南斯莱克景达实验动物有限公司。湖南省实验动物质量合格证号:430727201101457224,实验动物设施使用证明:430727207245002513。伦理审批号:ZYFY20211008-41。所有动物置于湖南中医药大学实验动物中心SPF 级动物房每日定时饲养。
1.1.2 实验细胞系 本研究选择的是人前列腺癌骨转移细胞PC 3,属于雄激素非依赖性前列腺癌细胞系,为中南大学湘雅二医院王荫槐教授团队馈赠。
1.1.3 实验药物 益肾通癃颗粒由补骨脂15 g、蒙古黄芪30 g、熟地黄15 g、三棱10 g、莪术10 g 组成,所有中药购自湖南中医药大学第一附属医院超微颗粒药房,由湖南春光九汇现代中药有限公司生产。 中药超微颗粒经煮沸的蒸馏水冲泡、浓缩,分别制成生药浓度为0.55、1.10、2.20 g/mL 的药液。 Indocyanine green-001(ICG-001),Wnt 信号通路阻断剂,凯立德生物医药技术(上海)有限公司,规格:50 mg/支,批号:847591-62-2。
1.1.4 主要试剂 还原型5XSDS 上样缓冲液、1.0 mol/L Tris·HCl(pH 6.8)、10% SDS、TEMED、PBST 缓冲液、30%Acr/Bic、RIPA 裂解液、SuperECL Plus 超敏发光液(长沙Abiowell 生物科技有限公司,批号分别为AWB0055、AWB0074、AWT0047、AWB0068、AWI0130、AWB0020、AWB0136、AWB0005);蛋白酶抑制剂(北京金泰宏达生物科技有限公司,批号:583794);显影液、定影液(上海佳信科技有限公司,批号分别为BW-61、BW-62)。
1.1.5 主要仪器 摇床(江苏其林贝尔仪器制造有限公司,型号:TS-92);恒温箱(北京六一生物科技有限公司,型号:DYY-6C);切片刀(德国莱卡公司,型号:M199);包埋机(常州中威电子仪器有限公司,型号:BMJ-A);精密pH 计(上海仪电科学仪器股份有限公司,型号:E-201-C);普通冰箱(合肥荣事达电子电器集团有限公司,型号:BCD-245F);光学显微镜(厦门Motic 电气股份有限公司,型号:BA210T);台式冷冻离心机(湖南湘仪实验室仪器开发有限公司,型号:H1650R);电泳仪(北京六一生物科技有限公司,型号:DYY-6C);旋涡混合器(江苏其林贝尔仪器制造有限公司,型号:GL-88B);磁力搅拌器(上海仪电科学仪器股份有限公司,型号:JB-13);电子天平(美国双杰(兄弟)集团有限公司,型号:JJ224BC);生物样品均质仪(杭州奥盛仪器有限公司,型号:BioPrep-24)。
1.2 研究方法
1.2.1 建立PC3 细胞裸鼠皮下移植瘤模型 先采用Matrigel 和无血清RPMI-1640 培养基按照1∶1 比例混匀制备成瘤基质,再用成瘤基质将经过复苏、培养、 消化的PC3 细胞调制至1×107/mL 的单细胞悬液。所有动物术前12 h 禁食不禁饮,用乙醚麻醉裸鼠后用75%乙醇对腋下进行消毒,在消毒部位注射0.1 mL PC3 单细胞悬液,并用无菌纱布轻轻按揉该部位。接种完毕后各组裸鼠自由饮食,每日观察成瘤情况。 1周后部分裸鼠腋下可触及粟粒大小的皮下移植瘤,3周后可见直径约8 mm 的瘤体,提示造模成功。
1.2.2 荷瘤裸鼠的分组及给药 从造模成功的荷瘤裸鼠中选取60 只瘤体大小较为一致的随机平均分为6 组,即模型对照组、阳性药物组、益肾通癃颗粒低/中/高剂量组和联合用药组,予以相应的药物干预,每次0.2 mL,每天1 次,连续4 周。 小鼠给药的临床等效剂量是根据人和小鼠体表面积比值进行换算的。体表面积折算的等效剂量比率为人(70.0 kg):小鼠(20 g)=384.20∶1。 人的益肾通癃颗粒给药剂量为生药80 g/d,故小鼠的等效给药剂量为0.22 g/d,即为中剂量。 具体干预措施详见表1。

表1 各组给药情况一览表
每天动态观察各组裸鼠生命体征及食饮情况。给药结束后,所有动物禁食不禁饮24 h,用10%水合氯醛溶液麻醉裸鼠并固定在鼠板上,从股静脉处抽取血液标本,静置2 h 后3 000 r/min 速度离心10 min,-80 ℃冰箱保存。仔细分离并取出瘤体后,用生理盐水冲洗,滤纸吸干水分,置于-80 ℃冰箱保存。
1.2.3 HE 染色法观察各组肿瘤组织的病理变化 60 ℃烤片12 h。先将切片置于二甲苯中15 min,3 次。然后依次在100%、95%、85%和75%乙醇中,每级放置5 min。再用蒸馏水浸洗5 min。 苏木精染1~5 min,蒸馏水冲洗,PBS 返蓝。伊红染1 s,蒸馏水冲洗。梯度乙醇(95%~100%)脱水,每级5 min。 取出后置于二甲苯10 min,2 次,中性树胶封片、显微镜观察。
1.2.4 免疫组织化学法检测增殖细胞核抗原(PCNA)在各组肿瘤组织中的表达情况 60 ℃烤片12 h,切片脱蜡至水,热修复抗原,孵育一抗(PCNA),孵育二抗,最后进行DAB 显色:滴加预制好的显色剂DAB工作液50~100 μL,室温孵育1~5 min,镜下控制反应时间,蒸馏水洗涤;苏木精复染5~10 min,蒸馏水冲洗,PBS 返蓝;各级乙醇(60%~100%)脱水,每级5 min。取出后置于二甲苯10 min,2 次,中性树胶封片、显微镜观察。
1.2.5 原位末端标记法检测各组肿瘤组织的细胞凋亡情况 石蜡切片先依次经过脱蜡、烘片、再脱蜡、水合、漂洗、封闭等处理,样本周围用吸水纸吸干,每个样本上滴加50 μL TdT 酶反应液,37 ℃避光反应60 min;每个样本上滴加50 μL Streptavidin-HRP 标记工作液,37 ℃避光反应30 min;每个样本上滴加50 μL DAB 工作液,室温显色反应30 s~5 min;显色后的样本片浸入1×PBS 漂洗3 次,每次5 min;将样本上滴加苏木精染液,染色30 s~5 min,蒸馏水冲洗干净后浸入1%盐酸甲醇溶液中分化5 s,立即用蒸馏水冲洗干净。 分别用70%、85%、95%、无水乙醇浸洗5 min。 用二甲苯浸2 次,每次10 min。 晾干后加中性树胶和盖玻片,光镜下观察拍照。
1.2.6 Western blot 检测Wnt 信号通路相关蛋白的表达水平 剪取组织,用冰预冷,PBS 漂洗,加入RIPA 裂解液于生物样品均质仪中反复研磨组织直至看不见组织块,离心提取细胞总蛋白。 配制分离胶和浓缩胶,取200 μL 蛋白上清,加入50 μL 5×loading buffer 混匀,沸水煮5 min,放入冰盒中速冷进行样品准备。再依次经过电泳、转膜、封闭、一抗孵育及二抗孵育等步骤,最后进行ECL 显色曝光测定Wnt1、Wnt3a、β-catenin、GSK-3β、p-GSK-3β、APC蛋白的表达水平。
1.2.7 免疫组织化学法检测Wnt 信号通路相关蛋白的表达水平 实验方法步骤与“1.2.4”类似,所有样品先60 ℃烤片12 h, 再将切片依次置于二甲苯,100%、95%、85%、75%乙醇,蒸馏水中放置脱蜡至水。将切片浸入0.01 mol/L 枸橼酸盐缓冲液(pH 6.0)中加热、煮沸、冷却、洗涤以修复抗原,加入1%高碘酸以灭活内源性酶。 滴加适当稀释的一抗进行孵育,4 ℃过夜,PBS 冲洗5 min×3 次。 滴加50~100 μL 兔抗小鼠IgG 抗体-HRP 多聚体,37 ℃孵育二抗30 min,PBS 冲洗5 min×3 次。 最后进行DAB 显色,显微镜下观察。
1.3 统计学方法
所有数据均采取SPSS 23.0 软件进行分析,计量资料满足独立性、正态性及方差齐性时,采用单因素方差分析(one-way ANOVA),满足正态性和方差齐性的多重比较采用LSD 法和Dunnett 法;资料不满足正态性和方差齐性时,采用秩和检验,多重比较采用Kruskal-Wallis H 检验。 P<0.05 认为差异具有统计学意义。 应用Image J 软件进行图像分析。
2 结果
2.1 各组肿瘤组织的病理变化
各组荷瘤裸鼠皮下移植瘤瘤体组织HE 切片均可见大量的PC3 细胞。 模型对照组肿瘤细胞增殖旺盛,大小不一,排列紊乱,细胞核增大,核染色深,核分裂象,核仁数量多。阳性药物组,益肾通癃颗粒低、中、高剂量组和联合用药组均可见程度不一的肿瘤细胞数量减少,部分呈空泡样坏死,细胞核变形及破碎,部分细胞核发生裂解,其中联合用药组的病理变化最为明显。 详见图1。

图1 各组荷瘤裸鼠肿瘤组织的病理变化(HE,×400)
2.2 各组肿瘤组织细胞增殖情况比较
与模型对照组比较,其余5 组荷瘤裸鼠肿瘤组织的增殖指数均降低(P<0.01);与阳性药物组比较,益肾通癃颗粒低、中、高剂量组的增殖指数高于阳性药物组(P<0.01),而联合用药组的增殖指数低于阳性药物组(P<0.01);随着益肾通癃颗粒给药剂量的逐渐增高,瘤体组织的增殖指数也随之逐渐下降(P<0.05,P<0.01)。 详见表2 及图2。

图2 各组荷瘤裸鼠肿瘤组织的细胞增殖情况(×400)
表2 各组荷瘤裸鼠肿瘤组织的增殖指数(±s,n=10)

表2 各组荷瘤裸鼠肿瘤组织的增殖指数(±s,n=10)
注:与模型对照组比较,**P<0.01;与阳性药物组比较,##P<0.01;与益肾通癃颗粒低剂量组比较,△△P<0.01;与益肾通癃颗粒中剂量组比较,○P<0.05,○○P<0.01;与益肾通癃颗粒高剂量组比较,□□P<0.01。
组别模型对照组阳性药物组益肾通癃颗粒低剂量组益肾通癃颗粒中剂量组益肾通癃颗粒高剂量组联合用药组F 值P 值增殖指数0.853 3±0.040 3 0.206 7±0.045 5**0.611 7±0.075 7**##0.426 7±0.041 8**##△△0.360 0±0.046 5**##△△○0.096 7±0.039 3**##△△○○□□182.867 0.000
2.3 各组肿瘤组织细胞凋亡情况比较
与模型对照组相比,其他组细胞凋亡指数均升高(P<0.01);益肾通癃颗粒低、中、高剂量组的细胞凋亡指数低于阳性药物组(P<0.01),联合用药组的细胞凋亡指数高于阳性药物组(P<0.01);益肾通癃颗粒各组随着给药剂量的逐渐加大,细胞凋亡的发生率也显著增高(P<0.01),剂量和药效呈现正相关关系。详见表3 及图3。

图3 各组荷瘤裸鼠肿瘤组织的细胞凋亡情况(×400)
表3 各组荷瘤裸鼠肿瘤组织的凋亡指数(±s,n=10)

表3 各组荷瘤裸鼠肿瘤组织的凋亡指数(±s,n=10)
注:与模型对照组比较,**P<0.01;与阳性药物组比较,##P<0.01;与益肾通癃颗粒低剂量组比较,△△P<0.01; 与益肾通癃颗粒中剂量组比较,○○P<0.01;与益肾通癃颗粒高剂量组比较,□□P<0.01。
组别模型对照组阳性药物组益肾通癃颗粒低剂量组益肾通癃颗粒中剂量组益肾通癃颗粒高剂量组联合用药组F 值P 值凋亡指数0.148 3±0.044 5 0.601 7±0.063 4**0.298 3±0.028 6**##0.370 0±0.030 3**##△△0.468 3±0.041 7**##△△○○0.801 7±0.047 1**##△△○○□□164.783 0.000
2.4 Western blot 检测各组肿瘤组织Wnt 信号通路相关基因蛋白的表达情况
与模型对照组相比,给药5 组荷瘤裸鼠瘤体组织的Wnt1、Wnt3a、β-catenin、APC、p-GSK-3β 蛋白的表达水平均下调(P<0.01),其中GSK-3β 蛋白的表达水平升高(P<0.01);益肾通癃颗粒的药效不及阳性药物ICG-001(P<0.05,P<0.01);但其与ICG-001联合用药时可发挥协同增效的作用,对Wnt 信号通路的阻断作用效果优于阳性药物组(P<0.01)。 详见表4及图4。

图4 Western blot 检测各组肿瘤组织Wnt 信号通路相关基因蛋白的表达情况
表4 Western blot 检测各组肿瘤组织Wnt 信号通路相关基因蛋白的表达水平(±s,n=10)

表4 Western blot 检测各组肿瘤组织Wnt 信号通路相关基因蛋白的表达水平(±s,n=10)
注:与模型对照组比较,**P<0.01;与阳性药物组比较,#P<0.05,##P<0.01;与益肾通癃颗粒低剂量组比较,△P<0.05,△△P<0.01;与益肾通癃颗粒中剂量组比较,○○P<0.01;与益肾通癃颗粒高剂量组比较,□□P<0.01。
组别模型对照组阳性药物组益肾通癃颗粒低剂量组益肾通癃颗粒中剂量组益肾通癃颗粒高剂量组联合用药组F 值P 值Wnt1 0.420 0±0.035 8 0.145 0±0.024 3**0.295 0±0.025 1**##0.263 3±0.048 9**##0.191 7±0.014 7**#△△○○0.101 7±.0232**#△△○○□□84.735 0.000 Wnt3a 0.415 0±0.027 4 0.231 7±0.031 9**0.315 0±0.028 8**##0.263 3±0.043 2**△0.233 3±0.040 3**△△0.148 3±0.027 9**##△△○○□□42.656 0.000 β-catenin 0.513 3±0.046 8 0.163 3±0.031 4**0.440 0±0.031 6**##0.305 0±0.055 8**##△△0.240 0±0.040 5**##△△○○0.075 0±0.024 3**##△△○○□□103.966 0.000组别模型对照组阳性药物组益肾通癃颗粒低剂量组益肾通癃颗粒中剂量组益肾通癃颗粒高剂量组联合用药组F 值P 值GSK-3β 0.100 0±0.031 6 0.273 3±0.049 7**0.416 7±0.028 8**##0.435 0±0.024 3**##0.473 3±0.108 0**##0.615 0±0.068 9**##△△○○□□53.374 0.000 p-GSK-3β 0.383 3±0.021 6 0.170 0±0.026 1**0.308 3±0.035 4**##0.280 0±0.026 1**##0.261 7±0.039 2**##△△0.076 7±0.019 7**##△△○○□□84.264 0.000 APC 0.536 7±0.056 8 0.186 7±0.031 4**0.346 7±0.039 8**##0.261 7±0.030 6**##△△0.196 7±0.028 8**△△○○0.080 0±0.016 7**##△△○○□□115.167 0.000
2.5 免疫组织化学法检测各组肿瘤组织Wnt 信号通路相关蛋白的表达情况
与模型对照组相比,给药5 组荷瘤裸鼠瘤体组织的Wnt1、Wnt3a、β-catenin、APC、p-GSK-3β 蛋白的表达水平均下调(P<0.01),其中GSK-3β 蛋白的表达水平升高(P<0.01);联合用药组对Wnt 信号通路的阻断作用优于阳性药物组(P<0.01);益肾通癃颗粒各剂量组对Wnt 信号通路的阻断效果弱于阳性药物组(P<0.05,P<0.01)。 详见表5 及图5。

图5 免疫组化法检测各组肿瘤组织Wnt 信号通路相关基因蛋白的表达情况(×400)
表5 免疫组化法检测各组肿瘤组织Wnt 信号通路相关蛋白的表达水平(±s,n=10)
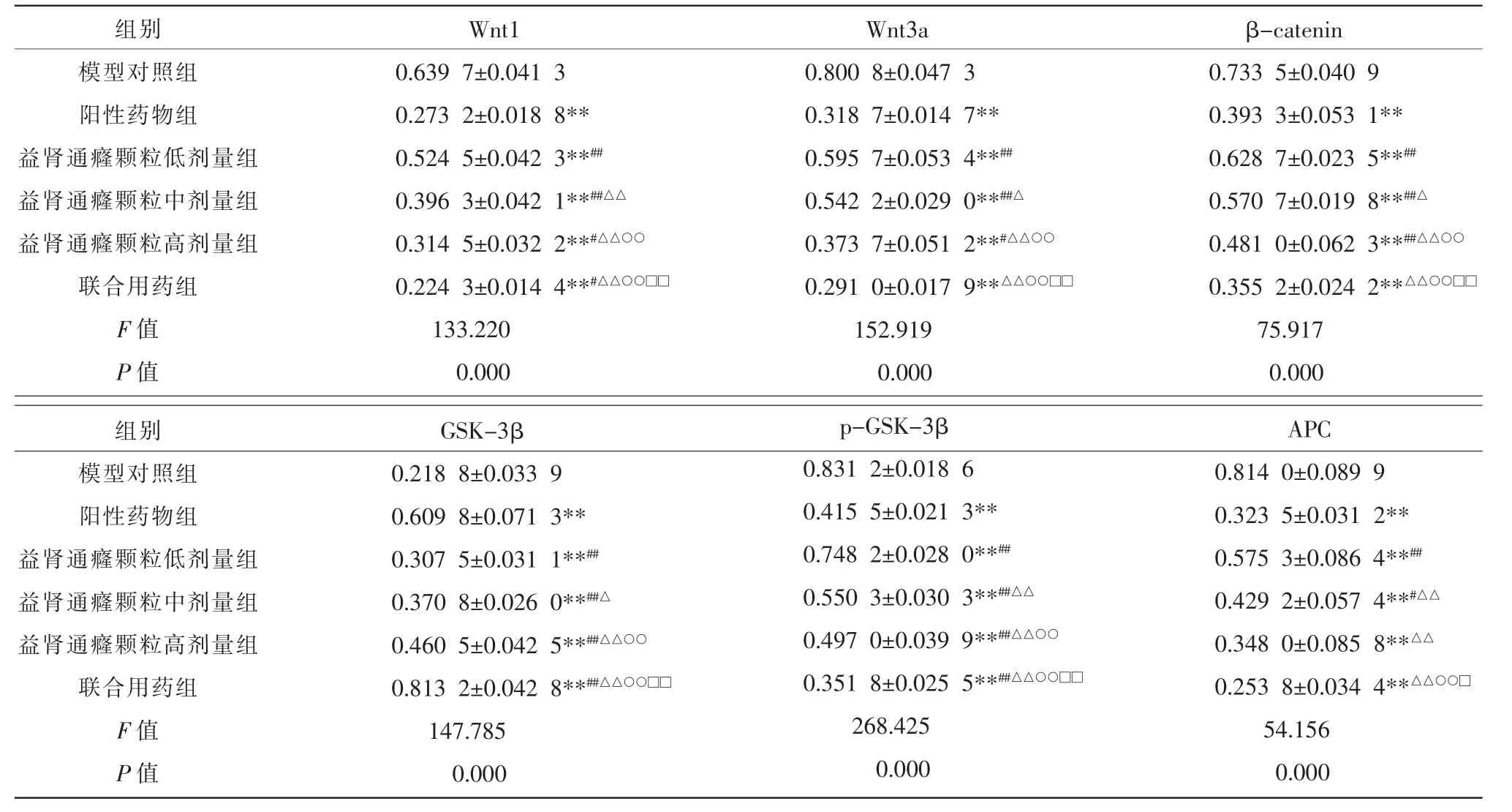
表5 免疫组化法检测各组肿瘤组织Wnt 信号通路相关蛋白的表达水平(±s,n=10)
注:与模型对照组比较,**P<0.01;与阳性药物组比较,#P<0.05,##P<0.01;与益肾通癃颗粒低剂量组比较,△P<0.05,△△P<0.01;与益肾通癃颗粒中剂量组比较,○○P<0.01;与益肾通癃颗粒高剂量组比较,□P<0.05,□□P<0.01。
组别模型对照组阳性药物组益肾通癃颗粒低剂量组益肾通癃颗粒中剂量组益肾通癃颗粒高剂量组联合用药组F 值P 值组别Wnt1 0.639 7±0.041 3 0.273 2±0.018 8**0.524 5±0.042 3**##0.396 3±0.042 1**##△△0.314 5±0.032 2**#△△○○0.224 3±0.014 4**#△△○○□□133.220 0.000 Wnt3a 0.800 8±0.047 3 0.318 7±0.014 7**0.595 7±0.053 4**##0.542 2±0.029 0**##△0.373 7±0.051 2**#△△○○0.291 0±0.017 9**△△○○□□152.919 0.000 β-catenin 0.733 5±0.040 9 0.393 3±0.053 1**0.628 7±0.023 5**##0.570 7±0.019 8**##△0.481 0±0.062 3**##△△○○0.355 2±0.024 2**△△○○□□75.917 0.000模型对照组阳性药物组益肾通癃颗粒低剂量组益肾通癃颗粒中剂量组益肾通癃颗粒高剂量组联合用药组F 值P 值GSK-3β 0.218 8±0.033 9 0.609 8±0.071 3**0.307 5±0.031 1**##0.370 8±0.026 0**##△0.460 5±0.042 5**##△△○○0.813 2±0.042 8**##△△○○□□147.785 0.000 p-GSK-3β 0.831 2±0.018 6 0.415 5±0.021 3**0.748 2±0.028 0**##0.550 3±0.030 3**##△△0.497 0±0.039 9**##△△○○0.351 8±0.025 5**##△△○○□□268.425 0.000 APC 0.814 0±0.089 9 0.323 5±0.031 2**0.575 3±0.086 4**##0.429 2±0.057 4**#△△0.348 0±0.085 8**△△0.253 8±0.034 4**△△○○□54.156 0.000
3 讨论
目前,PCa 的发病原因和机制还没有被现代医学完全解释清楚[11],现在可以确认的是一些危险因素,比如年龄、人种、遗传、饮食、激素、地理环境等等。 目前得到普遍认可的PCa 发病机制主要与PCa细胞增殖、凋亡、细胞周期等生物学过程异常有关[12-13]。而在这些肿瘤发生相关的生物学进程中,信号通路的调控作用有着无可比拟的重要性[14-15]。 新近研究发现,Wnt、PI3K/AKT、NF-κB、TGF-β/Smads、Notch、JAK/STAT 等信号通路在PCa 的发病中扮演了重要角色。 Wnt 是一种广泛存在于无脊索动物和脊索动物之中,参与调节细胞增殖、分化、凋亡、免疫等生物学过程的基因,其在多种细胞活性、细胞更新、调节生物发育过程及维持组织内环境稳定等方面发挥着不可或缺的作用[16-17]。β-catenin 是20 世纪80 年代后期被人类发现的一种进化守恒分子,是一种由CTNNB1基因编码,在介导细胞间黏附和相关信号传导、内稳态过程中起关键作用的蛋白质,也是Wnt/β-catenin信号转导通路的关键核效应分子[18]。 Wnt/β-catenin信号通路参与了维持上皮细胞表型、细胞生长分化等过程[19-20],在胚胎生长发育、器官纤维化、肿瘤发生发展等生理病理过程中具有关键意义。 在PCa 的模型中,Wnt/β-catenin 信号通路的表达被激活,诱导细胞的增殖和EMT 过程[21]。 因此,对它积极开展相关研究,可以帮助寻找最佳的PCa 治疗靶点。
国家级名老中医陈其华教授认为,前列腺相当于中医学的“精室”“男子胞”,为奇恒之腑,其形似腑,功同脏,执行藏精和排精两大功能,隶属于中医的肾系统。精室为病,应多从肾论治。根据中医学理论,可将PCa 归为“癥瘕”“积聚”“精室岩”等范畴。所谓癥瘕,或言积聚,是指因正气亏虚,脏腑失和,气滞、血瘀、痰浊蕴结于腹中,形成结块,或胀或痛为主要临床特征的病证。 正如《灵枢·百病始生》载:“积之始生,得寒乃生。 ”《难经·五脏积病》云:“积者,阴气也。 ”《活法机要·正虚与积聚》则道:“壮人无积,虚人则有之,脾胃怯弱,气血两衰,四时有感,皆能成积。 ”《景岳全书·杂证谟》有云:“凡汁沫凝聚,旋成癥块者,皆积之类,其病多在血分,血有形而静也。 ”PCa 的发病应紧紧抓住两个字, 一个是“虚”,所谓“虚损生积”;一个是“瘀”,所谓“血瘀致癥”。 “肾虚血瘀”是对PCa 癥积本质和病机的高度概括[22]。 故在治疗上当以补肾益气、化瘀散结,并由此确定了补肾活血法治疗PCa 的基本方药——益肾通癃汤。 方用熟地黄、黄芪为君,熟地黄味甘,性微温,归肝、肾经,功可滋补肝肾、益精填髓;黄芪味甘,性微温,归脾、肺经,功可益气健脾、利水行滞。补骨脂味苦、辛,性温,归肾、脾经,功能补肾助阳、缩尿固精,增君药温补之能,强君药化气之效,故为臣药。莪术味辛、苦,性温,三棱味辛、苦,性平,同归肝、脾二经,均行破血消癥、行气止痛之效,莪术、三棱常相须为用,助君臣药行活血祛瘀、消癥化积之能,共为佐药。五药相合,共育补肾益气、化瘀散结之功效,切中PCa“肾虚血瘀”之病机,已在我院临床应用多年,疗效较好。
前期本研究团队通过模块化聚类处理、关键靶点GO 分析和KEGG 分析,利用网络药理学相关技术,构建了益肾通癃汤的有效成分、药物靶点基因与PCa 疾病靶点的映射网络,筛选预测出的可能靶点涉及调节细胞增殖、凋亡,减轻炎症反应,抑制血管新生,降低氧化应激,细胞外基质降解,生长因子信号传导,AR 调节,阻碍EMT 进程等,尤其集中在调控细胞增殖与凋亡方面[23]。 Wnt/β-catenin 信号通路在PCa 发病中占有重要地位,与肿瘤细胞增殖、凋亡等生物学异常行为关系密切,很有可能是益肾通癃汤干预PCa 的潜在靶点。 结果显示,益肾通癃超微颗粒可以有效改善人前列腺癌骨转移细胞PC3 荷瘤裸鼠皮下移植瘤瘤体组织的病理改变,给药5 组可见程度不一的肿瘤细胞数量减少,部分呈空泡样坏死,细胞核变形及破碎,部分细胞核发生裂解,其中联合用药组的病理变化最为明显。 益肾通癃颗粒还可以显著抑制肿瘤细胞的增殖,促进细胞凋亡的发生,且药效呈浓度依赖性。 Western blot 及免疫组织化学结果发现,益肾通癃颗粒可以下调Wnt/β-catenin信号通路相关基因Wnt1、Wnt3a、β-catenin、APC 蛋白的表达,上调Wnt/β-catenin 信号通路相关基因GSK-3β 蛋白的表达,降低p-GSK-3β 蛋白的活性,且药效与剂量呈正相关性。在抑制Wnt 信号通路激活方面,益肾通癃颗粒的药效不及其阻断剂ICG-001,中西药联用组的疗效最佳。 结果说明,益肾通癃颗粒干预PCa 的作用很可能是通过调控Wnt/β-catenin信号通路来实现的,但中医药的干预作用往往是一个多环节、多靶点、多层次的过程,其药效机制还有待进一步研究。

