基于16S rDNA 高通量测序方法检测猪舍环境微生物群落多样性
樊梅娜,张 修,王丽荣
(山东碧蓝生物科技有限公司/山东省农业微生物技术创新中心,山东 泰安 271000)
我国是世界上最大的生猪生产和猪肉消费国[1],猪肉生产和消费需求旺盛。 在当前非洲猪瘟疫情防控背景下,如何保障生猪养殖业健康发展成为亟须解决的重大问题[2]。2021 年农业农村部印发《非洲猪瘟等重大动物疫病分区防控工作方案》,提出“推动大区内非洲猪瘟等重大动物疫病无疫区、无疫小区和净化示范场创建, 鼓励连片建设无疫区,全面提升区域动物疫病防控能力和水平”。作为非洲猪瘟疫情防控中的重要一环, 维持良好的猪舍环境能够有效减少病原菌滋生和疫病传播[3],因此,系统研究猪舍环境微生物多样性至关重要。
传统猪舍环境微生物的研究多采用空气沉降、菌落平板计数等方法[4],这些方法检测精准度较低,往往只能进行特定病原微生物的检测,无法全面、 系统地反映猪舍环境微生物群落组成及多样性,更无法满足高通量的检测需求[5-6]。 随着高通量测序技术的迅猛发展, 其成功解决了传统方法检测通量低、操作复杂等问题,广泛应用于环境微生物的检测当中[7]。 本研究基于16S rDNA 高通量测序技术, 通过分析不同类型猪舍的环境微生物多样性,了解猪舍环境微生物的多样性、相对丰度及主要病原菌属的特性, 为提升猪舍疫病综合防控能力提供参考。
1 材料与方法
1.1 试验材料
1.1.1 主要试剂
Phusion High-Fidelity PCR Master Mix with HF Buffer、GeneJET 凝胶回收试剂盒, 美国Thermo Fisher Scientific 公 司 产 品;TruSeq DNA Nano Kit,美国Illumina 公司产品;PowerSoilRDNA Isolation Kit,美国MIBIO 公司产品。
1.1.2 主要仪器
SimpliAmp PCR 仪,美国Thermo Fisher Scientific 公司产品;Microplate reader FLx800 蓝色荧光定量系统,美国Bio-Tek 公司产品。
1.2 试验方法
1.2.1 试验猪舍的选取及基本情况
从山东省某农业科技公司规模化养猪场选取保育猪舍(编号:BZ)、分娩猪舍(编号:RZ)和妊娠猪舍(编号:PM)3 种类型的猪舍,均为半封闭式结构,东西走向,自然通风为主,辅以机械通风,南北墙上均装有窗户,西墙装有风机,东墙装有湿帘。
保育猪舍共14 栋, 舍长25 m, 宽10 m,高2.5 m,面积为250 m2,舍内纵向有2 个饲养区,3个走道,共计24 个饲养单元,每单元安排15 头4周龄左右的保育猪,共计360 头。
分娩猪舍共8 栋, 舍长30 m, 宽20 m,高2.5 m,面积为600 m2,舍内纵向有4 个饲养区,5个走道,共有40 个饲养单元,每单元饲养1 头分娩母猪以及10~15 头15 日龄左右的哺乳仔猪。
妊娠猪舍共4 栋,舍长50 m,宽16 m,高2.5 m,面积为800 m2,舍内纵向有4 个饲养区,5 个走道,每列有65 个限位栏,共260 个限位栏,舍内共饲养妊娠母猪240 头左右。
1.2.2 猪舍日常饲养管理
保育猪舍每日定时喂料4 次,清理粪便1 次,饲喂颗粒饲料,适量人工添加;分娩猪舍每日定时投料3 次,清理粪便2 次,饲喂粉状饲料并根据饲喂情况人工适量添加; 妊娠猪舍每日定时投料1次,清理粪便1 次,采用自动料筒饲喂颗粒饲料。采样期间保育猪舍、分娩猪舍、妊娠猪舍内平均温度分别为25、24、21 ℃, 相对湿度分别为54%、68%、50%。
1.2.3 样品采集
采样时间为2021 年8 月,采样位置设在每个猪舍的中央距离地面60 cm 处, 采用空气沉降法采样,每种类型的猪舍选取3 栋猪舍采样,共9 个样 本(BZ1、BZ2、BZ3、PM1、PM2、PM3、RZ1、RZ2、RZ3)。 采样时, 采样人员与猪舍人员均远离培养皿,同时对采样时间、温度和湿度、光照以及风速进行记录。 采样完成后, 将培养皿装入无菌封口袋,做好标记,带回实验室[8]。

图1 97%相似度阈值下各样品的稀释性曲线
1.2.4 总DNA 提取与16S rDNA 高通量测序
采用PBS 缓冲液稀释并溶解样品,用Power-Soil DNA Isolation Kit 提取总DNA, 随后送至山东开亿基因科技有限公司,进行16S rDNA 高通量测序操作。
1.2.5 测序结果分析
将低质量测序序列排除, 在97%阈值下采用QIIME2 软件将9 个样品的有效序列聚类为不同操作分类单元(OTU),统计不同猪舍每个OTU 中的丰度信息。 计算α 多样性指数, 包括Chao1 指数、Shannon 指数、 谱系多样性指数; 分析样品β多样性, 利用Bray curtis 算法比较不同类型猪舍间物种群落结构差异。 利用QIIME2 软件对猪舍环境样品在门和属分类水平上细菌群落的组成和结构进行分析。
2 结果与分析
2.1 猪舍环境样品测序结果及稀释曲线
在过滤掉低质量序列后,9 个样品的有效序列总数为948 595 个,平均测序读长在463~473 bp。在97%相似度阈值下将其聚类为不同OTU, 统计得到不同猪舍样本在不同OTU 中的丰度信息。 9个样品共产生29 126 个OTU(见表1),涵盖了31门66 纲160 目320 科899 属1 831 种的细菌。 9个样品的稀释曲线如图1 所示, 随着取样数量的增加, 曲线已趋于平缓, 提示所采集样品的OTU的覆盖度已经基本饱和,表明取样深度合理。

表1 猪舍环境样本的序列信息
2.2 猪舍环境样品的微生物多样性分析
2.2.1 α 多样性分析
α 多 样 性 指 数 包 含Chao1 指 数、Shannon 指数、谱系多样性指数等,通过综合分析OTU 丰度等信息反映物种多样性信息。 由表1、表2 综合分析可知,不同猪舍的物种多样性存在差异,分娩猪舍以及保育猪舍的Chao1 指数、Shannon 指数及谱系多样性指数整体高于妊娠猪舍。
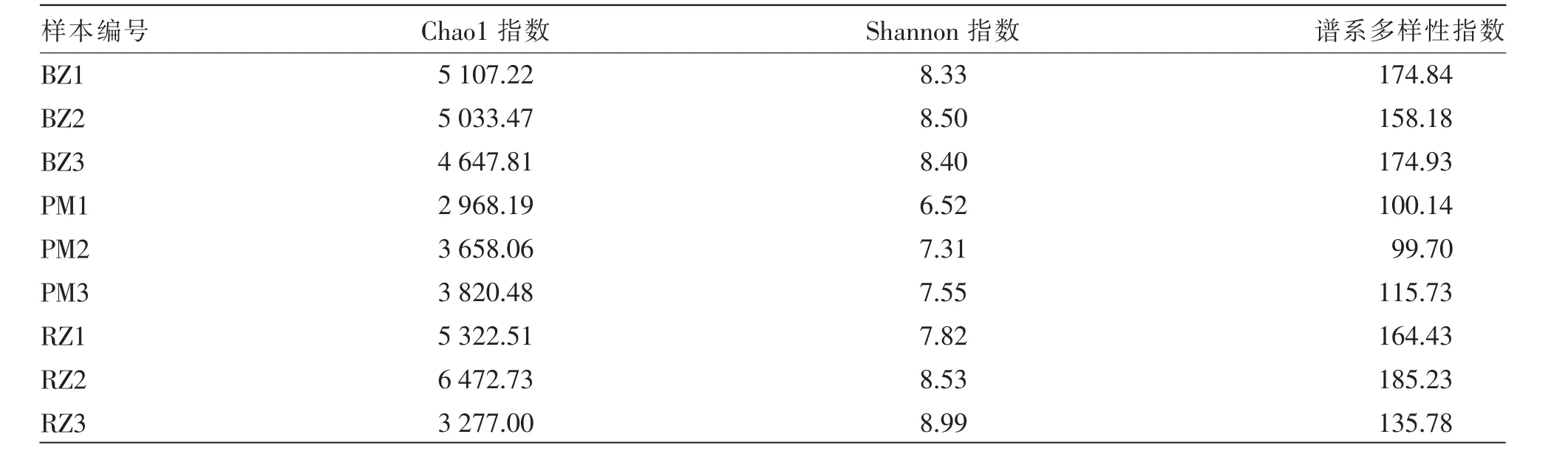
表2 猪舍环境样品微生物α 多样性指数
2.2.2 β 多样性分析
β 多样性分析可以衡量样品在菌群结构多样性方面的差异大小。Bray curtis 的计算结果将系统进化距离的差异显示在三维空间中, 可以作为β多样性的参照。以不同猪舍环境微生物为样品,对各样品的距离矩阵进行主成分分析, 得到β 多样性的主坐标分析(PCoA)结果,如图2 所示,3 个类型猪舍空间距离相隔较远, 表明菌群结构差异较大;与保育猪舍相比,妊娠猪舍和分娩猪舍各样品之间菌群结构差异较小。

图2 不同类型猪舍环境样品微生物β 多样性的主坐标分析(PCoA)图
2.3 猪舍环境样品微生物群落组成分析
2.3.1 细菌门分类水平的比较
如图3 所示,变形菌门(Proteobacteria)、拟杆菌门(Bacteroidota)、厚壁菌门(Firmicutes)和放线菌门(Actinobacteriota)为四大优势菌群,但在不同猪舍中相对丰度各有不同:妊娠猪舍中,变形菌门相对丰度最高,平均达到43%,厚壁菌门和放线菌门的平均相对丰度分别为32%和20%, 拟杆菌门平均相对丰度为4%;分娩猪舍中,变形菌门平均相对丰度达到93%,拟杆菌门、厚壁菌门和放线菌门平均相对丰度相差不大,分别为3%、2%、0.6%;保育猪舍中,变形菌门平均相对丰度为67%,厚壁菌门和拟杆菌门平均相对丰度分别为21%和9%,放线菌门平均相对丰度仅为1%。 结果表明,变形菌门在3 个类型的猪舍中相对丰度均最高, 厚壁菌门、 放线菌门以及拟杆菌门相对丰度在不同类型猪舍中差异较大。
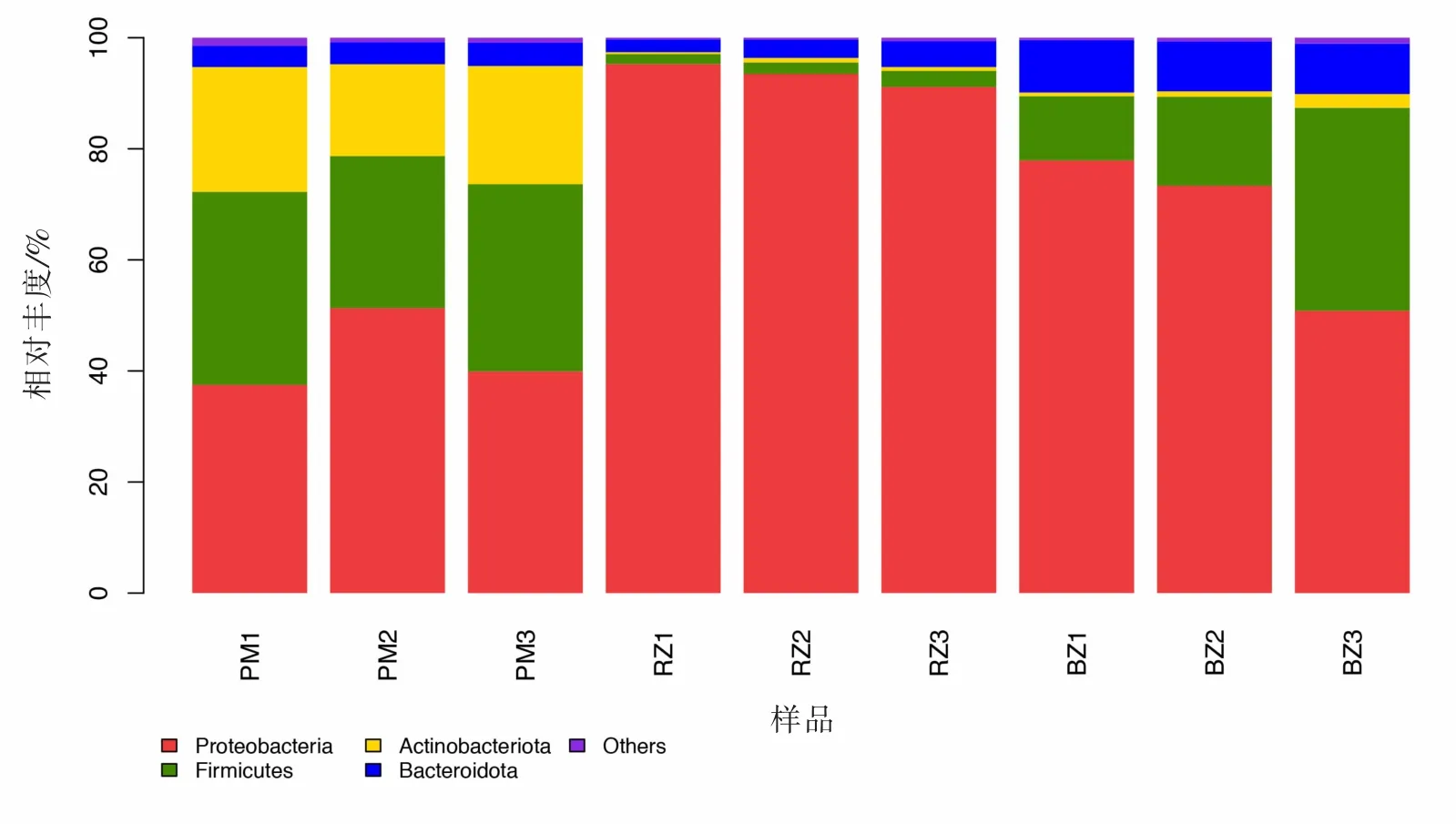
图3 不同类型猪舍环境样品细菌门分类水平的比较
2.3.2 细菌属分类水平的比较
如图4 所示,9 个样品共得到47 种细菌类群,其中,不动杆菌属(Acinetobacter)和假单胞杆菌属(Pseudomonas)在3 个类型的猪舍相对丰度均较高, 平均达5%以上; 寡养单胞菌属(Stenotrophomonas) 在保育猪舍中相对丰度最高,平均达到12%;棒杆菌属(Corynebacterium)在妊娠猪舍中相对丰度最高,平均达到14%;丛毛单胞菌属(Comamonas)和苯基单胞菌属(Phenylobacterium)在分娩猪舍平均相对丰度都为10%,仅次于平均相对丰度为19%的不动杆菌属; 其余各菌属相对丰度较低。
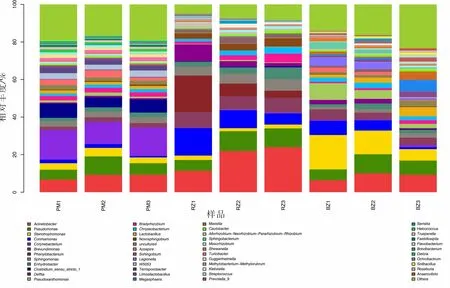
图4 不同类型猪舍环境样品细菌属分类水平的比较
2.4 猪舍环境群落结构的差异分析
为了探究不同猪舍环境样本与微生物群落结构之间的关系, 本研究在31 个不同门类水平上,构建了样品聚类关系树,并以热图(heatmap)的形式展现。如图5 所示,放线菌门、厚壁菌门、拟杆菌门和变形菌门在分支上相近, 且大多为红色或黄色方块,进一步表明这四个菌门丰度相对较高。
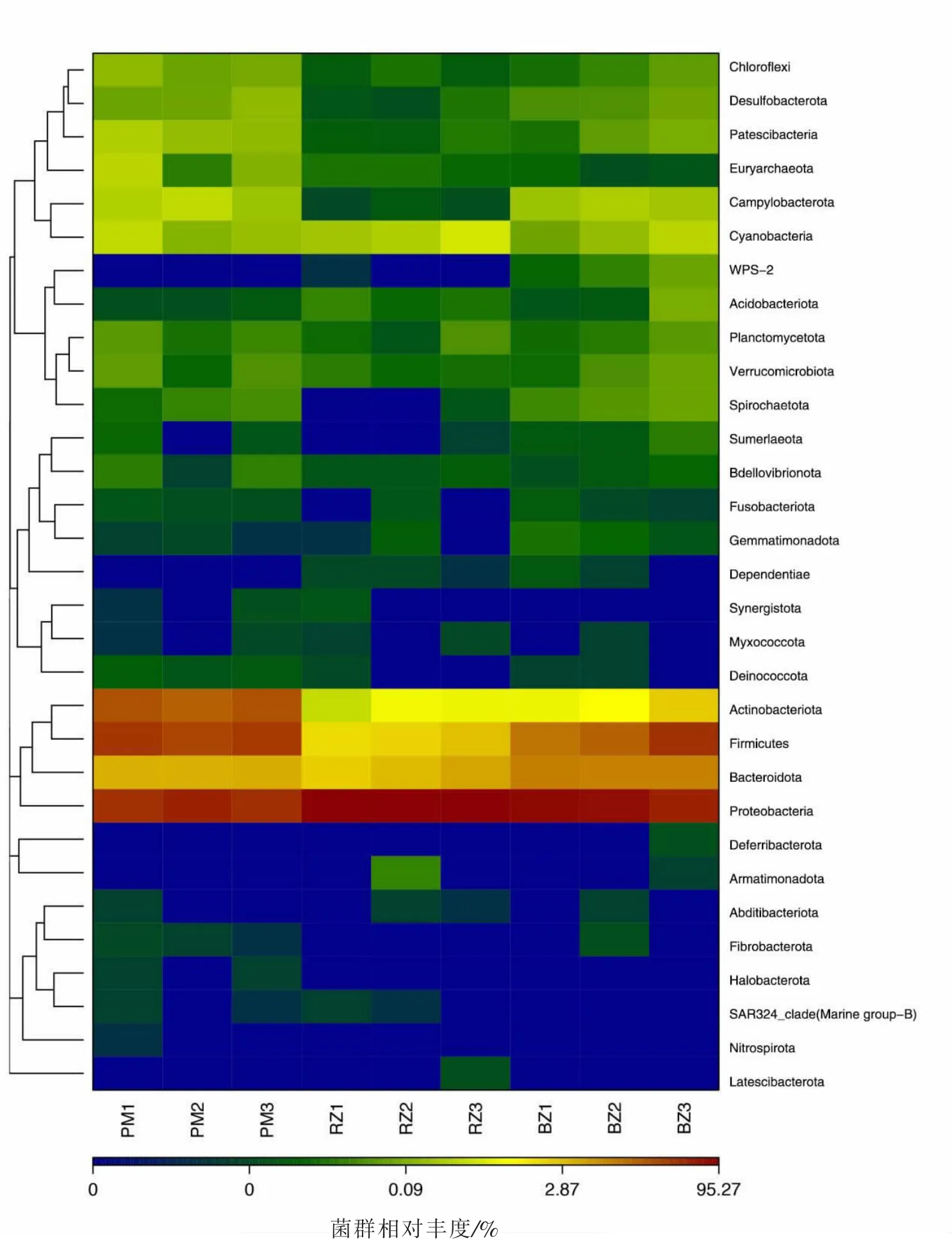
图5 热图分析(门水平)
2.5 猪舍空气中病原菌的分布
通过对猪舍环境空气样本进行属水平上的细菌多样性分析发现(见图4),采样猪舍空气中存在一些潜在的动物致病菌属, 主要包括假单胞菌属(Pseudomonas)、不动杆菌属(Acinetobacter)、寡养 单 胞 菌 属 (Stenotrophomonas)、 严 格 梭 菌(Clostridium_sensu_stricto_1)、 棒 杆 菌 属(Corynebacterium)、 短 波 单 胞 菌 属(Brevundimonas)、特吕佩尔菌属(Trueperella)、创伤球菌属(Helcococcus)、链球菌属(Streptococcus)、军团菌属(Legionella)、沙雷菌属(Serratia)、芽孢杆菌属(Bacillus)、苍白杆菌属(Ochrobactrum)、金黄杆菌属(Chryseobacterium)。 上述动物潜在致病菌的临床意义见表3。

表3 猪舍环境微生物中潜在动物病原菌的临床意义
3 讨论
目前,非洲猪瘟疫情防控形势依然严峻,该病对我国生猪养殖业的影响还在继续。 本研究基于16S rDNA 高通量测序方法,系统分析了规模化猪场不同类型猪舍环境微生物的多样性, 基于97%的相似规律共得到OTU 29 126 个, 涵盖了31 门66 纲160 目320 科899 属1 831 种的细菌。 李红梅等[23]利用16S rDNA 高通量测序方法研究了四川省大型规模化猪场环境微生物多样性, 基于97%的相似规律共得到OTU 27 276 个, 有16 门115 科217 属被鉴定, 本研究揭示的猪舍环境微生物多样性更加丰富。
本研究样品采集自规模化猪场3 种不同类型的猪舍, 样品16S rDNA 高通量测序结果表明,不同类型猪舍的环境微生物多样性存在差异, 分娩猪舍以及保育猪舍在微生物种类、系统进化多样性以及丰富程度上高于妊娠猪舍; 样品群落组成分析也表明,厚壁菌门、放线菌门以及拟杆菌门的相对丰度在3 个类型的猪舍间差异较大, 这可能与养殖密度、猪只营养条件及肠道微生物组成[24-25]、舍内空气流通方式等多种因素相关。
具体到属水平, 不同猪舍在菌群组成和结构上也有所不同。本研究结果表明,寡养单胞菌属在保育猪舍中相对丰度最高,平均达到12%。张鹏飞等[26]研究表明,该属典型菌嗜麦芽窄食单胞菌可导致猪只出现呼吸困难、气喘急促等症状;李超等[27]对猪舍环境微生物气溶胶含量与构成进行分析时发现, 该属细菌在研究的5 个不同养猪环境中均能检测到,含量高达45.5%~81.9%。 本研究结果表明,棒杆菌属在妊娠猪舍中丰度可达14%。张永灿[28]研究表明,棒杆菌属细菌存在于公猪包皮中,可通过配种感染妊娠母猪,严重影响猪只生长速度和生产性能。本研究结果表明,分娩猪舍中不动杆菌属丰度最高。 邱立等[29]在研究陕西省某规模化猪场仔猪腹泻病原菌时分离到该菌属内的鲍曼不动杆菌,该菌可寄生于仔猪体内,感染后并不能诱导免疫反应,从而导致长期慢性感染。 上述3个属的细菌均为条件致病菌, 在养殖环境恶化以及猪只营养不良、免疫力低下时可能会感染宿主,从而造成疫病暴发,养殖效益下降[30]。
本研究表明,猪舍环境微生物种类繁多,在发现的潜在动物致病菌中,有些致病力比较强,如假单胞菌属 (Pseudomonas)、 链球菌属(Streptococcus)、苍白杆菌属(Ochrobactrum)等,值得注意的是,军团菌属(Legionella)、芽孢杆菌属(Bacillus)等的致病性在人上亦有报道[31-32]。 另有研究发现,变形菌门中的大肠杆菌能传播到距离猪舍100 m以外的居民住宅区和养殖场[33]。因此,规模化猪场的养殖环境不仅影响动物健康状况, 而且也会对猪场工人和周边居民的健康造成严重威胁。 研究猪舍环境微生物的组成、丰度以及病原菌差异,对于规模化猪场防止病原滋生、 阻断疫病传播方面具有重要作用。
4 结论
规模化猪场不同类型猪舍环境微生物多样性丰富,变形菌门、拟杆菌门、厚壁菌门和放线菌门为四大优势菌群。 分娩猪舍以及保育猪舍在细菌种类、 系统进化多样性以及丰富程度上高于妊娠猪舍。 研究发现的猪舍环境中潜在动物致病菌属为猪舍环境消毒的药物选择提供了依据。

