红藤水溶性部位的LC-MS分析及抗炎活性成分的虚拟筛选
汤建,曹裕旻,左亚锋,李艳玲,靳彪,夏海平*
(1.亳州学院 中药学院,安徽 亳州 236800;2.江苏大学附属四院 神经内科,江苏 镇江 212001)
红藤[Sargentodoxa cuneata(Oliv.) Rehd. et Wils.]是我国特有的植物,属于大血藤科(以前归于木通科)大血藤属植物,以根、藤入药。红藤为传统中药材,具有清热解毒、理气活血等作用,用以治疗阑尾炎、风湿痹痛、跌打肿痛等[1]。已报道的化学成分包括酚类、有机酸、木脂素、三萜皂苷、黄酮、蒽醌等化学成分,药理研究表明其具有抑菌、抗炎、抗病毒、抑制血小板聚集、增加冠脉血流量、抗心肌缺血等作用[2]。本组研究人员在前期的工作中发现,红藤的75%乙醇提取物经过乙酸乙酯萃取后剩余的水溶性部位(HTW,50 mg/kg)能有效减轻弗氏完全佐剂诱导(AA)的大鼠的继发性肿胀(P< 0.05),显著降低AA大鼠腹腔巨噬细胞中TNF-α和IL-1β的水平(P< 0.01)[3]。
目前,红藤的药理活性研究主要以提取物为主,尚缺少确切的物质基础及作用机制方面的深入研究。近年来获得长足发展的分子对接(Molecular docking)技术在中药有效物质基础研究方面有着广泛的应用前景。针对某一特定的靶点,利用相关软件对中药化合物库进行对接,虚拟筛选出与靶点蛋白结合密切的候选化合物,根据预测结果再进行有针对性的药理实验验证,这将显著提高中药化学成分活性评价的效率,缩短中药药效物质基础的研究进程[4]。
本研究中采用LC-MS分析HTW中的主要化学成分,得到的14个小分子化合物(配体,表1)。同时分析与红藤抗炎相关的通路、靶点[3,5,6],本文选取肿瘤坏死因子-α(TNF-α)等6种蛋白(表2)为对接受体,采用AutoDock Vina软件[7]进行分子对接,虚拟筛选HTW中基于上述6种蛋白的抗炎活性成分,该研究将有助于确定红藤抗炎免疫的潜在物质基础和分子作用机制。
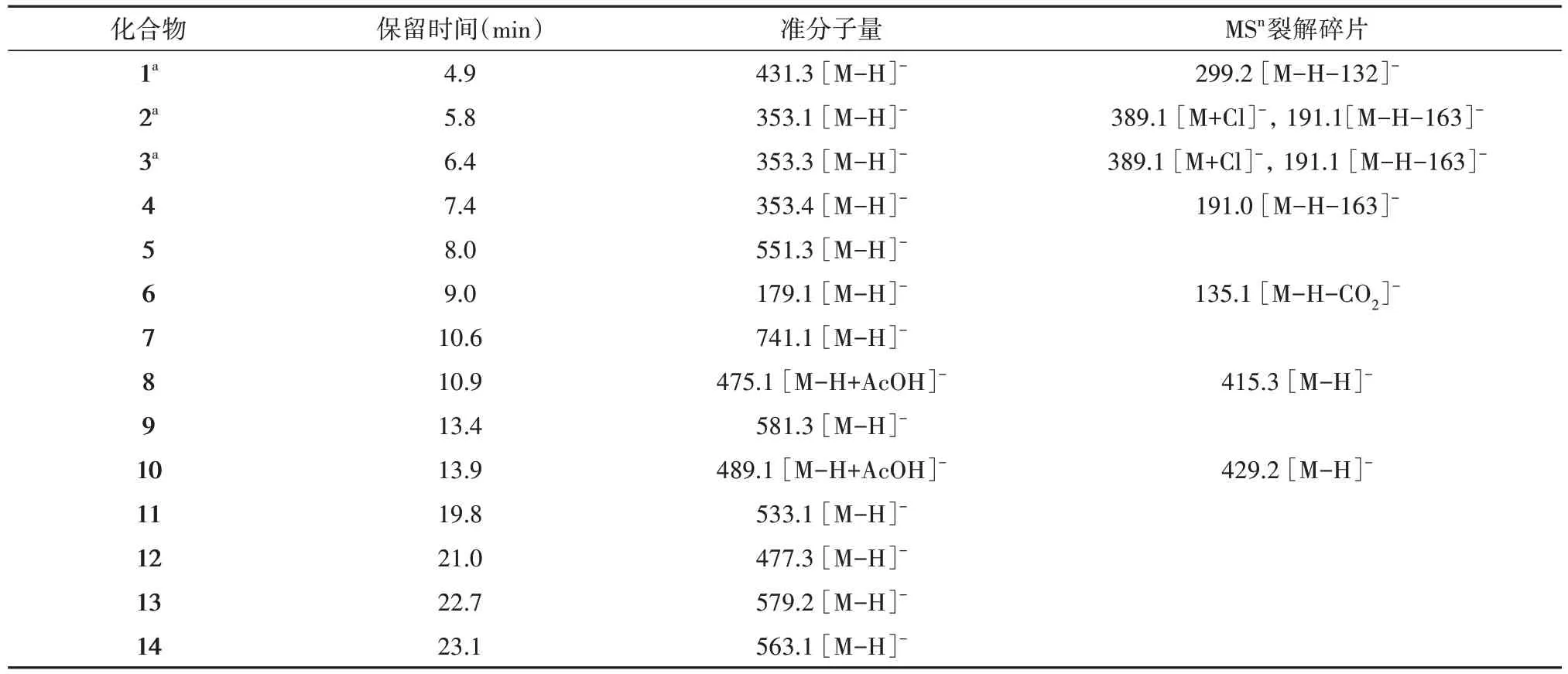
表1 HTW中14个化合物的MS和MS2准分子离子峰Tab.1 The main MS和MS2 fragments of 14 compounds in HTW

表2 6种抗炎靶点蛋白Tab.2 Six proteins associated with anti-inflammation
1 材料和方法
1.1 材料
Thermo LXQ液相色谱离子阱质谱联用仪(美国Thermo Fisher Scientific),Kromasil C18色谱柱(4.6 mm × 250 mm,4.5 μm),流动相用甲醇为色谱纯,超纯水(0.45 μm滤膜),红藤药材于2012年10月购自安徽亳州药材市场(药材经过江苏大学药学院欧阳臻教授鉴定,标本号HT1012),红藤水溶性部位(HTW)由本实验室自制,于-20℃保存。
本研究中采用的软件有ChemOffice Professional软件(美国PerkinElmer公司),AutoDock Tools1.5.6和AutoDock Vina(美国The Scripps Research Institute),PyMOL(TM) 1.7.4.5 Edu(美国Schrodinger,LLC公司)和Discovery Studio 2016 client(美国BIOVIA公司)。
1.2 LC-MS分析HTW中化学成分
LC-MS分析条件:流动相为1%冰醋酸和甲醇(68% : 32%),等度洗脱;柱温:30℃;流速:1 mL/min;检测波长:327 nm;进样量:20 μL。电喷雾离子源(ESI),喷雾电压3.50 kV,毛细管温度300℃,毛细管电压-30 V,透镜电压-100.00 V,鞘气(液氮)流速40 arb,辅助气10 arb,扫描范围:100.00 ~ 2 000.00 m/z,采用负谱全离子扫描方式采集数据。
挑选LC-MS色谱图中含量较高的14种成分(表1)进行分析。4.9 min处的准分子离子峰431.3[M-H]-,其二级质谱MS2为299.2,减少132,推测含有芹糖片段。结合文献[2,8]推测该化合物为osmanthuside H(1)。在5.8 min、6.4 min和7.4 min处均有353的准分子离子峰,前两个化合物MS2均有389.1[M+Cl]-和191.1 [M-H-163]-峰,第三个化合物MS2有191.0 [M-H-163]-峰,结合文献[2,8,9]推测这三个化合物分别为新绿原酸(Neochlorogenic acid,2)、绿原酸(Chlorogenic acid,3)、隐绿原酸(Cryptochlorogenic acid,4)。8.0 min处的准分子离子峰551.3[M-H]-,结合文献[2,8]推测该化合物为Glehlinoside C(5)。9.0 min处的准分子离子峰179.1 [M-H]-,其MS2为135.1,减少44(CO2),结合文献[2,8]推测该化合物为咖啡酸(Caffeic acid,6)。10.6 min处的准分子离子峰741.1 [M-H]-,结合文献[2,8]推测该化合物为鹅掌楸苷(Liriodendrin,7)。10.9 min处的准分子离子峰475.1 [M-H+AcOH]-,其MS2为415.3 [M-H]-,减少60(AcOH),结合文献[2,8]推测该化合物为Icariside D1(8)。类似地,推测13.9 min处的准分子离子峰为化合物phenethyl-O-α-L-rhamnosyl-β-D-glucoside(10)。13.4 min、19.8 min、21.0 min、22.7 min和23.1 min处的准分子离子峰,经与文献[2,8]核对,推测分别为(+)-南烛木树脂酚-9′-O-β-D-葡萄糖苷[(+)-lyoniresin-9′-yl-β-glucoside,9]、野菰苷(Aegineoside,10)、木通苯乙醇苷B(Calceolarioside B,12)、无梗五加苷B(Acanthoside B,13)和5-甲氧基野菰苷(5-methoxyaegineoside,14)。这14种化合物分别属于苯丙酸、苯乙醇苷和木脂素类成分。ChemDraw软件绘制分子结构(图1),并用Chem3D转化成三维结构,MM2力场进行最小能量优化,结果保存为mol2格式。AutoDock Tools1.5.6对小分子进行加氢,计算Gasteiger电荷,合并非极性氢,最终保存为pdbqt格式文件,以备AutoDock Vina进行分子对接。

图1 HTW中14种化合物结构Fig.1 Chemical structures of 14 compounds in HTW
1.3 靶标蛋白结构的获取和预处理
前期研究[3]发现HTW对TNF-α和IL-1β有明确的抑制作用,因此本文中选取包括TNF-α、Caspase-1(IL-1β转化酶)在内的6个与红藤抗炎密切的靶点蛋白(表2),并通过检索PDB结构数据库(http://www.rcsb.org)下载对应的靶点蛋白晶体复合物PDB文件,将这些文件依次导入PyMOL软件中,删除原配体、水分子、无机物以及有机物,在AutoDock Tools1.5.6软件中加氢,保存为pdbqt格式,以备AutoDock Vina进行分子对接[6]。
1.4 参数设置和分子对接
AutoDock Vina 采用的是格点对接,均方根偏差(RMSD)在2Å范围内,其他参数均为缺省值,分别进行20次对接。受体蛋白的晶格中心设置见表2,对接空间(Grid Box):40 nm × 40 nm × 40 nm,能量范围为4。将靶点蛋白晶体复合物中化合物(配体)取出,重新与受体对接,其对接值为阈值。
HTW中14个化合物(图1)分别与表2中6种靶点蛋白对接,显示前9位的结合态的结合能打分值,均选择第一行(即dist from rmsd l.b.值和best mode rmsd u.b.值均为0)的打分值。根据能量打分值确定潜在的活性物质基础,将能量值优于或接近阈值的化合物认定为HTW中主要的抗炎活性成分。
2 结果与分析
本研究将HTW中含量较为丰富的14个化合物分别靶点蛋白Caspase-1、IKK-β、TNF-α、iNOS及TLR2进行对接。综合化合物结合能、阈值以及平均值等方面评价(图2)显示,TLR2对化合物最为敏感,与新绿原酸(2)、绿原酸(3)、鹅掌楸苷(7)、野菰苷(11)、木通苯乙醇苷B(12)、无梗五加苷B(13)的结合能均超过-9.0 kcal/mol,远超过阈值-7.2 kcal/mol,其中与化合物12结合力最强,为-9.7 kcal/mol。特别是该部位中比较丰富的化合物2和3,均与TLR2有较好的结合力,进一步提示,绿原酸类化合物对抗炎活性发挥着较大的作用。iNOS对HTW中化合物也较敏感,特别是化合物10和11的结合能分别为-9.8 kcal/mol和-9.4 kcal/mol,超过自身阈值-9.3 kcal/mol。对TLR2及iNOS最敏感的木通苯乙醇苷B(12)、phenethyl-O-α-L-rhamnosyl-β-D-glucoside(10)均为苯乙醇苷类化合物,说明该类化合物可能也是红藤抗炎活性的重要物质基础。野菰苷(11)的衍生物(13)与TLR2及iNOS均有较强的结合能(-9.0 kcal/mol,-8.9 kcal/mol),说明木脂素类化合物可能也对红藤抗炎作用有重要贡献。但IL-6(PDB ID:1ALU)和Caspase-1(PDB ID:1RWN)与化合物的结合能普遍较低,其平均值(M2)仅有-6.2 kcal/mol和-6.8 kcal/mol。

图2 化合物1-14与6种靶点蛋白对接结合能Fig.2 Affinity scores of compounds 1-14 docking with 6 proteins
而在众多药理实验中均表现较好药理活性的咖啡酸(6)对6种蛋白的结合能均较低,平均值仅-6.7 kcal/mol,这可能是因为配体化合物除了应具有相关的官能团外还应具备一定的空间体积,以便于与所处位置的氨基酸残基有较强的结合,而咖啡酸分子量较小,相对其他13种化合物,其结构较简单[10]。
通过图3A可见,化合物10较好地嵌在2Y37(iNOS)的空腔中,表现出较强的结合能力(-9.8 kcal/mol),且超过其阈值-9.3 kcal/mol。分子对接平面图(图4)中可见其与2Y37蛋白中的ILE238等氨基酸残基之间存在范德华力;葡萄糖糖环内氧与GLY365之间、4′-OH的氢与TRP366之间分别形成氢键;苯环与TRP188、PHE363之间存在Pi-Pi作用;苯环与LEU203之间形成Pi-Alkyl作用;鼠李糖3′′-OH的氧与PRO344之间、4′′位碳与GLN257之间分别存在一种弱的氢键。

图3 化合物10与2Y37(A)及化合物12与5D3I(B)分子对接图Fig.3 Docking of compound 10 with 2Y37 (A) and 12 with 5D3I (B)

图4 化合物10与2Y37蛋白分子对接平面图Fig.4 2D diagram of compound 10 docking with protein 2Y37
通过图3B可见,化合物12几乎完全被封装在5D3I(TLR2)的“口袋”中,表现出较强的结合能力(-9.7 kcal/mol),远超过其阈值-7.2 kcal/mol。分子对接平面图(图5)中可见其与5D3I蛋白中的LEU334等氨基酸残基之间存在范德华力;苯乙醇片段中3-OH的氧VAL303、咖啡酸片段中的4′′-OH的氢同时与LEU292、GLY291形成氢键;上述两种片段中的苯环分别与VAL302和LEU289形成Pi-Alkyl作用,后者的苯环与PHE325形成Pi-Pi作用力。糖中2′-OH氢、咖啡酸片段中的3′′-OH的氧与ASN296、ASN290之间存在斥力。

图5 化合物12与5D3I蛋白分子对接平面图Fig.5 2D diagram of compound 12 docking with protein 5D3I
3 讨论
红藤是临床上常用的祛风除湿、抗炎止痛中药材,前期的研究中发现其水溶性部位(HTW)能有效减轻AA大鼠的继发性肿胀,对其腹腔巨噬细胞产生的TNF-α和IL-1β抑制率分别为22%和55%,作用强度接近于阳性对照药雷公藤多苷[3]。红藤的提取物还对IL-6、iNOS等炎症因子以及NF-κB通路均有良好的抑制作用[3,11],网络药理学研究也提示TNF-α、IL-1β以及TLR2可能是红藤抗炎的关键靶点蛋白[12]。为了进一步发现HTW中潜在的抗炎物质以及抗炎作用机制,本研究中采用AutoDock Vina软件,对与红藤抗炎密切相关的6种蛋白TNF-α、IL-1β、IL-6、IKK-β、iNOS及TLR2等进行了分子对接,虚拟筛选出关键蛋白和活性化合物。
与前期的细胞实验中抑制TNF-α的报道一致,HTW中确有一些化合物,如:1-3、7、10和14对2AZ5蛋白(TNF-α)的结合能均超过-8.0 kcal/mol,接近或强于阈值(-8.5 kcal/mol)。这些化合物可能与HTW抗炎、抑制TNF-α有关。TNF-α在类风湿关节炎的病理过程中居中心地位,TNF-α能诱导其它细胞产生更加广泛的致炎物质,针对TNF-α的小分子抗炎免疫药物筛选是重要的工作,也是重要抗炎免疫的重要调节因子[13]。但HTW中化合物对Caspase-1的结合能普遍较低,这与前期实验数据[3]不一致,可能因为分子对接的预测本身和实际有不一致的地方,也可能是HTW抑制IL-1β是通过其他通路进行的。IL-6与化合物的对接值普遍较低,其平均值(M2)是6种蛋白中最低的,这与药理实验结果[2]以及网络药理学预测[12]不一致。IL-1β和IL-6是抗炎的关键靶点[14],但目前的对接方式未能体现其抗炎的关键作用,说明需要改进。
根据分子对接结果(图2),除化合物6外,其他13个化合物与iNOS(2Y37)和TLR2(5D3I)的结合能在-8.1 ~ -9.8 kcal/mol之间,其均值(M2)分别为-8.6 kcal/mol和-8.8 kcal/mol,表现出较强的结合能力,可能是潜在的关键靶点。这与文献[12]中关于TLR2可能是抗炎关键靶点的预测是一致的,但在前期的药理实验中未曾发现。一氧化氮(NO)是炎症反应的重要调节分子,iNOS作为合成NO的调控因子,成为众多天然小分子抗炎的治疗靶点[15]。TLR2通过MyD88促进转录因子NF-κB激活,指导下游炎症介质的释放,成为抗炎免疫的重要靶点[16]。根据本次实验,绿原酸和以化合物10、12为代表的苯乙醇苷等成分可能是HTW的最重要的抗炎活性物质;其抗炎活性与TNF-α、iNOS、TLR2等靶点密切相关,后续进一步的研究中,将重点关注这些炎症因子。

