非小细胞肺癌EGFR-TKI靶向治疗与细胞焦亡的关系
陈家琛,吴听雨,夏伟梁
0 引言
肺癌是当今危害极大的癌症之一,其中80%~85%为非小细胞肺癌(NSCLC)[1]。NSCLC常见的基因突变有EGFR突变、ROS1融合、RET融合、ALK易位、MET剪接位点突变、ERBB2突变和BRAF突变等[2]。EGFR突变是肺腺癌中最常见的突变类型,约占10%[3]。EGFR突变患者使用酪氨酸激酶抑制剂通常能显著延长患者的生存期,大大改善预后。然而,治疗后仍不可避免地产生耐药性[4],因此对靶向治疗机制的进一步探究显得尤为重要。
细胞焦亡是近年新发现的一种细胞死亡方式,通常是通过切割GSDM(gasdermin)家族蛋白后形成N端游离的肽段,这一肽段会诱导细胞形成孔道并导致细胞破裂,从而释放胞质成分[5]。许多研究证明细胞焦亡与肿瘤治疗关系密切,然而对于肿瘤发展的影响尚存在争议[6]。鲜有研究关注非小细胞肺癌中靶向药物与焦亡的关系、不同EGFR突变对靶向治疗的不同响应是否与其产生的细胞死亡方式有关。因此,本研究旨在探讨非小细胞肺癌不同EGFR突变体中靶向药物治疗与细胞焦亡之间的关系,并评估其在提高疗效中的作用,为非小细胞肺癌的治疗提供新的思路,以进一步提高患者的生存率和生活质量。
1 材料与方法
1.1 细胞株和试剂
人肺癌A549细胞、鼠肺癌Lewis(LLC)细胞(中科院细胞所);培养基和0.25%胰蛋白均购自美国Gibco公司;CCK-8试剂盒购自上海陶术生物科技有限公司; 特级胎牛血清(乌拉圭)购自上海雅酶生物公司;高糖DMEM、MEM和PBS均购自美国HyClone公司;无血清冻存液、5×蛋白上样缓冲液、RIPA强裂解液、PMSF裂解液、10% SDS、Tris-盐酸缓冲液、PAGE胶凝固剂、促凝剂、BCA蛋白浓度测定试剂盒和ECL化学发光显色液均购自上海雅酶生物公司;AKT抗体(4060S)、Caspase-3(9662S)、ERK抗体(12950S)、GSDMD(69469S)和GSDME(19453S)均购自美国CST公司;GAPDH、β-actin和β-Tubulin均购自美国Proteintech公司。
1.2 方法
1.2.1 蛋白质印迹实验 细胞收集后加入RIPA裂解液及相关蛋白酶抑制剂使其充分裂解,并用BCA溶液进行蛋白浓度定量检测,以便后续进行电泳上样体积确定。将配置好的蛋白样品加入PAGE凝胶后按120 V进行80 min电泳。电泳结束后300 mA 90 min转膜。转膜结束后用高蛋白奶粉,TBST缓冲液配制成5%的封闭液封闭60 min,一抗溶液中孵育过夜。次日经TBST溶液洗涤后于相应二抗溶液中孵育1 h。最后采用化学发光仪器进行目的蛋白显像。
1.2.2 稳转细胞株的构建 将需要构建稳转细胞株的细胞铺到96孔板中,每孔3 000个细胞接种。待细胞贴壁后,以含慢病毒的培养液(2倍浓度梯度稀释的慢病毒)培养细胞(感染复数MOI=慢病毒体积×慢病毒滴度/细胞数量)。根据目标细胞的MOI值,使用慢病毒转染目标稳转细胞株。转染慢病毒12 h后需更换新的完全培养液继续培养细胞。换液48 h后,在倒置荧光显微镜下观察样孔中细胞状态和带荧光细胞比例。最后通过在培养基中加入特定抗生素来筛选和传代细胞一周以上。而后将细胞接种到12孔板中,收集蛋白进行Western blot实验验证。
1.2.3 乳酸脱氢酶实验 在96孔板中每孔铺3 000~5 000个细胞(实验孔周围加满PBS缓冲液,防止水分蒸发造成实验误差)。待细胞长至80%~90%密度,进行药物处理。实验处理时间结束后,细胞在含有0.04% Triton X-100、2 mmol/L HEPES和0.01%BSA(pH7.5)裂解缓冲液中裂解15 min,而后用50 µl细胞裂解液与含0.34 mmol/L NADH和2.5 mmol/L丙酮酸钠的500 mmol/L磷酸钾缓冲液(pH7.5)150 µl混合。孵育30 min后,在酶标仪上用吸光度340 nm监测变化90 s以上。将获得的实验组LDH值与对照组中测定的LDH值进行归一化,计算细胞存活百分比。
1.2.4 小鼠皮下肿瘤模型构建 提前一周购买5周龄SPF级雄性C57/BL6小黑鼠,并在SPF级动物房饲养。每只小鼠接种100万个细胞,种植体积50 µl。第二天观察小鼠状态。后续每隔两天观察一次小鼠状态和皮下瘤形成情况。待皮下成瘤后,对小鼠随机分组,按照实验安排对小鼠进行给药处理。给药方式为灌胃给药(奥希替尼:25 mg/kg,3次/周), 药物配方:5% DMSO+40%PEG300+5% Tween-80+50% 0.9%氯化钠溶液(配制成5 mg/ml奥希替尼)。每天观察小鼠状态。待皮下肿瘤成瘤后,每隔两天记录小鼠体重变化,测量肿瘤大小(V=0.5×长度×宽度2)。
1.2.5 细胞增殖和毒性检测 在96孔板中每孔铺3 000~5 000个细胞,待细胞长至合适密度,进行转染或药物等处理。实验处理时间结束后,将CCK-8试剂和新鲜培养液按照1:9比例稀释后加入96孔板中,每孔100 µl,而后继续在培养箱中孵育0.5~3 h,孵育1 h后在酶标仪上选择450 nm波长的吸光度进行检测。
1.2.6 酶联免疫吸附实验 收集血样后,室温放置30 min使其自然凝固后,2 000 r/min,离心20 min,收集上清液,配制标准品后点板,酶标板贴上封板膜,室温反应2 h,撕开封板膜,用洗涤缓冲液400 µl洗4遍。充分去除洗涤缓冲液后将试剂盒中的酶标目的检测抗体工作液加入到每个样孔中,每孔200 µl。将酶标板贴上封板膜,室温反应2 h。撕开酶标板加上封板膜,洗涤缓冲液将所有样孔洗4 遍,每遍1 min。配置底物反应液,加入洗好后的酶标板样孔中,每孔200 µl。在酶标板样孔中加入50 µl终止反应液,样孔中的颜色由蓝色转为黄色,完成上述步骤后30 min内在酶标仪上测量450 nm波长处吸光度。
1.3 统计学方法
GraphPad Prism 8软件进行统计分析,Adobe InDesign软件排图。所有数据以均数±标准差(±s)表示。两组数据组内比较采用配对t检验;多组间比较采用方差分析(ANOVA)。P<0.05为差异有统计学意义。
2 结果
2.1 构建EGFR野生、突变细胞模型
为了在体外细胞模型和体内动物模型中模拟临床上EGFR突变患者对于EFGR-TKIs疗法的响应程度,选择在鼠源细胞系LLC中导入人源EGFR突变序列,最终构建EGFR突变细胞模型,并设定了以下实验组:EV、EGFR-WT、L858R、T790M、19Del和20ins。细胞系构建完成后,通过蛋白质印迹实验进行验证。稳转细胞株中EGFR的表达都远高于未导入的细胞株的水平,且根据L858R突变抗体进一步验证了EGFR-L858R突变的成功导入。EGFR的相关下游通路,如pERK被不同程度激活,pAKT在L858R及T790M中被一定程度激活,这也辅助验证了EGFR突变构建成功,见图1A。本研究还验证了构建好的细胞系增殖水平,见图1B,可以看到相比EV组,构建的EGFR突变稳转株的细胞增殖水平略有提高,这可能是导入EGFR突变后增加了肿瘤细胞的恶性程度。

图1 构建LLC细胞系的EGFR野生、突变稳转株Figure 1 Establishment of LLC cell lines stably express EGFR-WT and EGFR-mutated
2.2 奥希替尼处理EGFR特定突变细胞模型
首先我们通过对细胞进行72 h药物处理,CCK-8测定EGFR稳转株对奥希替尼的响应度,图2A中可以观察到,相比EV组,其他突变稳转株对药物的敏感度都有所提高,并确定后续用药浓度为1 μmol/ml。在药物处理组中部分细胞形态肿大,膜被明显破坏,符合发生焦亡时的表型,尤其是在L858R以及T790M中这一现象尤为明显,见图2B。因此我们推测EGFR-L855R、EGFRT790M、EGFR-19del突变细胞株在药物处理后发生的细胞死亡方式里包括焦亡。

图2 构建的EGFR野生、突变稳转株对Osimertinib(1 μmol/ml)的药物敏感度Figure 2 Sensitivity of wild-type and mutated EGFR LLC cell lines to osimertinib (1 μmol/ml)
因此我们对细胞继续用药物处理72 h后采样测定其LDH释放水平,见图3。结果发现,处理72 h后,在EGFR-T790M和EGFR-L858R突变细胞株中都发现有较强的LDH释放(P=0.039、P=0.0013)。

图3 LLC细胞经Osimertinib(1μmol/ml)处理72h后LDH释放水平Figure 3 Levels of LDH released in LLC cells treated with osimertinib (1 μmol/ml) for 72 h
2.3 TKI靶向药物处理后可发生GSDME介导的细胞焦亡
细胞形态和LDH测定的结果,让我们推断经过TKI处理后,EGFR-L858R以及EGFR-T790M可能发生了细胞焦亡。鉴于临床上,EGFR-L858R突变患者比例较大,因此后续实验我们主要关注在EGFR-L858R突变上。后续的蛋白质印迹实验结果表明,在接受药物处理的L858R突变株中观察到明显的GSDME蛋白切割,见图4A。对蛋白表达水平进行量化,可以看到接受药物处理的L858R细胞株中,GSDME-N(图4B)以及cleaved Caspase-3(图4C)的蛋白水平显著高于其他实验组(P<0.0001)。
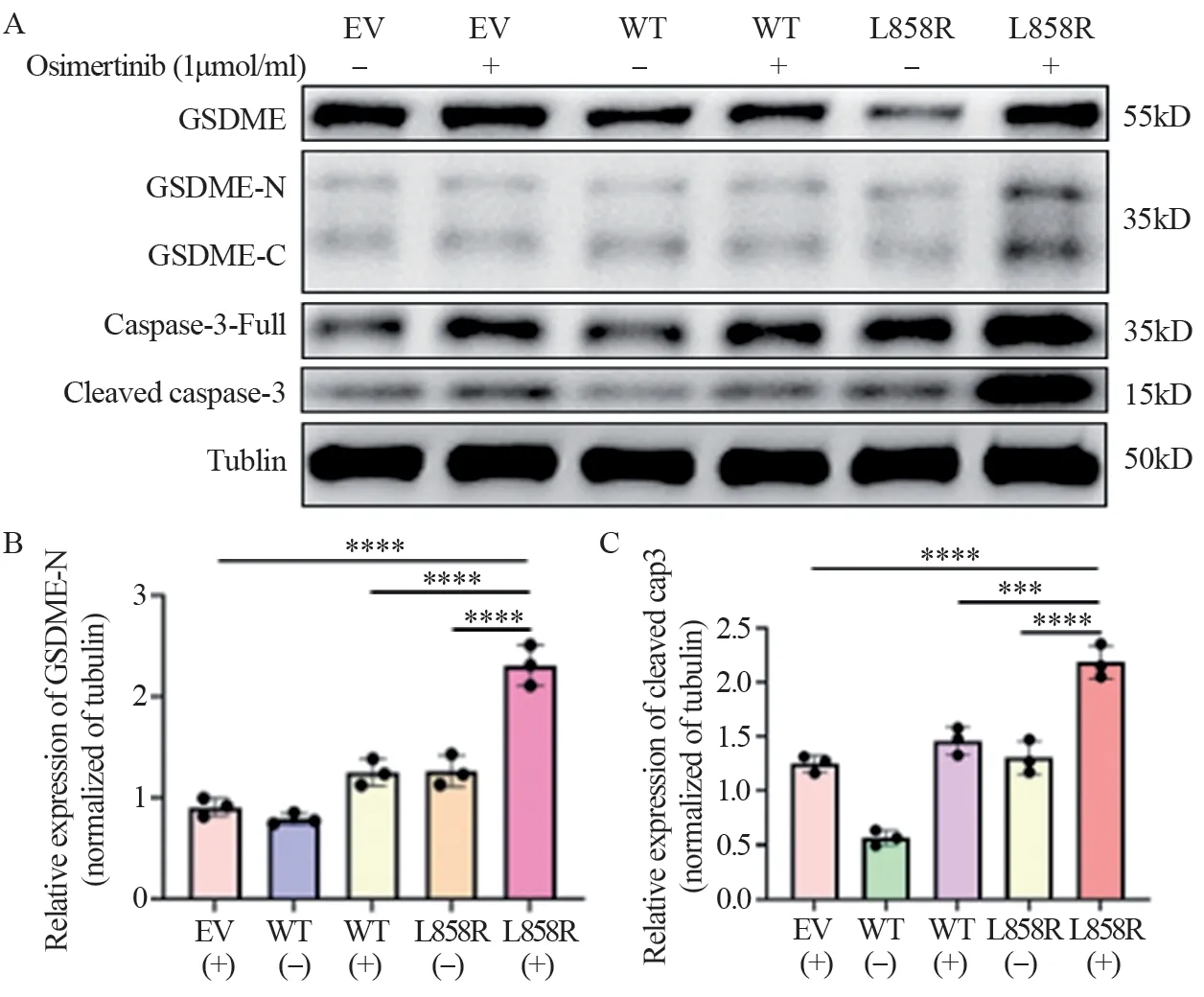
图4 1μmol/ml Osimertinib处理72h后对LLC-EGFR-L858R蛋白水平的影响Figure 4 Effect of 72-hour treatment with osimertinib (1 μmol/ml) on the protein levels of LLC-EGFR-L858R
2.4 过表达GSDME后奥希替尼对肿瘤的抑制提高
通过结晶紫实验分别验证沉默GSDME及过表达GSDME后TKI的处理结果。经过1 µmol/ml的奥希替尼处理72 h,可以看到通过沉默GSDME在很大程度上遏制了TKI的治疗水平,另外过表达GSDME也在一定程度提高了细胞焦亡的程度,因此经过药物处理后GSDME-OE组细胞数量显著低于其他两组(P=0.0486;P=0.0284),见图5。

图5 GSDME表达水平对奥希替尼处理效果的影响Figure 5 Effect of GSDME expression levels on osimertinib treatment
2.5 动物实验验证肿瘤抑制水平
选用C57/BL6小鼠进行皮下肿瘤细胞模型的构建,选择构建好的LLC稳转株。实验共计分为五组即WT(-)、WT(+)、L858R(-)、L858R(+)、L858R-GSDME-OE(+)。每组四只,每只小鼠分别注射特定肿瘤细胞数量为5×105。在注射肿瘤细胞五天后开始给药,并持续记录小鼠体重和肿瘤大小。其中小鼠体质量和肿瘤体积变化趋势,见图6A、B,可以看到使用我们选择的药物浓度不影响小鼠的正常生长发育,从肿瘤大小和Ki-67表达水平可看出,L858R(+)和L8585RGSDME-OE(+)这两组的效果较好,有效抑制了肿瘤的增殖,见图6C和6D。

图6 GSDME过表达可有效提高奥希替尼对小鼠的治疗效果Figure 6 Overexpression of GSDME enhanced therapeutic efficacy of osimertinib on mice
2.6 奥希替尼处理后产生的细胞焦亡与肿瘤免疫治疗的潜在联系
L858R及L858R-GSDME-OE小鼠体内的IL-1β水平远高于其他对照组,这有利于免疫细胞的募集。L858R处理组和未处理组相比,IL-18的水平经过药物处理后降低(P<0.0001),见图7。

图7 奥希替尼治疗后小鼠体内IL-1β和IL-18水平Figure 7 Levels of IL-1β and IL-18 in mice after osimertinib treatment
3 讨论
肺癌的治疗方式越来越多,但死亡率仍居高不下,每年约造成176万人死亡[7]。值得注意的是,中国每年约有63.1万人死于肺癌[8],且肺癌发生率逐年攀升。临床上,常用的酪氨酸激酶抑制剂虽然显著改善了预后,但耐药性的出现仍是棘手的问题。在已有的基础上解决耐药或者探索新的治疗方式是临床上的趋势。本研究基于临床现状[9],构建了EGFR-EV、EGFRWT、EGFR-L858R、EGFR-T790M、EGFR Exon19del(Del_746-751)、EGFR Exon20ins(D770_N771>ASVDN)突变细胞株。EGFR基因中最常见的突变:外显子19缺失以及外显子21的Leu858Arg(L858R)点突变,这两个突变约占所有EGFR突变的45%[10]。2017年邵峰团队的研究[11]发现化疗药物可以引发GSDME主导的细胞焦亡。为了观察焦亡现象,我们常用的方法是观察经过处理后的细胞形态以及LDH的释放水平。本研究结果显示,与其他突变相比,L858R突变的细胞主要通过细胞焦亡而死亡,并且提高焦亡水平可以进一步增强奥希替尼的治疗效果。
由于细胞焦亡是一个比较新的概念,很多治疗方式是否造成焦亡往往容易被忽略。本研究发现,由于EGFR-L858R细胞株经药物处理后以焦亡为主要细胞死亡方式,由此推测药物对肿瘤的抑制效果与焦亡的发生程度相当。通过过表达介导焦亡发生的GSDME基因,本研究成功实现了提高焦亡水平的可能。细胞与动物实验中,过表达GSDME后,药物处理效果都显著高于普通的EGFR-L858R细胞株。临床上虽然不能通过调控焦亡的程度来提高治疗水平,但可以在患者的筛选中发现更易发生焦亡的肺癌患者,更好地设计治疗方案。
临床上,已经有许多治疗方案将TKI治疗和免疫治疗联用并取得一定的效果,但并非所有患者都能从这种联合治疗中受益,且毒性发生率相对较高[12]。目前关于焦亡的研究发现,细胞焦亡通常会伴随炎性因子的大量释放,如IL-1β以及IL-18[13],本研究通过ELISA实验发现,经过药物处理后的小鼠血液中IL-1β水平提高,IL-18水平下降。有研究表明IL-1β信号转导可诱导DC细胞成熟和单核细胞分化为DC和炎性巨噬细胞[13]。IL-18可以促进Th2反应和血管生成。这意味着在没有其他细胞因子的情况下,肿瘤细胞中的迁移和侵袭增加,导致肿瘤微环境更加恶性[14]。因此,我们推测经过TKI靶向治疗后,肿瘤细胞焦亡释放大量炎性因子,引发强烈的不良反应。最终,这对肿瘤免疫可能起到了正向调节作用。鉴于焦亡对肿瘤微环境的影响尚未明确,该部分研究有待进一步开展,但深挖焦亡机制有望为临床上肺癌患者的治疗带来新的视角。本研究使用的是鼠源的EGFR突变细胞进行实验验证,虽然与临床上的数据接近,但是否完全对应还需更多临床试验来验证。综上,本研究结果为肺癌治疗提供了新的思路和方法,也为深入探究肺癌治疗机制提供了重要的参考。
利益冲突声明:
所有作者均声明不存在利益冲突。

