一款益生菌复合制剂双向调节斑马鱼肠道动力作用研究
◎ 吴绮霞,高前程,梁枝聪,郭亚娟,高业成,丰时运
(1.广东完美生命健康科技研究院有限公司,广东 中山 528400;2.完美(广东)日用品有限公司,广东 中山 528400)
肠道运动能力的强弱在一定程度上影响着肠道的生理功能,最终影响着人体的健康[1]。肠道动力紊乱是肠易激综合征(Irritable Bowel Syndrome,IBS)症状发生的重要病理表现[2]。以腹泻为主的IBS 患者呈肠道动力亢进的表现,肠道收缩次数增加,排泄次数频繁,大便性状改变;便秘型IBS 则表现为肠道动力不足,排泄困难。此外,还有以上两种肠动力异常类型的混合型及不定型IBS。这类疾病的发病机制可能与饮食、内脏敏感性、神经心理、胃肠道炎症和肠道动力紊乱等多种因素相关[3]。
益生菌是一种具有多种益生作用的微生物,对人体健康有重要作用。具有肠道定植能力的益生菌能通过改善肠道菌群提高消化系统的营养吸收能力以及机体免疫力[4-6]。所以,研究开发能够调节肠道动力的益生菌功能食品,有助于对肠道动力紊乱疾病进行有效的预防和治疗。
斑马鱼被广泛应用于研究疾病机制和药物研发及筛选[7-8],其与人类的遗传基因高度相似,且其肠道结构和解剖结构与哺乳动物非常相似[9],是肠道疾病研究的理想模型。发育至5~6 d 的幼鱼,肠道会自发蠕动,可通过统计幼鱼肠道蠕动次数评价药物的肠道功能活性[10]。本文利用斑马鱼模型,研究了益生菌复合制剂中的复合益生菌定植能力、促进肠道蠕动作用以及缓解由番泻叶引起的非细菌性腹泻作用。
1 材料与方法
1.1 实验动物
野生型AB 品系斑马鱼,自然成对交配繁殖,年龄为受精后4~5 d,用于肠腔定植、促肠道蠕动、改善非细菌性腹泻实验。用28 ℃养鱼用水(pH 值为6.5~8.5,硬度为50~100 mg·L-1CaCO3,电导率为450~550 μS·cm-1)饲养斑马鱼,实验所用斑马鱼由杭州环特生物科技股份有限公司养鱼中心提供,实验动物使用许可证号为 SYXK(浙)2012-0171,饲养管理符合国际 AAALAC 认证(认证编号:001458)要求。
1.2 材料与试剂
益生菌复合制剂(主要成分为植物乳植杆菌LPPerfectus®001、鼠李糖乳酪杆菌LRPerfectusTM158、鼠李糖乳酪杆菌HN001、嗜酸乳杆菌NCFM、动物双歧杆菌乳亚种HN019),由完美(广东)日用品有限公司提供,淡紫红色粉末,1.5 g/袋,345 亿CFU/袋,-20 ℃保存。使用前将益生菌复合制剂常温放置1 h,准确称取0.15 g 于15 mL 离心管中,向其中加入10 mL 0.01 mol·L-1PBS,振荡混合均匀,益生菌的最终浓度为3.45×108CFU·mL-1。将菌液于4 ℃,4 000 r·min-1离心5 min,弃去上清液,并重复2 次,将益生菌复合制剂中添加的辅料清洗干净,现配现用。尼罗红Nile Red:批号SLBP9326V,Sigma,用DMSO 配制成浓度为 10 mg·mL-1的母液,-20 ℃保存,使用前用胚胎培养液配制成10 ng·mL-1溶液。CM-DiI(红色荧光):批号C5324420,翌圣,使用前,加入50 μL DMSO 使其彻底溶解,然后使用PBS 将其稀释至工作浓度5 μg·mL-1,现配现用。二甲基亚砜(DMSO):批号20210701,天津市大茂化学试剂厂;甲基纤维素:批号20210402,国药集团化学试剂有限公司;磷酸缓冲盐溶液(PBS):批号8122734,gibco 公司;番泻叶提取物:批号A3042221,由广东一方制药有限公司提供,番泻苷A(C43H38O20)和番泻苷B(C42H38O20)的含量为12.2 mg·g-1,使用前用胚胎培养液配制成8 mg·mL-1溶液。胚胎培养液:分别称取7.000 g NaCl、0.400 g NaHCO3、0.100 g KCl、0.235 g CaCl2用超纯水溶解,定容至2 L 容量瓶。使用真空过滤器(孔径0.2 μm)过滤后灭菌备用。实验用水均为双蒸水。6 孔、12 孔细胞培养板,康宁公司。
1.3 仪器与设备
BX43 正置荧光显微镜,OLYMPUS 公司;ZXGPA2160 恒温培养箱,上海智成分析仪器制造有限公司;爱生研究级斑马鱼养殖系统;MS1003S/01 电子分析天平,梅特勒托利多科技(中国)有限公司;5430/R 小型台式高速冷冻离心机,Eppendorf。
1.4 实验方法
1.4.1 复合益生菌在斑马鱼肠腔定植存活实验
根据前期实验确定复合益生菌对正常斑马鱼的无可见有害作用(No Observed Adverse Effect Level,NOAEL)浓度为3.45×108CFU·mL-1。在经前处理后的菌体中加入10 mL 含5 μg·mL-1CM-Dil 的1×PBS 溶液,37 ℃孵育20 min,孵育结束后离心收集菌体,并用0.01 mol·L-1PBS 清洗两遍,再次离心后加入10 mL 胚胎培养液振荡混合均匀,复合益生菌终浓度为3.45×108CFU·mL-1。
随机挑选发育正常的5 dpf 斑马鱼胚胎置于12 孔板中,每孔15 尾,每孔加入荧光标记后的益生菌菌液1 mL,28 ℃培养箱共同培养24 h,于共培养期间的2 h、6 h、18 h、24 h 进行拍照,分别随机选取10 尾斑马鱼,用正置荧光显微镜拍照,观察各时间段内复合益生菌于其肠腔内分布情况。共同培养结束后,用无菌的胚胎培养液将斑马鱼胚胎清洗3 次,转入到新的孔板中,每天更换胚胎培养液,培养48 dpf。于胚胎培养液培养的2 h、6 h、18 h、24 h 和48 h 进行荧光拍摄,观察移除复合益生菌培养后,斑马鱼肠腔内荧光情况。用ImageJ 图像处理软件进行荧光图像分析,计算斑马鱼肠腔内荧光强度。
1.4.2 对斑马鱼肠道蠕动的促进作用评价
本实验参考贾福怀等[11]实验方法,并加以修改。在经前处理后的菌体中加入10 mL 胚胎培养液振荡混合均匀,使复合益生菌浓度为3.45×108CFU·mL-1。随机挑选5 dpf 幼鱼,水溶给予尼罗红(终质量浓度为10 ng·mL-1)于28 ℃培养箱避光暴露4 h,使斑马鱼肠道完全充满尼罗红染料。尼罗红暴露结束,清洗染色后的斑马鱼3 次,将斑马鱼随机分配于六孔板中,每孔30 尾斑马鱼,给予前处理后的益生菌3.45×108CFU·mL-1,同时设置正常对照组,于28 ℃培养箱避光暴露12 h,期间不投饵。暴露12 h 后,每组随机选取10 尾斑马鱼,使用荧光显微镜进行观察和拍照,使用ImageJ 软件处理图像并计算肠道尼罗红荧光强度(S),以肠蠕动促进率评价样品对斑马鱼肠蠕动的促进作用。斑马鱼肠蠕动促进作用计算公式为
式中:S1为正常对照组平均值,Pixels;S2为复合益生菌实验组平均值,Pixels。
1.4.3 缓解斑马鱼非细菌性腹泻功效评价
本实验参考赵文嘉[12]实验方法,并加以修改。随机挑选5 dpf 幼鱼,分配于6 孔板中,每孔各30 尾,设置正常对照组、模型对照组、复合益生菌实验组。除正常对照组外,其余各组均给予番泻叶溶液8 mg·mL-1的方式建立斑马鱼非细菌性腹泻模型,于28 ℃培养箱避光处理10 h。造模结束后,清洗至少3 遍,复合益生菌实验组加入前处理后的益生菌3.45×108CFU·mL-1,模型对照组、正常对照组加入胚胎培养液,于28 ℃培养箱避光培养6 h。最后各实验组斑马鱼避光暴露于尼罗红水溶液中(终质量浓度10 ng·mL-1),于28 ℃培养箱避光培养3 h。孵育结束后清洗3 遍,每组随机选取10 尾斑马鱼,使用荧光显微镜进行观察和拍照,使用ImageJ 软件处理图像并计算肠道荧光强度(F),以腹泻缓解率评价样品改善非细菌性腹泻的功效,斑马鱼改善非细菌性腹泻的缓解作用计算公式为
式中:F1为复合益生菌实验组平均值,Pixels;F2为正常对照组平均值,Pixels;F为模型对照组平均值,Pixels。
1.4.4 数据统计分析
肠道蠕动促进评价及缓解腹泻功效评价实验结果采用均值±标准差表示,斑马鱼肠腔益生菌定植存活实验结果采用均值±标准误差表示。结果使用SPSS 26.0 软件进行统计和单因素方差分析,用Dunnett's-t检验进行统计,P<0.05 表示差异具有统计学意义。
2 结果与分析
2.1 复合益生菌在斑马鱼肠腔定植实验
大肠和小肠是益生菌发挥作用的消化部位,而益生菌能否最终发挥应有的功用,则需要它们在肠道存活一定时间[13]。如果益生菌不能黏附定植,就将成为过路菌,直接被排除出体外。如图1、图2 所示,斑马鱼与CM-Dil 红色荧光标记的复合益生菌共同培养2 h、6 h、18 h、24 h 后,其肠腔的荧光逐渐增强,2 h 时,复合益生菌已经进入斑马鱼肠腔。与2 h 对比,6 h 时充满肠腔,24 h时荧光强度达到最高。共同培养24 h后,肠道荧光强度均随时间的推移逐渐下降,且在24 h 仍有荧光信号。从实验结果可知,该复合益生菌可在肠腔定植,并可存活24 h 以上。

图1 不同时间段斑马鱼肠道中的复合益生菌荧光强度典型图

图2 不同时间段斑马鱼肠道中的复合益生菌荧光强度图
2.2 复合益生菌对斑马鱼肠道蠕动的促进作用
给斑马鱼喂食尼罗红一定时间后,斑马鱼肠道内会充满尼罗红,但肠道内的尼罗红不会被斑马鱼吸收。因此,在尼罗红荧光淬灭之前,通过斑马鱼肠道内尼罗红荧光信号的强弱可判定斑马鱼肠腔内蠕动状况[14]。尼罗红水溶液染色4 h 后斑马鱼肠腔内荧光情况见图3。使用ImageJ 图像处理软件计算斑马鱼肠腔内荧光强度,分析该复合益生菌对斑马鱼肠道蠕动促进作用,结果见表1。由表1 可知,与正常对照组相比,斑马鱼给予复合益生菌6 h后,斑马鱼肠腔内的荧光强度显著降低,肠道蠕动促进率为28.68%(P<0.05),表明该益生菌复合制剂对斑马鱼肠蠕动有一定的促进作用。

表1 斑马鱼肠腔荧光强度以及复合益生菌对斑马鱼肠道蠕动促进率结果表

图3 复合益生菌对斑马鱼肠道蠕动促进作用典型图
2.3 复合益生菌缓解斑马鱼非细菌性腹泻
番泻叶有效成分主要为番泻苷A、B,经消化系统吸收分解后,分解产物蒽醌会刺激骨盆神经节以收缩大肠,引起腹泻[15]。复合益生菌对番泻叶提取物诱导斑马鱼非细菌性腹泻结果见图4。使用ImageJ 图像处理软件计算斑马鱼肠腔内荧光强度,分析该款复合益生菌缓解非细菌性腹泻效果,结果见表2。由表2可知,与模型对照组相比,正常对照组肠腔内荧光强度极极显著增加(P<0.001)。斑马鱼肠道内容物减少,出现类似腹泻症状。斑马鱼给予复合益生菌6 h 后,相比于模型对照组,斑马鱼肠腔内的荧光强度显著增加,腹泻缓解率为30.25%(P<0.05),表明该益生菌复合制剂对斑马鱼非细菌性腹泻具有一定的缓解作用。

表2 斑马鱼肠腔荧光强度以及复合益生菌对斑马鱼缓解非细菌性腹泻效果结果表
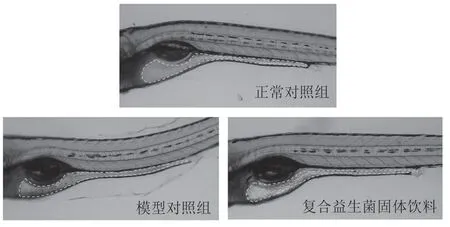
图4 该复合益生菌对斑马鱼非细菌性腹泻缓解作用典型图
3 讨论
3.1 益生菌的肠道定植能力
目前的研究表明,益生菌具有改善肠道微生态平衡、增强机体免疫、调节肠道动力、促进营养物质吸收等多种功效,主要通过4 种机制发挥作用:抑制病原菌、增强肠道上皮屏障功能、调节宿主免疫功能以及参与肠-脑轴调节[16]。在机体中益生菌主要存在于胃、小肠和大肠中[17]。因此,能够在肠道定植是益生菌发挥作用的关键。口服是一种常见的益生菌摄入方式,但由于胃肠道环境特殊,大多数定植能力差的益生菌无法在肠道内长时间存活,在食用后不久便会排出体外,导致无法发挥出应有的益生作用[18]。
在有关益生菌肠道定植能力的研究中,CHEN等[16]通过给予斑马鱼乳双歧杆菌,发现在6 h 时益生菌可充满斑马鱼肠腔,且可存活24 h 以上。郭亚娟等[19]通过给予斑马鱼复合益生菌,发现4 h 时斑马鱼肠腔已布满益生菌,并可以在肠腔中稳定存活。在本研究中,在斑马鱼与益生菌共同培养期间,随着培养时间的增加,斑马鱼肠道中检测出的荧光信号强度逐渐增强,在6 h 时复合益生菌布满肠道,24 h 时肠道内总荧光强度达到最高12 781.90±725.91;在无益生菌培养期间,48 h 时仍可在斑马肠道内检测到荧光信号,表明该款益生菌复合制剂中添加的益生菌具有较好的肠道定植能力。
3.2 益生菌的促肠道蠕动作用
随着饮食的变化和持续的社会以及心理压力,IBS 的患病人数也在逐年上升,通常患者有着不同程度的便秘症状[20]。在以往的研究中,一般使用营养疗法进行治疗,但大多数治疗只能短期改善,使用益生菌等微生物制剂治疗功能性肠胃病正逐渐被人们所接受,大量研究表明肠道菌群对人体的健康至关重要[21]。有研究证实,益生菌产生的短链脂肪酸和多肽等具有调节胃肠动力促进肠道蠕动作用。益生菌也可以促进5-羟色胺分泌,来调控肠神经反射,作用于迷走神经,调节胃肠的收缩功能[22]。
已有多项研究表明了益生菌及其组合物的促肠道蠕动作用,陈家伦等[23]研究中通过对小鼠给予益生菌组合物,发现低、高剂量均可促进小鼠小肠推进率,显著降低首粒黑便时间。程光丽等[24]的研究中,志愿者在连续3 个月服用益生菌产品后,食物在肠道内停留时间显著性减少,肠动次数及肠道收缩力显著增加。在本研究中,斑马鱼给予复合益生菌6 h 后,肠腔内的尼罗红荧光强度下降(P<0.05),肠道内容物减少,肠道蠕动促进率为28.68%,表明该款益生菌复合制剂具有促进肠胃蠕动的作用。
3.3 益生菌的缓解腹泻作用
腹泻主要症状为排便量增加,患腹泻的原因有多种[5]。此外,肠道微生态系统紊乱会使炎症因子增加,引起肠道免疫系统障碍,最终导致肠道黏膜、组织受损[25-26]。已有研究证明,益生菌可以实现在小肠黏膜上皮细胞上定植以促进β-防御素的产生,进一步提高肠上皮细胞的自我保护及修复受损;此外,益生菌的代谢活动会合成具有抗炎、抗氧化、调节免疫的有益代谢物,使病原菌的生长繁殖受到抑制[27-29]。
在一些研究中,通过益生菌干预能够达到缓解或治疗腹泻症状。汪家琦等[30]利用添加抗生素建立小鼠腹泻模型,并通过复合益生菌灌胃进行治疗,结果表明益生菌治疗具有修复隐窝、保护肠粘膜、减轻腹泻的功效。在王慕华等[31]的研究中腹泻患者在益生菌干预后大便次数从原来的4.8 次/日恢复到了1 次/日,并能够减轻腹泻引起的腹痛等症状。在本研究中,使用番泻叶构建斑马鱼腹泻模型,给予该款复合益生菌进行干预,结果发现斑马鱼肠道尼罗红荧光信号强度显著高于模型组,表明该款益生菌复合制剂具有缓解腹泻的作用。
4 结论
该款益生菌复合制剂经本实验研究,具有良好的肠道定植能力,在斑马鱼肠腔存活时间较长。在健康斑马鱼上可有效促进肠道蠕动,具有润肠通便的功效;在斑马鱼非细菌性腹泻模型上,可有效缓解腹泻症状,减少过度排泄。综合上述,该款益生菌复合制剂能增强健康肠道蠕动功能,减轻肠道受到刺激而导致的过度收缩排泄,维持肠道动力平衡,具有双向调节肠道动力作用,可能对营养吸收、免疫调节、消化等肠道生理功能有着潜在的积极影响,具体机制需进一步研究。

