影像学在克罗恩病并发肠腔狭窄诊断及随访中的价值
庄 楠,李文波,朱庆莉
中国医学科学院 北京协和医学院 北京协和医院超声医学科,北京 100730
克罗恩病(Crohn’s disease,CD)是一类慢性复发性炎症性肠病,肠腔狭窄是其常见的并发症之一。肠腔狭窄可累及消化道各个节段,最常见的部位为末段回肠和回盲瓣,由于CD所导致的透壁性炎症,其纤维化可累及肠壁全层,导致肠壁增厚/硬化、肠腔狭窄甚至梗阻[1]。一项基于人群的队列研究显示[2],超过5%的患者最初为狭窄性表型,15%的患者10年内发展为肠腔狭窄。
按照病因,CD合并肠腔狭窄可分为原发狭窄和术后吻合口处狭窄;按照病理类型,可分为炎症型、纤维型及混合型。炎症型狭窄是肠壁充血水肿、淋巴增生等所导致的,纤维型狭窄则是长期慢性炎症刺激所导致的肠壁纤维组织沉积和瘢痕形成[3]。以炎症型狭窄为主的CD患者可通过药物保守治疗,激素类药物和抗肿瘤坏死因子抑制剂能够缓解炎症型狭窄所导致的梗阻症状[4]。药物治疗仅能延迟患者接受手术的时间,80%以上的患者在首诊CD 10年内接受第一次肠切除术[5]。针对纤维型狭窄为主的患者,目前尚无有效的药物治疗手段,必须采用内镜下球囊扩张术(endoscopic balloon dilation,EBD)、狭窄成形术(strictureplasty)或节段性肠管切除术等外科手段治疗[6]。但手术治疗并非没有风险,手术后原部位再次手术的概率为10%[7],4%的狭窄成形术后可能会导致吻合口漏、脓肿形成等并发症[7],多次手术可导致短肠综合征,严重影响患者的消化功能。故准确鉴别CD并发肠腔狭窄的病变性质,选择恰当的治疗手段,对患者的预后及生存质量至关重要。
在CD并发肠腔狭窄的评估中,必须明确狭窄肠段的数目、部位、程度等特征,尽可能区分炎症型狭窄与纤维型狭窄,为临床进一步诊疗提供参考,同时评价药物疗效、监测术后情况,这是影像学诊断的重点。目前的影像学评估方法包括腔内评估和计算机断层扫描评估,如内镜、CT、MRI、超声等。本文总结针对CD并发肠腔狭窄的各项影像学技术,讨论其优点和局限性,旨在为临床提供参考。
1 内镜
内镜是CD诊断的常规首选检查项目,可在腔内直观地观察消化道情况,并通过内镜在肠腔内走行是否通畅等判断狭窄的部位、节段及程度(图1)。第三届欧洲炎症性肠病共识已推荐其用于评价结肠和末段回肠肠腔狭窄[8]。CD内镜严重指数评分[9](Crohn’s disease endoscopic index of severity,CDEIS)和CD简化内镜评分[10](simple endoscopic score for Crohn’s disease,SES-CD)亦将肠腔狭窄列入CD活动指数评价指标中。同时,内镜可留取狭窄部位肠段进行病理学评估,明确病变性质。3.5%的肠腔狭窄合并发育不良或癌变[8]。
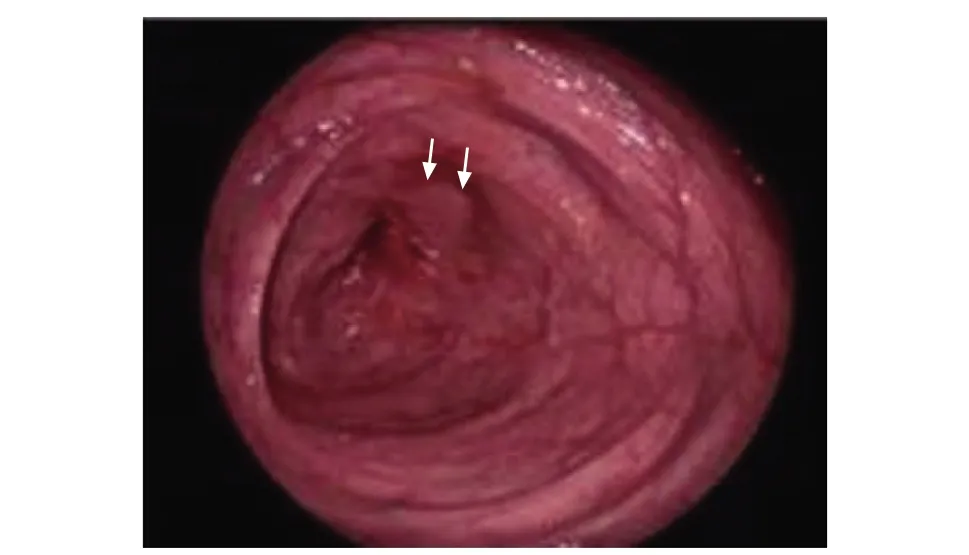
图 1 1例女性患者,42岁,右半结肠切除术后,诊断为克罗恩病,肠镜显示吻合口处狭窄(箭头)
CD合并肠腔狭窄的内镜下治疗手段日趋成熟,EBD目前已成为一项常用的非手术性治疗方法,适用于短节段(≤4 cm)、内镜可通过的狭窄性病变[11]。其并发症少,安全性高,穿孔的发生率仅为3%[12]。17%~82%的CD并发狭窄患者可通过EBD使病情长期缓解[13],接受EBD的患者在1、3、5年内累计避免外科手术率分别为80%、57%和52%[12]。长节段、黏膜面炎症严重的狭窄性病变是EBD治疗失败的主要原因[14]。狭窄成形术被视为一类肠管切除术的替代方法,虽然肠管切除术能够解除肠腔狭窄,但切除过长节段肠管将降低吸收功能,造成短肠综合征,影响患者的营养情况,甚至缩短预期寿命。狭窄成形术的指征为较长节段的肠管内存在多处肠腔狭窄,尤其适用于肠段受累超过100 cm且患短肠综合征的患者[15]。Yamamoto等[16]汇总了1112例行狭窄成形术CD患者的临床结局,术后5年复发率为28%,其中90%发生于非手术部位。狭窄成形术对减轻CD合并狭窄患者症状、降低手术几率具有重大价值。内镜下针刀狭窄切开术(needle-knife stricturotomy)[17]和内镜下金属支架植入术[18]是一类针对纤维型狭窄或球囊扩张失败的难治性狭窄的新型治疗手段,能够进一步减少内镜下出血、穿孔等创伤。
但内镜对于多节段、肠壁深部病变的取材较为困难,难以进行全面评估;且内镜为侵入性检查,患者接纳度低,腔内检查仅能提供黏膜信息,对于明显梗阻、内镜不能通过的肠段,则无法确切评价肠腔狭窄情况。
2 计算机断层扫描肠道成像
计算机断层扫描肠道成像(computed tomography enterography, CTE)是目前整体评估CD的重要非侵入性影像学手段之一,诊断肠腔狭窄的灵敏度为85%~93%,特异度为100%[5]。CTE对单个狭窄的诊断准确度可达100%,对狭窄数目的诊断准确度为83%[5](图2)。
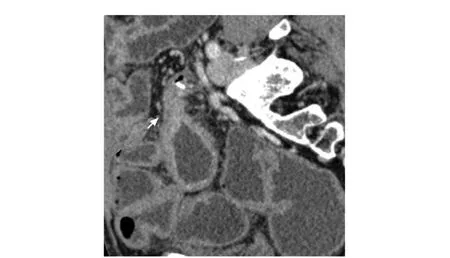
图 2 1例男性患者,52岁,结肠次全切除术后,计算机断层扫描肠道成像显示吻合口处肠腔狭窄(箭头)
以组织病理学为参考,CTE图像中肠壁增厚伴异常强化、肠系膜血管增生等征象与CD高度炎性狭窄密切相关[19]。Chiorean等[20]纳入44例CD伴肠腔狭窄患者,构建了CTE标准化评分系统,将CTE评分与47处手术切除病变肠段的病理结果进行分析,结果表明CTE对炎性病变和狭窄性病变的诊断准确度分别为76.6%和78.7%。CTE对于肠壁炎性和纤维化病变的诊断价值仍有待进一步前瞻性研究加以证实。虽然CTE是一类临床上广泛采用的非侵入性CD检查手段,但CTE需要肠道准备,对已存在梗阻的患者并不适用;同时其辐射暴露等问题在患者长期随访及重复评估中应予以重视。
3 MRI
MRI在CD的诊断及评估中发挥了重要作用,磁共振肠造影(magnetic resonance enterography,MRE)能够准确评价CD并发肠腔狭窄,明确狭窄性病变的数目、部位和程度,检测肠腔狭窄诊断准确度为90%,灵敏度为75%~100%,特异度为90.9%~95.7%[21-22]。目前,MRI已用于药物疗效评价的随访中。一项研究表明,肠腔狭窄长度小于12 cm,近端肠腔最大直径为18~29 mm,MRE延迟相显著增强,无瘘管存在等因素可作为阿达木单克隆抗体治疗CD肠腔狭窄成功的预测因子[23]。
在评估肠壁病变性质方面,多项MRI新技术在肠壁纤维化定性和定量测量中取得了突破。MRI扩散加权成像(diffuse weighted imaging,DWI)是利用水分子通过不同密度的组织以提供图像对比度(若炎症组织密度高、扩散受限,呈现为明亮的图像),一项Meta分析总结了DWI评价CD肠壁炎症程度的灵敏度为92.9%,特异度为91.0%[24]。动态对比增强MRE在延迟相测量的增强参数,纤维化肠壁的造影剂滞留时间更长,从而区分肠壁的炎症与纤维化[25]。磁化传递成像(magnetization transfer imaging,MTI)对狭窄肠腔组织中的胶原含量变化十分敏感,能够准确区分纤维化和非纤维化的肠壁组织。动物实验表明,晚期肠壁纤维化的大鼠磁化传递比值(magnetization transfer ratio,MTR)明显高于非纤维化大鼠[26]。Li等[27]的研究表明,MTR与肠壁纤维化密切相关,并且能够区分中-重度纤维化和无-轻度纤维化。然而,由于MRI费用昂贵、检查时间长、需严格肠道准备,且患者耐受性低,故其在临床尚未得到广泛应用。

图 3 1例男性患者,45岁,诊断克罗恩病,经腹超声显示第5组小肠局部肠腔狭窄,近端肠腔扩张(箭头)
4 经腹超声
经腹超声(transabdominal ultrasound, TAUS)近年来已被广泛应用于CD的诊断和随访中,在并发症检测方面具有较高的灵敏度和特异度(图3)。根据既往文献报道,常规TAUS诊断CD合并肠腔狭窄的灵敏度可达100%,特异度为63%[28-29]。以手术病理为金标准,Pallotta等[30]发现肠道超声造影检查对CD患者单发狭窄诊断的灵敏度为97.5%,特异度为100%,对多发狭窄的诊断灵敏度为75%,特异度为100%。TAUS对肠腔狭窄的诊断灵敏度和特异度均较高,且无辐射、检查简便,适用于CD并发症的随访及药物疗效监测。
值得一提的是,在明确肠腔狭窄的纤维化程度方面,超声新技术取得了长足进展。肠道超声造影具有区分CD炎症型和纤维型狭窄的潜能,研究表明,超声造影显示的肠壁彩色多普勒血管化程度与纤维狭窄程度呈显著负相关[31],超声造影表现与肠壁炎症型(Spearman’s,r=0.53)、纤维型狭窄(Spearman’s,r=0.50)的病理评分显著相关[32]。剪切波超声弹性成像(shear wave elastography, SWE)是通过脉冲刺激,在体内产生剪切波,测量传播速度从而得到的组织弹性值。Chen等[33]通过对CD合并肠腔狭窄的肠切除标本进行SWE检查,结果显示以22.55 kPa为临界值,区分轻/中度与重度肠壁纤维化的灵敏度为87.5%,特异度为57.9%。Dillman等[34]动物实验表明,纤维化肠壁相对于急性炎症期肠壁,其剪切波速度(shear wave velocity,SWV)显著增高,测量SWV能够区分肠壁炎症型病变和纤维型病变。综上,肠道超声造影和SWE能够明确CD合并肠腔狭窄的肠壁病变性质,具有良好的临床应用前景。
5 正电子发射断层显像/计算机体层成像
18F-氟脱氧葡萄糖(fludeoxyglucose,FDG)正电子发射断层显像/计算机体层成像(positron emission tomography/computed tomagraphy,PET/CT)主要用于评价组织功能及代谢情况,近年来越来越多地应用到了炎症性肠病的评估中。Louis等[35]发现,对于内镜下的严重病变,包括深溃疡和狭窄等,PET/CT的检出率为100%(14/14)。
18F-FDG PET/CT对重度炎症性病变的检出率为87%,但对浅表的轻度炎症、溃疡性病变,诊断准确度仅为7%[36-37]。Jacene等[38]纳入了17例具有明确梗阻症状的CD患者,其中13例接受了手术,术前利用18F-FDG PET/CT检测患者肠壁内的FDG摄取情况,将检查结果与术后病理标本进行比较,发现FDG不仅沉积于急性炎症的肠壁中,在严重纤维化、肠肌肥大的肠壁中也有积累,提示18F-FDG PET/CT可能无法进一步鉴别肠腔狭窄是炎症型或是纤维型。然而,在其他研究中,以内镜联合组织学检查为金标准,纳入37处肠腔狭窄病变,利用18F-FDG PET/CT联合MRI、TAUS等其他影像学手段,能够100%发现有临床症状并需要干预的CD狭窄性病变[39]。因此,18F-FDG PET/CT鉴别炎症型和纤维型狭窄的能力有待于进一步研究证实。
6 小结
影像学评估可明确CD狭窄肠段的数目、部位、形态以及程度,对该病的诊断及治疗起到了重要作用,虽然内镜是最常用的评价手段,但对于CD这类跨壁性炎症性肠病来说,不能仅局限于腔内评估,还需要结合断层影像学手段及连续性检查手段综合评估,如CT、MRI和TAUS等。在评价肠壁炎症及纤维化程度方面,超声、MRI等新技术有着良好的发展前景,并逐渐得到认可,有望在临床上广泛应用。目前尚无指南提出诊断及鉴别CD伴肠腔狭窄性质的标准方法,各项影像学手段各有其优势和局限性(表1),对于CD合并肠腔狭窄的早期筛查、治疗评价及预后评估仍不完善,对于肠壁纤维化诊断标准尚不统一[40],期待更为深入的临床研究。

表 1 不同影像学方法诊断CD合并肠腔狭窄的优势和局限性
作者贡献:庄楠负责文献查询、整理及文章撰写;李文波、朱庆莉负责文章审阅和修改。
利益冲突:无

