他莫昔芬治疗包裹性腹膜硬化症的研究进展
康达贤 孙丽萍 张欣洲
【摘要】 包裹性腹膜硬化症(EPS)是长期腹膜透析患者的一种少见且严重的并发症,主要见于长期腹膜透析和有反复、严重腹膜透析相关性腹膜炎(PDAP)病史者。EPS早期诊断困难,预后差、病死率高,其发病机制仍未完全清楚,目前缺乏理想的预防和治疗方案。他莫昔芬是一种选择性雌激素受体调节剂,目前可应用于治疗乳腺癌、卵巢癌及某些以纤维化病变为特征的疾病。有研究表明他莫昔芬也可用于治疗EPS。该文对EPS及他莫昔芬治疗EPS的相关研究进展进行了系统综述。
【关键词】 他莫昔芬;包裹性腹膜硬化症;选择性雌激素受体调节剂;腹膜透析;治疗
Research progress in tamoxifen in treatment of encapsulating peritoneal sclerosis Kang Daxian, Sun Liping, Zhang Xinzhou. The Second Clinical Medical College,Jinan University,Shenzhen 518020, China
Corresponding author, Zhang Xinzhou, E-mail: xinzhouzhang1946@163.com
【Abstract】 Encapsulating peritoneal sclerosis (EPS) is a rare and serious complication in patients with long-term peritoneal dialysis and a history of recurrent and severe peritoneal dialysis-associated peritonitis (PDAP). Early diagnosis of EPS is difficult, clinical prognosis is poor, and the fatality rate is high. The pathogenesis of EPS is still not fully understood, and ideal prevention and treatment regimens are still lacking. Tamoxifen, a selective estrogen receptor modulator, is currently used in the treatment of breast cancer, ovarian cancer and some diseases characterized by fibrotic lesions. Studies have shown that tamoxifen can also be used to treat EPS. In this article, research progress in EPS and tamoxifen in the treatment of EPS was systematically reviewed.
【Key words】 Tamoxifen; Encapsulating peritoneal sclerosis; Selective estrogen receptor modulators; Peritoneal dialysis; Therapy
腹膜透析是终末期肾病(ESRD)患者肾脏替代治疗的主要方法之一,因其具有延缓残肾功能丢失、血流动力学较稳定、操作简便、提高生活质量等优点,日益为ESRD患者所接受及选择。目前在全球范围内至少有 10万名ESRD患者选择腹膜透析,占透析总人数的10%~15%[1]。腹膜透析相关性腹膜炎(PDAP)是腹膜透析常见的并发症,是患者腹膜透析失败或死亡的重要原因[2]。国外腹膜透析中心报道腹膜炎发生率为0.06~1.66次/患者年[3-4]。我国大型腹膜透析中心报道PDAP为0.14~0.17次/患者年[5-7]。随着腹膜透析导管相关技术的提高,腹膜炎发生率已大幅下降,但仍然是制约腹膜透析发展的主要原因[8]。根据国际腹膜透析学会的定义,包裹性腹膜硬化症(EPS)是一种由弥漫性增厚腹膜粘连引起的连续、间歇性或反复出现肠梗阻症状的综合征[9]。EPS早期诊断困难且病死率高,近71%EPS病例于停止腹膜透析后诊断,故有部分EPS病例在数據中未能达到完全统计[10]。他莫昔芬作为一种选择性雌激素受体调节剂,在我国主要用于治疗乳腺癌术后或复发的患者,研究表明他莫昔芬也可用于治疗EPS,改善EPS患者的预后。本文将从EPS的相关研究及他莫昔芬治疗EPS的相关研究进展展开论述。
一、包裹性腹膜硬化症
1. 流行病学
据多个腹膜透析中心统计,EPS的发病率较低,约为0.4%~8.9%,但其全因死亡率高,为 25.8%~56.5%[11-12]。Lambie等[13]报道,澳大利亚、新西兰和苏格兰17 396例腹膜透析患者中EPS的患病率为0.57%。我国台湾地区3个腹膜透析中心收集的1982—2015年3 202 例腹膜透析患者中,EPS患病率为1.8%,全因死亡率为35%,且发病率及病死率均随腹膜透析时间延长而升高[14]。我国广州地区一项关于腹膜透析患者10年生存率的前瞻性观察队列研究表明,在随访的553例腹膜透析患者中,有1.3%的患者发生EPS[15]。该中心另一项单中心回顾性病例对照研究显示,所纳入的1997—2018年2 930例持续性腹膜透析患者中,有16例(0.55%)EPS患者,最终死亡的EPS患者6例(37.5%)[16]。由此可见EPS发病率较低,我国对EPS的相关研究有限,仍需要更多相关的临床研究进行统计分析总结。早期及正确认识并诊断、治疗EPS对于腹膜透析患者的预后改善至关重要。
2. 发病机制及危险因素
EPS发病机制目前仍未完全清楚,其中较为公认的可能机制是“双重打击”学说[11-12, 17]。在腹膜透析所致的腹膜损伤中,腹膜透析导管和腹膜透析溶液作为外源性因素,长期使用可诱导腹膜间皮细胞出现慢性应激,致腹膜间皮细胞发生转化,随后与沉积的纤维蛋白共同使间质纤维化,同时间质形成新生血管,在两者影响下腹膜出现以胶原沉积、血管生成、间皮下纤维化及钙化和炎症细胞浸润为特征的上皮-间质转变,此为第一重打击。在其他各种非腹膜透析因素如尿毒症毒素、药物、各种生物刺激因素等(尤其是细菌性腹膜炎)刺激下,间质新生血管管壁逐渐增厚,随后出现血管腔狭窄及闭塞,逐渐加重血管内皮损伤,导致腹膜高渗状态。在此基础上,部分葡萄糖、肌酐、尿素等物质从腹腔迅速转移至腹膜血管,从而使血管、腹腔及腹膜透析液三者之间渗透梯度失衡,进一步增加了腹膜的通透性,促使大量纤维蛋白的沉积,随后聚集出现纤维蛋白膜,在腹腔内不平衡的凝血/纤溶系统下覆盖肠道,随着时间的推移逐渐形成完整的包膜包裹肠道,引起肠道的运动及吸收功能障碍,此为第二重打击。
关于EPS的危险因素,目前有多项研究证实腹膜透析病程是EPS的独立危险因素[16, 18-21]。长期腹膜透析可影响腹膜功能,增加腹膜炎发作次数,同时增加了腹膜高转运状态、超滤失败持续时间延长等风险,进一步影响EPS的发生、发展。有研究显示,腹膜透析病程与EPS相关[20]。另有研究者使用多变量模型分析,发现较高的腹膜转运状态与EPS独立相关。因此在长期腹膜透析患者中,评估腹膜功能、及时停止腹膜透析可能是预防EPS的有效措施。另有研究表明,腹膜透析开始年龄、肾移植病史、腹膜炎病史、腹膜透析液类型等因素均为EPS的危险因素[18-21]。这些研究为临床上预防腹膜透析EPS的发生、改善EPS患者的预后提供了参考。
3. 临床表现及诊断
EPS主要表现为腹痛、腹胀、呕吐等肠梗阻综合征的相关症状,同时大多数患者会有明显营养不良的表现[9]。然而,部分导致肠道动力紊乱的疾病也有可能出现与EPS相似的临床症状,因此仅通过临床症状判断EPS较困难,目前诊断EPS的金标准仍为病理诊断。但基于取材困难等现实因素,现在大多数EPS患者主要根据临床表现以及辅助检查结果明确诊断。
影像学检查有助于区分EPS与其他原因的肠梗阻[22]。腹部X线平片及超声检查可显示腹膜增厚和小肠异常,但尚无明确的资料证明其特异度及灵敏度[23]。目前CT或增强CT是识别腹膜及小肠异常和包裹性腹腔钙化的最佳检查方式,常用于诊断EPS。EPS在CT中可表现为腹膜增厚、钙化,甚至可显示肠近端包裹呈茧状。Vlijm等[24]的病例对照研究显示,EPS患者在有相应病史及症状时,结合CT表现诊断EPS的灵敏度达100%,当6个参数(腹膜增强、腹膜增厚、腹膜钙化、肠栓系、肠扩张和液体腔室/分离)中存在3个(如果没有静脉注射造影剂,5个参数中存在2个)时,诊断EPS的灵敏度为100%,特异度为94%。
在腹膜透析液中寻找可靠的生物标志物或许可提示EPS的发生或发展。有学者提出,如果怀疑EPS,可检测腹膜透析液或腹水中CRP等炎症因子的水平协助诊断,但在临床应用中发现,这些指标无法于早期提示EPS[11]。有研究表明,基质金属蛋白酶-2(MMP-2)可能可以作为EPS的诊断及治疗的新靶点[25]。该研究中,MMP-2水平和腹膜透析持续时间与EPS风险独立相关,基于MMP-2水平和腹膜透析持续时间的列线图可高度预测EPS。目前仍缺少更多的临床数据来支持这些标志物的特异度和灵敏度,随着生物工程等技术的发展,也许未来可以找到更有意义的生物标志物来指导EPS的诊断及治疗。
二、他莫昔芬在EPS中的作用
他莫昔芬是一种选择性雌激素受体调节剂(SERM),其结构与雌激素相似,存在Z型和E型两个异构体,其中Z型异构体发挥抗雌激素作用[26]。Z型异构体进入细胞内后,可与雌激素受体竞争结合,形成受体复合物,从而阻止雌激素作用的发挥。在乳腺癌中,他莫昔芬可阻断乳腺癌细胞中雌二醇诱导的血管内皮生长因子(VEGF)产生。有研究表明,他莫昔芬对卵巢癌及某些以纤维化病变为特征的疾病(如纤维性纵隔炎、腹膜后纤维化等)具有一定的疗效,同时有研究表明他莫昔芬可治疗EPS,以下将从他莫昔芬治疗EPS的机制、相关进展展开论述。
1.他莫昔芬治疗EPS的机制
目前已有动物模型研究表明,他莫昔芬可通过抑制腹膜增厚、抑制新生血管形成、降低透出液VEGF水平等方面保护腹膜功能。Loureiro等[27]发现,在小鼠模型中,他莫昔芬可阻断间皮-间充质转化,通过恢复腹膜间皮细胞的间充质表型,以及保留腹膜间皮细胞的纤溶特性,从而改善透析液暴露导致的腹膜改变。Huang等[28]发现,他莫昔芬减少小鼠间皮下区内脏腹膜的厚度,而在人腹膜间皮细胞(HPMC)的体外模型中,他莫昔芬在抑制HPMC产生的Ⅰ型膠原蛋白的同时,刺激转化生长因子-β(TGF-β),从而减轻炎症细胞黏附,保护内皮和血管平滑肌细胞。Yan等[29]在小鼠模型中发现,他莫昔芬可通过抑制腹膜上皮细胞-间充质转化进程,减弱高糖透析液诱导的腹膜纤维化,同时也使小鼠腹膜内间皮下新生血管的数量明显减少,VEGF水平下降。Silva等[30]发现,他莫昔芬抑制大鼠腹膜纤维化,诱导Smad7的上调,而Smad7是TGF-β/Smad信号通路的细胞内抑制剂,有助于纤维化前基因的负调控;经TGF-β激活的原发性腹膜成纤维细胞体外实验也证实,他莫昔芬可部分阻断炎症介质。上述研究从细胞、动物等各层面发掘了他莫昔芬治疗EPS的作用机制,从理论上验证了他莫昔芬治疗EPS的可行性。
2.他莫昔芬治疗EPS的研究进展
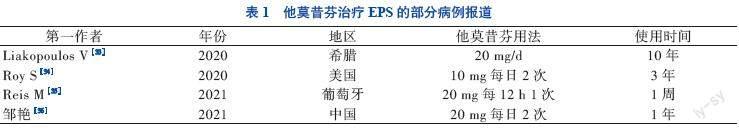
已有许多个案报道及小型透析中心提供的数据表明,他莫昔芬用于治疗EPS有效。来自智利的单一腹膜透析中心对12例EPS患者展开为期2年的随访,发现对炎症期EPS患者使用他莫昔芬合并糖皮质激素联合治疗效果明显,但该研究并没有与未使用他莫昔芬治疗或单独使用他莫昔芬治疗的患者进行对比[31]。荷兰一项多中心回顾性研究对63例严重EPS患者的数据进行分析发现,接受他莫昔芬治疗者的病死率明显低于未接受他莫昔芬治疗者[32]。但也有部分研究表明,他莫昔芬并没有明显改善EPS患者生存率,这可能与EPS患者疾病阶段不同、药物作用所掩盖有关。此外部分个案报道(表1),小剂量他莫昔芬联合糖皮质激素或免疫抑制剂治疗能明显缓解EPS患者症状,且均未出现不良反应。
3. 他莫昔芬与其他EPS治疗方案的对比
由于EPS的发病率较低,目前相关治疗方案仅见于病例报道及单中心数据,很少有随机对照研究进行治疗方案的对比。当前最常被各中心选择治疗EPS的药物是糖皮质激素。糖皮质激素已被证明在EPS出现的早期阶段可通过减少炎症、纤维蛋白沉积和肠壁水肿取得部分治疗效果,但当纤维蛋白渗出过多时,糖皮质激素则无法阻止腹膜硬化的发展[7, 17]。一项来自西班牙的单中心研究表明,对比接受药物治疗(包括糖皮质激素治疗)和未接受药物治疗的EPS患者,组间生存率比较差异并无统计学意义,但亚组分析显示,与类固醇+免疫抑制剂组相比,接受他莫昔芬+类固醇+免疫抑制剂组的中位生存率有所提高[37]。另外有部分病例報道表明,使用免疫抑制剂(如硫唑嘌呤、环孢素等)可能使部分EPS患者获益,但存在明显的个体差异,同时部分病例报道表明腹膜透析患者在结束腹膜透析、接受肾移植及后续抗排斥治疗后仍可出现EPS,这也使免疫抑制剂治疗EPS的有效性存在疑问[10, 17]。
如EPS患者出现完全性肠梗阻、肠梗阻等严重并发症,可以选择外科手术治疗,但接受手术的患者大多死于手术并发症[9]。同时,部分患者因基础营养情况较差,容易出现术后反复感染,从而出现EPS复发[10]。因此手术治疗需评估患者的全身状态,谨慎选择手术时机。这对于部分患者而言,选择药物治疗的安全性相对较高,而他莫昔芬通过阻断腹膜上皮-间充质转化进程,在EPS早期阻止病情的进一步发展,在EPS发展后期减少炎症介质、保护腹膜功能,达到抗纤维化的效果,从而改善患者的预后,同时其较少的不良反应(相对于手术),均体现其优势所在。
三、小结及展望
EPS是长期腹膜透析患者一种严重的潜在并发症,其发生的风险已被证明在不同的中心、国家之间存在差异,但病死率仍然较高。大多数研究认为,腹膜透析持续时间的增加是EPS发生的关键风险因素,因此定期评估腹膜功能,及时发现高腹膜转运状态或许是预防EPS的一种有效手段。通过临床症状及辅助检查可能早期诊断EPS。他莫昔芬作为选择性雌激素受体调节剂,已被证实可以用于治疗以纤维化病变为特征的疾病。动物模型、体外模型及临床案例均表明他莫昔芬可以用于治疗EPS。但EPS的患者数量较少,且部分患者症状不典型,早期诊断困难,能早期识别并且成功进行他莫昔芬治疗的患者更少,目前仍然缺乏多中心研究以及病例对照研究来证实他莫昔芬的有效性。未来需要进一步提高对EPS这一疾病的认识水平,早期诊断并干预,及时启动他莫昔芬治疗,可能是降低EPS病死率的关键所在。
参 考 文 献
[1] Zimmerman A M. Peritoneal dialysis: increasing global utilization as an option for renal replacement therapy[J]. J Glob Health, 2019, 9(2): 020316.
[2] 卢东丽, 刘同换, 王立新, 等. 利用mNGS成功诊治多形拟杆菌致难治性腹膜透析腹膜炎一例[J]. 新医学, 2022, 53(6): 453-456.
Lu D L, Liu T H, Wang L X, et al. Successful diagnosis and treatment of refractory peritonitis caused by Bacteroides thetaiotaomicron by high-throughput sequencing: a case report[J]. J New Med, 2022, 53(6): 453-456.
[3] Piraino B, Bernardini J, Brown E, et al. ISPD position statement on reducing the risks of peritoneal dialysis-related infections[J]. Perit Dial Int, 2011, 31(6): 614-630.
[4] 唐杏明, 郑玮, 胡洁萍, 等. 透出液免疫球蛋白G与腹膜透析相关性腹膜炎的关系[J]. 中山大学学报(医学科学版), 2021, 42(5): 796-800.
Tang X M, Zheng W, Hu J P, et al. Relationship between dialysate IgG and peritoneal dialysis associated peritonitis[J]. J Sun Yat Sen Univ Med Sci, 2021, 42(5): 796-800.
[5] Dong J, Zhao M H. Clinical research in a modern Chinese peritoneal dialysis center[J]. Perit Dial Int, 2014, 34(Suppl
2): S49-S54.
[6] Feng X, Yang X, Yi C, et al. Escherichia coli Peritonitis in peritoneal dialysis: the prevalence, antibiotic resistance and clinical outcomes in a South China dialysis center[J]. Perit Dial Int, 2014, 34(3): 308-316.
[7] Yu X, Yang X. Peritoneal dialysis in China: meeting the challenge of chronic kidney failure[J]. Am J Kidney Dis, 2015, 65(1): 147-151.
[8] 中國腹膜透析相关感染防治专家组. 腹膜透析相关感染的防治指南[J]. 中华肾脏病杂志,2018,34(2):139-148.
Chinese Expert Group on the Prevention and Treatment of Peritoneal Dialysis Related Infections. Guidelines for the prevention and treatment of peritoneal dialysis related infections [J]. Chin J Kidney Dis, 2018,34 (2): 139-148
[9] Brown E A, Bargman J, van Biesen W, et al. Length of time on peritoneal dialysis and encapsulating peritoneal sclerosis - position paper for ISPD: 2017 update[J]. Perit Dial Int, 2017, 37(4): 362-374.
[10] Pepereke S, Shah A D, Brown E A. Encapsulating peritoneal sclerosis: your questions answered[J]. Perit Dial Int, 2023, 43(2): 119-127.
[11] Kawanishi H, Shintaku S, Banshodani M, et al. Past and present perspectives on encapsulating peritoneal sclerosis[J]. Contrib Nephrol, 2015, 185: 87-97.
[12] Hamada C, Tomino Y. Recent understanding of peritoneal pathology in peritoneal dialysis patients in Japan[J]. Blood Purif, 2021, 50(6): 719-728.
[13] Lambie M, Teece L, Johnson D W, et al. Estimating risk of encapsulating peritoneal sclerosis accounting for the competing risk of death[J]. Nephrol Dial Transplant, 2019, 34(9): 1585-1591.
[14] Tseng C C, Chen J B, Wang I K, et al. Incidence and outcomes of encapsulating peritoneal sclerosis (EPS) and factors associated with severe EPS[J]. PLoS One, 2018, 13(1): e0190079.
[15] Xia X, Qiu Y, Yu J, et al. Ten-year survival of patients treated with peritoneal dialysis: a prospective observational cohort study[J]. Perit Dial Int, 2020, 40(6): 573-580.
[16] Lu M, Ye H, Chen D, et al. Risk factors and clinical outcomes of encapsulating peritoneal sclerosis: a case-control study from China[J]. Perit Dial Int, 2022, 42(5): 505-512.
[17] 刁翔文, 余学清, 阳晓. 包裹性腹膜硬化的诊断和防治[J]. 中华肾脏病杂志, 2020, 36(10): 793-798.
Diao X W, Yu X Q, Yang X. Diagnosis and prevention and treatment of encapsulated peritoneal sclerosis[J]. Chin J Kidney Dis, 2020, 36 (10): 793-798.
[18] Kasuga H. After peritoneal dialysis discontinuation: when will we remove peritoneal dialysis catheter?[J]. J Vasc Access, 2019, 20(suppl 1): 31-34.
[19] Koc Y, Basturk T, Sakaci T, et al. Encapsulated peritoneal sclerosis: a single center, retrospective analysis of clinical manifestations, risk factors and prognosis[J]. Minerva Urol Nefrol, 2018, 70(4): 429-436.
[20] Hsu H J, Yang S Y, Wu I W, et al. Encapsulating peritoneal sclerosis in long-termed peritoneal dialysis patients[J]. Biomed Res Int, 2018, 2018: 8250589.
[21] Nakao M, Yamamoto I, Maruyama Y, et al. Risk factors for encapsulating peritoneal sclerosis: analysis of a 36-year experience in a University Hospital[J]. Nephrology, 2017, 22(11): 907-912.
[22] Srisajjakul S, Prapaisilp P, Bangchokdee S. Imaging pearls and differential diagnosis of encapsulating peritoneal sclerosis: emphasis on computed tomography[J]. Clin Imaging, 2023, 94: 116-124.
[23] Machado N O. Sclerosing encapsulating peritonitis: review[J]. Sultan Qaboos Univ Med J, 2016, 16(2): e142-e151.
[24] Vlijm A, Stoker J, Bipat S, et al. Computed tomographic findings characteristic for encapsulating peritoneal sclerosis: a case-control study[J]. Perit Dial Int, 2009, 29(5): 517-522.
[25] Chou C Y, Tseng C C, Chen J B, et al. A matrix metalloproteinase-2-based nomogram to assess the risk of encapsulating peritoneal sclerosis in peritoneal dialysis patients[J]. Biomed Res Int, 2021, 2021: 6666441.
[26] Adehin A, Kennedy M A, Soyinka J O, et al. Breast cancer and tamoxifen: a Nigerian perspective to effective personalised therapy[J]. Breast Cancer Targets Ther, 2020, 12: 123-130.
[27] Loureiro J, Sandoval P, del Peso G, et al. Tamoxifen ameliorates peritoneal membrane damage by blocking mesothelial to mesenchymal transition in peritoneal dialysis[J]. PLoS One, 2013, 8(4): e61165.
[28] Huang J W, Yen C J, Wu H Y, et al. Tamoxifen downregulates connective tissue growth factor to ameliorate peritoneal fibrosis[J]. Blood Purif, 2011, 31(4): 252-258.
[29] Yan P, Tang H, Chen X, et al. Tamoxifen attenuates dialysate-induced peritoneal fibrosis by inhibiting GSK-3β/β-catenin axis activation[J]. Biosci Rep, 2018, 38(6): BSR20180240.
[30] Silva F M O, Costalonga E C, Silva C, et al. Tamoxifen and bone morphogenic protein-7 modulate fibrosis and inflammation in the peritoneal fibrosis model developed in uremic rats[J]. Mol Med, 2019, 25(1): 41.
[31] Torres R, Ebner P, Sanhueza M E, et al. Encapsulating peritoneal sclerosis[J]. Rev Med De Chile, 2017, 145(1): 41-48.
[32] Korte M R, Fieren M W, Sampimon D E, et al. Tamoxifen is associated with lower mortality of encapsulating peritoneal sclerosis: results of the Dutch Multicentre EPS Study[J]. Nephrol Dial Transplant, 2011, 26(2): 691-697.
[33] Liakopoulos V, Georgianos P I, Vaios V, et al. 10-year-long survival in a PD patient with severe calcifying encapsulating peritoneal sclerosis treated with tamoxifen: a case report[J]. BMC Nephrol, 2020, 21(1): 110.
[34] Roy S, Alexander K, Chowdhury M H, et al. Encapsulating peritoneal sclerosis presenting after two donor kidney transplantations: a case report and literature review[J]. Case Rep Nephrol Dial, 2021, 11(2): 204-209.
[35] Reis M, Gomes A M, Santos C, et al. Encapsulating peritoneal sclerosis: from early diagnosis to successful kidney transplantation[J]. J Bras Nefrol, 2022, 44(4): 587-591.
[36] 邹艳, 张瑶, 肖伍豪, 等. 强的松联合他莫昔芬治疗难治性腹膜炎致包裹性腹膜硬化症一例[J]. 临床肾脏病杂志, 2021, 21(9): 790-792.
Zou Y, Zhang Y, Xiao W H, et al. Prednisone plus tamoxifen in the treatment of encapsulated peritoneal sclerosis caused by refractory peritonitis: one case report[J]. J Clin Nephrol, 2021, 21(9): 790-792.
[37] De Sousa-Amorim E, Del Peso G, Bajo M A, et al. Can EPS development be avoided with early interventions? The potential role of tamoxifen: a single-center study[J]. Perit Dial Int, 2014, 34(6): 582-593.
(收稿日期:2023-08-04)
(本文編辑:林燕薇)

