用于炎症治疗的磷脂酰丝氨酸修饰胞外囊泡纳米递药系统的初步构建与评价
闫洁, 常恬, 章竟, 葛广荣, 陈九源, 霍强, 程秀
(蚌埠医学院药学院, 安徽 蚌埠 233030)
炎症是机体对抗各种有害刺激的自我保护反应。当炎症反应过度或不适当时会导致多种疾病的发生,如慢性炎症性疾病、自身免疫性疾病等[1-2]。槲皮素(quercetin,Que)是一种广泛存在的天然黄酮类化合物,可以减轻炎症症状、抑制炎症反应的发生发展,具有潜在的治疗效果[3]。研究表明[4],Que能够抑制巨噬细胞向促炎M1型极化,同时减少炎性因子TNF-α、IL-6的分泌,从而抑制炎症的发展。但因其难溶于水,在体内易分解导致生物利用度低,限制了Que的应用[5]。通过纳米载体系统递送Que能够有效地改善这些不良性质,提高药物的疗效和稳定性,成为改善Que类天然药物的重要策略[6-7]。但是传统的纳米递送系统还存在着易被免疫系统清除、毒性等问题。鉴于这些缺陷,越来越多的研究者开始利用源自细胞膜材料或细胞分泌的胞外囊泡(extracellular vesicles,EVs)构建天然纳米递送载体[8-9]。作为天然生物材料,细胞及其衍生物具有良好的生物相容性和相应的生理功能(如长循环、主动趋化能力等),为载体靶向递送带来了新的转机。巨噬细胞作为机体重要的免疫细胞,在炎症反应部位会被大量招募,并通过自身的极化以及分泌的各种细胞因子调节炎症[10-11]。因此,利用巨噬细胞来源的EVs递送Que,有利于巨噬细胞对药物的同源摄取。磷脂酰丝氨酸(phosphatidylserine,PS)是一种负电荷磷脂,一般存在于细胞膜内侧,当细胞发生凋亡时,细胞会生成凋亡小体,同时PS外翻,释放凋亡信号,促进炎症部位招募巨噬细胞的摄取吞噬[12-13]。在本研究中,通过将PS修饰到EVs的表面模拟凋亡小体,促进EVs被巨噬细胞吞噬摄取。因此,本研究通过PS修饰的EVs递送Que(PS-EVs@Que)提高药物的稳定性和生物利用度,旨在为炎症治疗方面的制剂开发提供新的参考与建议。
1 材料与方法
1.1 细胞株及主要试剂
RAW264.7巨噬细胞(上海科学院);胎牛血清(美国Gibco公司);DMEM培养基(大连美仑生物科技有限公司);BCA蛋白定量试剂盒、青霉素-链霉素溶液、DiO荧光染料、脂多糖(LPS)、辣根过氧化物酶标记山羊抗兔IgG(H+L)、辣根过氧化物酶标记山羊抗小鼠IgG(H+L)、ELISA试剂盒(江苏碧云天生物技术公司);兔抗TSG101、鼠抗CD81、鼠抗CD63(Proteintech Group生物技术有限公司);兔抗iNOS单克隆抗体(美国Abcam公司);PS和Que(上海阿拉丁生化科技股份有限公司)。
1.2 细胞培养
巨噬细胞(RAW264.7)培养于含10%的胎牛血清和1%的青霉素-链霉素溶液DMEM培养基中,置于37 ℃,5%的CO2细胞培养箱中培养。
1.3 提取RAW264.7细胞的EVs
RAW264.7细胞生长至70%~80%融合度时,更换培养基为无血清培养基,继续培养48 h后收集细胞上清液,上清液在4 ℃条件下,300×g离心10 min、2 000×g离心20 min、10 000×g离心30 min、100 000×g离心70 min。舍弃上清液,用PBS重悬沉淀得到巨噬细胞来源的EVs溶液,-80 ℃冰箱保存备用。
1.4 RAW264.7细胞来源EVs的表面标志物鉴定
提取的EVs与上样缓冲液混匀,95 ℃加热5 min使蛋白变性。将样品和蛋白标准参照物按顺序依次缓慢加入含有预先配置的凝胶加样孔中,进行电泳(75 V、30 min,100 V、90 min)电泳结束后,取出凝胶,将蛋白转移至PVDF膜上。然后加入待检测蛋白对应的一抗(抗TSG101、CD81、CD63),4 ℃孵育过夜。洗膜后,室温条件下分别孵育对应的辣根过氧化物酶标记山羊抗兔IgG或山羊抗小鼠IgG二抗2 h,再次洗膜后与发光剂反应并使用化学发光成像系统曝光并拍照。
1.5 PS-EVs@Que的制备
离心管内加入100 μL EVs溶液(1 mg/mL),再向管中加入100 μL PBS稀释后的Que(1 mg/mL)甲醇溶液。将上述离心管悬浮在超声仪中进行脉冲式间隔超声(120 W,30 s),超声载药后取出置于冰上冰浴10 min。重复3次,将离心管放入37 ℃恒温水浴锅内,孵育1 h以恢复EVs的膜稳定性。将液体转移至超滤管(截留分子量100 kD)中离心,补充100 μL PBS至超滤管内重悬后反复超滤,最终在上层内管得到EVs@Que。然后将20 μL PS(1 mg/mL)加到EVs@Que中,混匀后在37 ℃恒温箱中孵育30 min。利用超滤管滤除多余的PS最终得到PS-EVs@Que。
1.6 仿生纳米药物的表征
1.6.1 EVs、EVs@Que、PS-EVs@Que纳米颗粒追踪分析(NTA)检测 取EVs、EVs@Que、PS-EVs@Que溶液,用PBS稀释至测量浓度,采用ZetaView纳米颗粒追踪分析仪(德国PMX公司)测量样品的粒径,重复3次。
1.6.2 EVs、EVs@Que、PS-EVs@Que透射电镜(TEM)检测 制备得到的EVs、EVs@Que、PS-EVs@Que溶液适当稀释后,分别取5 μL滴加在200目有碳支持膜的铜网上,常温放置2 h,干燥后用透射电镜观察样品的结构。
1.7 聚丙烯酰胺凝胶电泳(SDS-PAGE)分析
将EVs、EVs@Que、PS-EVs@Que提取蛋白后进行BCA定量,按一定比例与上样缓冲液混合均匀,95 ℃加热5 min使蛋白变性。将样品和蛋白标准参照物按顺序依次缓慢加入含有预先配置的凝胶加样孔中进行电泳(75 V、30 min,100 V、90 min)。结束后取出凝胶,用快速考马斯亮蓝染色液染色30 min,脱色2 h后拍照并分析。
1.8 仿生纳米药物的制剂评价
1.8.1 检测波长的选择 称取一定质量的Que,用甲醇溶液稀释,用紫外分光光度计进行扫描确定其检测波长。
1.8.2 Que标准曲线的制备 用甲醇溶解Que配制成1 mg/mL的溶液,稀释成2.6、4.2、5.7、7.3、8.8、10.4 μg/mL的Que标准工作液。用紫外分光光度计测定标准工作液在369 nm波长处的光密度(D),并绘制标准曲线。
1.8.3 包封率与载药量的测定 按“1.5”的方法制备出PS-EVs@Que,通过BCA定量确定EVs(1 mg/mL)的量,加入100 μL不同浓度的Que(Que的加入量设为20、40、60、80、100、200、400 μg),超声载药处理后将PS加到EVs@Que中,混匀孵育后将所得药物在超滤管中离心,分离EVs和未被包封的Que,用紫外分光光度计测定下层管中含游离Que溶液D(369 nm)值,根据Que溶液的标准曲线,计算出游离药物质量。按以下公式计算包封率EE(%)和载药量DLC(%):
EE(%)=(Wtotal-Wfree)/Wtotal×100%
DLC(%)=(Wtotal-Wfree)/Ntotal×100%
式中,Wtotal:Que的投药量;Wfree:溶液中游离的Que质量;Ntotal:包载Que的纳米粒的总质量
1.9 CCK-8实验检测Que对巨噬细胞的毒性
将巨噬细胞接种于96孔板中,培养箱培养过夜后加入含不同浓度Que的培养基,继续培养24 h后每孔加入10 μL CCK-8试剂培养箱孵育1 h,酶标仪检测450 nm处的D值,空白培养基作为对照组。按以下公式计算细胞活力:

1.10 PS-EVs@Que的细胞摄取实验
取适量稀释好的亲脂性DiO染料分别添加到载药修饰的EVs中,置于37 ℃下避光孵育1 h,使用超速离心机在4 ℃下120 000×g离心70 min去除上清液中多余未结合的染料,得到DiO标记的EVs@Que和PS-EVs@Que。RAW264.7细胞接种在共聚焦小皿中,细胞培养箱中过夜使其贴壁,分别向共聚焦小皿中加入DiO标记的EVs@Que和PS-EVs@Que,分别置于细胞培养箱中避光孵育4 h。4%多聚甲醛固定细胞后用Hoechst 33258染细胞核,在激光共聚焦显微镜下观察巨噬细胞对EVs的摄取情况。
1.11 蛋白质印迹法检测巨噬细胞中极化标志物iNOS的蛋白表达
取对数生长期的RAW264.7细胞种板,将细胞分为对照组、LPS组、LPS+EVs@Que组、LPS+PS-EVs@Que组,除对照组外,其余各组均使用LPS(1 μg/mL)刺激巨噬细胞4 h后,给药组分别给予EVs@Que、PS-EVs@Que(Que含量20 μmol/L)处理巨噬细胞4 h;更换新的培养基继续培养12 h,细胞刮收集细胞,PBS洗涤后置于冰上裂解30 min,4 ℃、12 000 r/min离心30 min。采用BCA法测定蛋白浓度后,取蛋白样品加入适量上样缓冲液,于SDS-PAGE分离,然后将凝胶上的蛋白转移至PVDF膜上,室温封闭后将膜与一抗iNOS抗体4 ℃孵育过夜,洗膜后再加入相应二抗室温孵育2 h,再次洗膜后与发光剂反应并使用化学发光成像系统曝光并拍照。应用Image J分析软件检测并分析条带的灰度值。
1.12 ELISA法检测IL-6和TNF-α的浓度
取对数生长期的RAW264.7细胞种板,将细胞分为对照组、LPS组、LPS+Que组、LPS+EVs@Que组、LPS+PS-EVs@Que组,除对照组外,其余各组均使用LPS(1 μg/mL)刺激巨噬细胞4 h后,给药组分别给予Que、EVs@Que、PS-EVs@Que(Que含量20 μmol/L)处理巨噬细胞4 h;更换新的培养基继续培养12 h,铺板干预后收集各组细胞培养上清液,根据说明书应用ELISA试剂盒检测RAW264.7细胞培养上清液中IL-6和TNF-α的含量。
1.13 统计学分析
2 结果
2.1 RAW264.7细胞EVs的鉴定
透射电子显微镜观察到EVs形态呈圆形或类圆形双层膜杯状结构,粒径大小在100 nm左右。NTA结果显示EVs粒径主要分布在(104.06±2.15)nm。使用蛋白免疫印迹法检测EVs的标志蛋白表达,结果显示EVs阳性表达标志性蛋白TSG101、CD81和CD63,并且EVs上清液中蛋白表达呈阴性。验证了RAW264.7细胞来源EVs的成功提取。见图1。

A:透射电子显微镜下观察EVs结构形态;B:NTA检测EVs颗粒直径;C:蛋白质印迹检测EVs表面标志蛋白TSG101、CD81、CD63
2.2 EVs@Que和PS-EVs@Que的粒径分布及形态学考察
EVs形态均呈双层膜杯状结构,载药后EVs@Que粒径为(110.53±1.15)nm,经PS修饰后粒径增至(118.45±0.97)nm,载药修饰后EVs的粒径逐渐增大,形态没有明显变化,均呈类圆形。EVs@Que及PS-EVs@Que蛋白染色条带与EVs染色的蛋白位置相似,颜色基本一致,表明修饰载药后EVs的基本蛋白被很好地保留下来。见图2。

A:透射电子显微镜下对比超声处理载药及修饰前后的EVs结构形态;B:NTA分析超声载药及修饰前后EVs颗粒直径变化;C:考马斯蓝染色对比载药前后EVs表面蛋白的变化
2.3 PS-EVs@Que的制剂学评价
2.3.1 Que检测波长的确定 紫外分光光度计扫描200~600 nm波长范围内紫外吸收,结果如图3所示,确定其紫外吸收峰在369 nm处。

图3 Que光密度曲线
2.3.2 Que标准曲线的建立 以Que的浓度为横坐标,D值为纵坐标,对测定结果做线性回归曲线,得到Que的标准曲线。如图4所示,Que的标准曲线为y=0.086 4x+0.014 3,R2=0.999,Que浓度在0~10.4 μg/mL范围内线性关系良好。
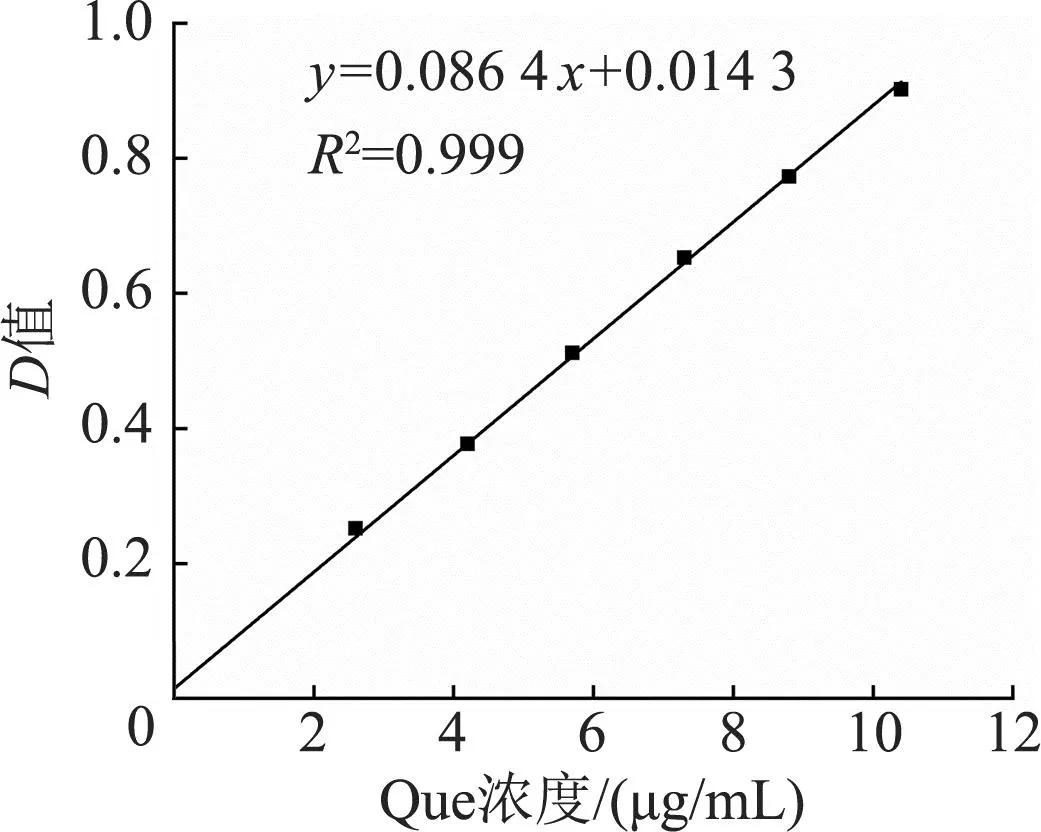
图4 Que标准曲线
2.3.3 PS-EVs@Que载药量和包封率的测定 如图5所示,随着Que加入量的增加,PS-EVs@Que的载药量逐渐上升,包封率呈下降趋势,但由于EVs载药有限,载药量增加到一定程度后几乎不变。设置不同的投药量,比较不同浓度Que对载药量和包封率的影响,当Que投药量为100 μg时,具有较高的包封率和载药量,分别为(20.08±0.52)%和(8.59±0.16)%,因此选择此投药量进行后续实验。

图5 PS-EVs@Que载药量和包封率
2.4 Que对巨噬细胞的毒性作用
如图6所示,当Que浓度在0~20 μmol/L时巨噬细胞活力较高,当Que浓度在40~200 μmol/L时细胞活力明显下降(P<0.01)。因此综合考虑选择20 μmol/L的Que用于后续实验。
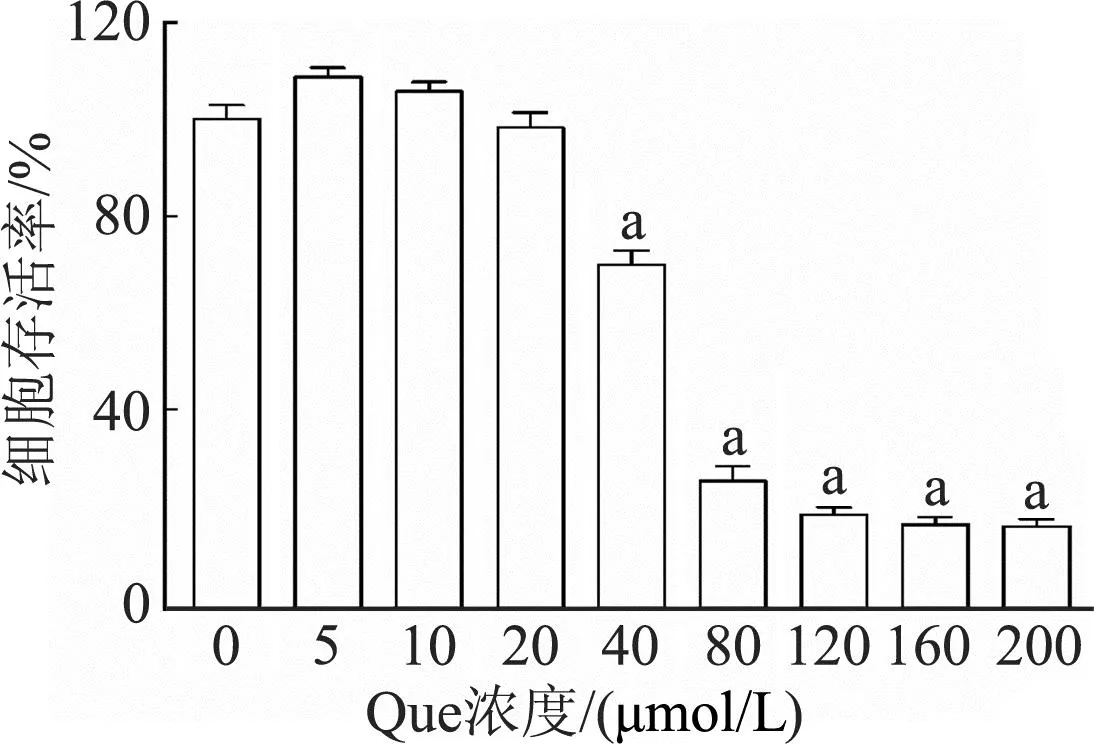
a:P<0.01,与0 μmol/L比较图6 Que对巨噬细胞的24 h细胞毒性
2.5 PS-EVs@Que的细胞摄取情况
共聚焦显微镜结果显示(图7),PS修饰的EVs@Que纳米递药系统比无修饰的EVs@Que绿色荧光更强(P<0.01),表明PS修饰能增强EVs@Que的被摄取能力。
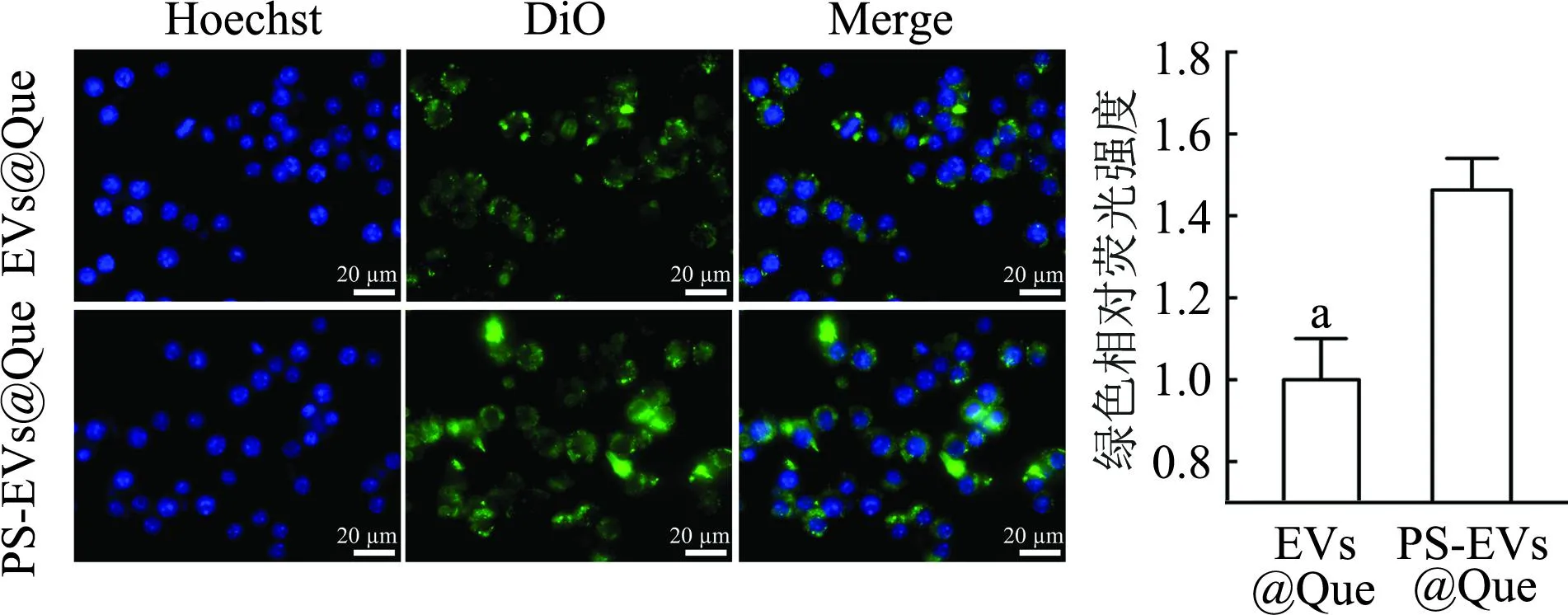
a:P<0.01,与PS-EVs@Que组比较
2.6 巨噬细胞中极化标志物iNOS的蛋白表达差异
如图8所示,PS-EVs@Que相比于其他组巨噬细胞的iNOS蛋白表达明显降低(P<0.01),结果表明PS-EVs@Que对M1型巨噬细胞的抑制作用明显强于EVs@Que组,显示出更强的抑制炎症效果。
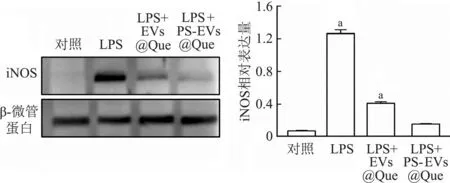
a:P<0.01,与LPS+PS-EVs@Que组比较
2.7 巨噬细胞培养基中炎症因子的表达差异
如图9所示,PS-EVs@Que组细胞培养上清液中的IL-6和TNF-α表达水平显著降低。PS-EVs@Que组的炎症因子的表达明显低于EVs@Que组(P均<0.01)。结果表明PS-EVs@Que处理组对炎症因子分泌的抑制作用更强,起到更好的抑制炎症作用。
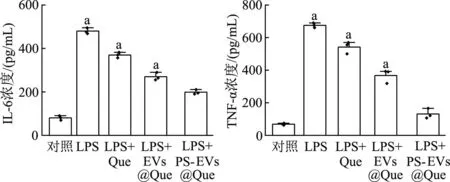
a:P<0.01,与LPS+PS-EVs@Que组比较
3 讨论
炎症是人体抵御外源性入侵物或调节机体免疫反应失调必不可少的防御手段。但如果任由炎症过度发展,则会导致组织向病理性纤维化发展,使正常的组织功能受损[14]。巨噬细胞是免疫细胞中一种关键的细胞类型,在炎症的发展中发挥重要作用。其中,促炎M1型巨噬细胞能快速清除入侵病原体,启动炎症反应以保护宿主,但过量也会损害组织再生、影响伤口愈合,造成宿主损伤[15]。因此可以通过调整巨噬细胞极化的表型治疗炎症。例如,减少巨噬细胞向促炎M1型极化。Que作为一种天然黄酮类化合物具有抗炎等生物学效应,能够抑制巨噬细胞向M1型极化。然而,由于其在体内的半衰期短和生物利用度低,因此在制药领域的应用受到限制[16]。EVs具有独特的生物相容性、较好的稳定性、具备物质负载能力和对细胞的高亲和力,被视为药物分子的最佳载体[17]。因此,将载体与Que联合应用能够在一定程度上解决Que稳定性不足与生物利用度低等问题。并且,通过表面修饰PS能够将EVs伪装成凋亡小体,进一步增强其被巨噬细胞快速识别和吞噬摄取的能力,以提高巨噬细胞对纳米粒子的摄取效率[18]。
本研究成功提取了巨噬细胞(RAW264.7)来源的EVs,并且采用超声技术将Que装载至EVs中,进而将PS修饰到载有Que的EVs上制备得到PS-EVs@Que。实验结果显示,经超声载药处理后的囊泡,在形态、标志蛋白表达以及功能上并无明显变化,并且修饰载药后粒径逐渐增大。同时,PS-EVs@Que的药物载药量达到了8.59%。摄取结果显示,PS-EVs@Que的摄取效率明显高于无修饰EVs@Que。初步证实了经PS修饰的EVs@Que可以增强药物被细胞摄取的能力。蛋白印迹和ELISA结果表明,PS-EVs@Que显著抑制了巨噬细胞的M1型极化,降低了促炎因子的表达。
综上所述,本研究初步构建了纳米药物PS-EVs@Que,证明了PS-EVs@Que能够更好地被巨噬细胞吞噬摄取,从而抑制巨噬细胞向促炎M1表型转化、降低其促炎因子的分泌,进而达到更好抑制炎症的效果。此外,纳米载体(PS-EVs@Que)的成功构建为提高Que的稳定性与生物利用度提供了一种有效的策略,同时也为扩展天然化学药物与天然载体之间联合应用提供了参考与理论依据。

