转铁蛋白受体亲和肽衍生物的制备
于家乐,李松涛,赵桂琴
(承德医学院 中药研究所 河北省中药研究与开发重点实验室,河北 承德 067000)
临床上常用的化疗药物对肿瘤组织细胞的选择性差,导致患者出现脱发、白细胞减少、免疫力下降等一系列严重的毒副反应,限制了其在临床上的应用[1-2]。因此,提高抗肿瘤药物对肿瘤组织细胞的选择性尤为必要。
受体介导的药物靶向递送是抗肿瘤药物研究领域的重要方向之一。转铁蛋白受体(transferrin receptor,TfR)可以与转铁蛋白特异性结合并介导后者的胞吞,其功能是参与维持机体铁离子平衡和调节细胞生长[3-4]。研究表明,肿瘤细胞快速增殖对铁离子的需求量增大,导致TfR在脑部肿瘤、乳腺癌及肺癌等多种肿瘤细胞表面的表达量较正常细胞显著提高[5],使得TfR成为抗肿瘤药物靶向递送的作用靶点[6]。
TfR亲和肽(TfR binding peptide,TfRBP,肽序列:HAIYPRH)[7]与TfR的结合位点不同于转铁蛋白[8],其与TfR的结合活性不受内源性转铁蛋白的竞争性抑制,被认为是一种理想的TfR靶向配体。作者采用Fmoc固相合成法制备一种TfRBP氮末端连接半胱氨酸(Cys)的衍生物(肽序列:CHAIYPRH),以Cys的侧链巯基作为活性反应位点偶联抗肿瘤药物,实现其作为TfR靶向给药载体的功能,为进一步构建TfR靶向多肽-药物偶联物奠定基础。
1 实验
1.1 试剂与仪器
2-氯三苯甲基氯(2-CTC)树脂(取代度1.2 mmol·g-1),天津南开和成科技有限公司;N-芴甲氧羰基-N′-三苯甲基-L-组氨酸[Fmoc-His(Trt)-OH]、N-芴甲氧羰基-(N′-2,2,4,6,7-五甲基二氢苯并呋喃-5-磺酰基)-L-精氨酸[Fmoc-Arg(Pbf)-OH]、N-芴甲氧羰基-L-脯氨酸(Fmoc-Pro-OH)、N-芴甲氧羰基-O-叔丁基-L-酪氨酸[Fmoc-Tyr(tBu)-OH]、N-芴甲氧羰基-L-异亮氨酸(Fmoc-Ile-OH)、N-芴甲氧羰基-L-丙氨酸(Fmoc-Ala-OH)、N-芴甲氧羰基-S-三苯甲基-L-半胱氨酸[Fmoc-Cys(Trt)-OH],成都新诚诺科技有限公司;甲醇、乙腈,色谱纯;其它试剂均为市售分析纯。
U3000型高效液相色谱仪,美国Thermo Fisher公司;安捷伦 6420型液质联用仪,美国Agilent公司;Newstyle型反相半制备高效液相色谱仪,苏州汉邦科技有限公司;CHRIST冻干机,北京博励行仪器有限公司;L530型低速离心机,湖南湘仪实验室仪器开发有限公司;Quintix124-1CN型分析天平,赛多利斯科学仪器北京有限公司;BUCHI R-300型旋转蒸发仪,青岛佳鼎分析仪器有限公司;MS-H280-Pro型数显加热磁力搅拌器,北京大龙兴创实验仪器有限公司。
1.2 方法
1.2.1 Fmoc-组氨酸-CTC树脂的合成
将经N,N-二甲基甲酰胺(DMF)溶胀后的2-CTC树脂(0.83 g,1 mmol)置于干燥的反应柱中,依次加入DMF(5 mL)、Fmoc-His(Trt)-OH(1.87 g,3 mmol)和N,N-二异丙基乙胺(DIPEA,0.52 mL,3 mmol);室温下氮气鼓动反应2 h,抽滤,分别用DMF和二氯甲烷(DCM)洗涤3次;加入20 mL封闭液DCM-甲醇-DIPEA(80∶15∶5,体积比,下同),封闭2次,每次15 min;抽滤去除封闭液,分别用DMF和DCM洗涤3次,得到Fmoc-组氨酸-CTC树脂。
1.2.2 TfRBP衍生物全保护肽树脂的合成
向Fmoc-组氨酸-CTC树脂中加入体积分数20%的哌啶/DMF溶液(15 mL)去Fmoc保护2次,抽滤,分别用DMF和DCM洗涤3次;茚三酮检测呈蓝色,表明组氨酸氨基上的Fmoc保护基团已被成功脱除;向脱除Fmoc保护的组氨酸-CTC树脂中加入DMF(10 mL)、Fmoc-Arg(Pbf)-OH(1.95 g,3 mmol)、N,N′-二异丙基碳二亚胺(DIC,0.46 mL,3 mmol)和1-羟基苯并三唑(HOBt,0.41 g,3 mmol),室温反应3 h;茚三酮检测呈无色,表明氨基酸偶联完成;抽滤,分别用DMF和DCM洗涤3次。重复上述脱Fmoc保护与氨基酸偶联过程,将剩余氨基酸连接到树脂上,得到TfRBP衍生物全保护肽树脂,用甲醇收缩2次,真空减压干燥后,备用。Fmoc保护氨基酸的用量见表1。

表1 Fmoc保护氨基酸的用量
1.2.3 TfRBP衍生物全保护肽树脂的裂解
将TfRBP衍生物全保护肽树脂置于干燥的反应容器中,加入20 mL裂解试剂三氟乙酸-1,2-乙二硫醇-水-三异丙基硅烷(94∶2.5∶2.5∶1),室温反应2 h后抽滤;将滤液缓慢滴入冰乙醚(50 mL)中,离心后弃去上清液,沉淀用冰乙醚洗涤(20 mL×3),真空减压干燥,得到TfRBP衍生物粗品。
1.2.4 TfRBP衍生物粗品的纯化
采用半制备高效液相色谱法对TfRBP衍生物粗品进行纯化。色谱条件:Hedera ODS-2反相半制备C18色谱柱(20 mm×250 mm,10 μm);流动相为0.2%醋酸水溶液(A)-乙腈(B),梯度洗脱程序:0~30 min,10%B~30%B;30~30.1 min,30%B~10%B;30.1~40 min,10%B;流速10 mL·min-1;检测波长215 nm。分段收集主峰,合并相同流分,用旋转蒸发仪减压浓缩,冷冻干燥,得到0.41 g白色絮状固体,即TfRBP衍生物纯品。
2 结果与讨论
2.1 HPLC分析
将TfRBP衍生物纯品(1 mg)溶解于1 mL超纯水中,经0.45 μm微孔滤膜过滤后进行HPLC分析。色谱条件[9]:Venusil ASB C18反相色谱柱(4.6 mm×250 mm,5 μm);流动相为0.1%三氟乙酸水溶液(A)-含0.1%三氟乙酸的乙腈溶液(B),梯度洗脱程序:0~20 min,5%B~95%B;20~20.1 min,95%B~5%B;20.1~25 min,5%B;流速1 mL·min-1;检测波长215 nm;柱温35 ℃。TfRBP衍生物纯品的HPLC图谱见图1。
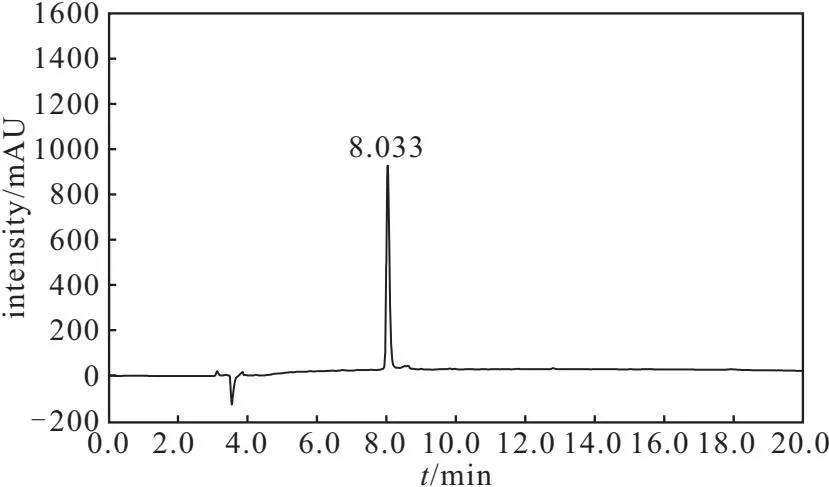
图1 TfRBP衍生物纯品的HPLC图谱Fig.1 HPLC spectrum of pure TfRBP derivative
由图1可知,主峰的保留时间为8.033 min,TfRBP衍生物纯品的纯度为97.9%(峰面积归一化法),总收率为40.3%。
2.2 ESI-MS分析
TfRBP衍生物纯品的ESI-MS图谱见图2。
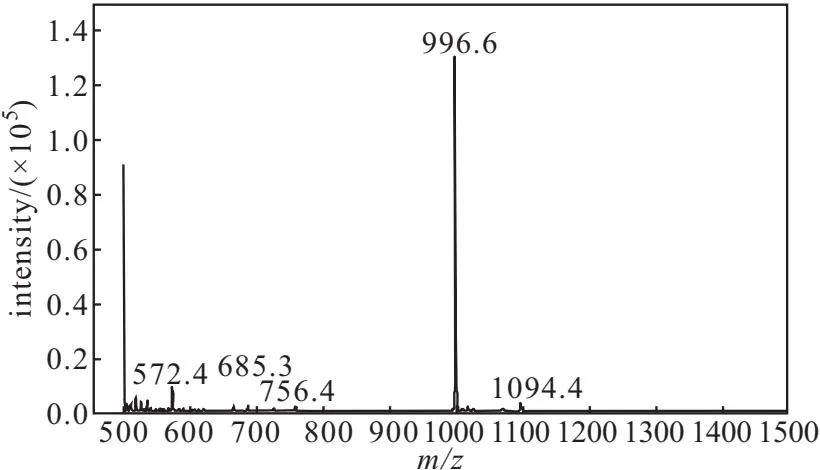
图2 TfRBP衍生物纯品的ESI-MS图谱Fig.2 ESI-MS spectrum of pure TfRBP derivative
由图2可知,TfRBP衍生物纯品的ESI-MS(m/z)数据:996.6 [M+H]+,其相对分子质量与理论值(997.1 [M+H]+)一致。
2.3 讨论
在氨基酸偶联过程中需加入过量的反应原料,原料浓度较高有利于正向反应的进行,可缩短氨基酸偶联反应时间,提高氨基酸偶联效率,使整个合成过程能够快速、高效地进行。在Fmoc-组氨酸-CTC树脂的合成过程中,需使用封闭液对树脂进行封闭,这样可以将树脂上未能与组氨酸反应的活性位点进行填充,当加入下一种氨基酸时,其只能与组氨酸上脱去Fmoc保护的氨基反应,以保证全保护肽树脂合成结束后所连接的首个氨基酸的正确性。
Fmoc固相合成法常用三氟乙酸进行切肽和脱除侧链保护基团。在切割TfRBP衍生物全保护肽树脂时,侧链保护基团脱除后会释放大量具有高反应活性的碳正离子,若这些离子没有被及时吸附,就会与TfRBP衍生物的Tyr和Cys的亲核性侧链发生副反应[10]。为避免上述问题,在裂解过程中需添加清除剂以吸附碳正离子。其中含硫试剂1,2-乙二硫醇在裂解过程中对碳正离子具有极强的吸附能力,水是针对tBu、Trt、Pbf常用的捕获剂,三异丙基硅烷可避免非芳香性氨基酸在裂解过程中发生副反应。因此,采用三氟乙酸、1,2-乙二硫醇、水和三异丙基硅烷组成的混合试剂对全保护肽树脂进行裂解。
与液相多肽合成法相比,Fmoc固相合成法具有反应条件温和、氨基酸保护基选择多、合成方便、工作量小、易实现自动化、合成规模易放大等优点,但也存在固相树脂载体上的中间体杂肽无法及时分离、目标产物需采用反相高效液相色谱等方法进行纯化等缺点。
3 结论
采用Fmoc固相合成法成功制备了TfRBP衍生物,其纯品的HPLC纯度为97.9%,总收率为40.3%,经ESI-MS鉴定其相对分子质量与理论值一致。该方法具有操作简便、合成周期短、总收率高等优点,为肿瘤靶向多肽类配体的制备提供了参考,也为进一步构建TfR靶向多肽-药物偶联物奠定了基础。

